从江香猪CYP1A2基因4个外显子的多态性
杨家大,任 琼,吴声榕
(1.凯里学院环境与生命科学学院,贵州凯里556011;2.贵州省从江县农业局,贵州从江557400;3.凯里学院图书馆,贵州凯里556011)
从江香猪CYP1A2基因4个外显子的多态性
杨家大1,任 琼2,吴声榕3
(1.凯里学院环境与生命科学学院,贵州凯里556011;2.贵州省从江县农业局,贵州从江557400;3.凯里学院图书馆,贵州凯里556011)
为探明从江香猪细胞色素P450氧化酶CYP1A2基因的标签SNPs,以及积累从江香猪药物代谢酶的基础资料,采用直接测序法对从江香猪CYP1A2基因外显子1、4、5和6进行多态性分析。结果表明:第1外显子存在11个多态位点(g.98G→A、g.147C→G、g.189C→T、g.198C→T、g.211A→G、g.231C→T、g.328T→C、g.338C→A、g.352T→C、g.458G→A和g.778G→A),优势基因型分别为GG、CC、TT、CC、GG、CC、CC、AA、CC、AA和AA,优势等位基因分别为G、C、T、C、G、C、C、A、C、A和A,多态信息含量为0.073 2~0.160 0,有效等位基因数为1.082 3~1.212 7,纯合度为0.827 3~0.920 9,杂合度为0.079 1~0.172 7,香农信息指数为0.166 6~0.318 7,群体处于Hardy-Weinberg平衡状态(P>0.05)。第4外显子存在1个多态位点g.1087C→G,优势基因型为CC,优势等位基因为C,多态信息含量为0.3642,有效等位基因数为1.918 8,纯合度为0.673 8,杂合度为0.326 2,香农信息指数为0.671 8,群体偏离Hardy-Weinberg平衡(P<0.05)。第5、6外显子未发现多态性。从江香猪CYP1A2基因第1外显子多态位点丰富,位点纯合度高、变异性小,具备药物代谢动物模型开发的良好基础,但多态信息含量不足,连锁分析或关联分析时需谨慎选择。第4外显子多态位点少,但位点的多态信息含量合适,可用作连锁分析及关联分析的标签SNP。
从江香猪;CYP1A2;标签SNPs;多态性
猪尤其是小型猪在组织器官结构及生理生化指标等方面与人相似[1],食性也与人类接近,且其实验伦理问题不及灵长类动物和犬突出,加上易繁殖,生产成本较低,已广泛用作医学实验动物模型。从江香猪产于贵州省从江县,是我国稀有的优良地方微型猪种,具有个体矮小、近交程度高、外形均一、性格温驯、与人亲近等优良特性,是培育实验动物的理想资源[2],在疾病模型、新药临床前评价、食品安全、异种器官移植等领域具有一定的应用前景。
细胞色素P450氧化酶(Cytochrome P450enzymes,CYP)是存在于肝脏的微粒体混合功能氧化酶系的主要成分,是一组由许多同工酶组成的超基因大家族,对体内许多内源性物质和外源性化合物的生物转化有重要作用[3]。CYP1A是其亚家族之一,人体内包含CYP1A1和CYP1A2。CYP1A1是一种芳香烃羟化酶,主要参与代谢活化多环芳烃类致癌物,在外源物代谢中占2.5%,分布在肺、皮肤、胃肠道、淋巴、胎盘、喉和脑等,在肝脏含量很低[45]。CYP1A2则主要存在于肝脏,其含量占肝脏总CYP的13%,在脑、肺、肠道等组织也有少量分布。CYP1A2与药物代谢关系密切,参与咖啡因、非那西丁、醋氨酚、17β-雌二醇、普洛萘尔、维拉帕米、硝苯地平、丙咪嗪、茶碱等20多种药物的代谢,约占CYP代谢药物总量的4%。此外,CYP1A2还在10多种前致癌物的代谢激活或灭活中发挥重要作用,其活性变化与药物的药效或毒理相关[67]。猪及小型猪肝脏存在人CYP1A2的同源酶[89]。国内小型猪品系巴马香猪和贵州小型香猪的肝微粒体也检测到人CYP1A2样酶[1011]。猪CYP1A2活性具有性别差异,雄性低于雌性[1213],雌性与去势公猪相当[13],去势公猪高于雄性猪[14]。在mRNA和蛋白质水平,去势公猪也高于非去势公猪[15]。在猪肝脏或原代培养肝细胞[1617]、心房、心室及冠状动脉[1820],CYP1A2均可被β-萘黄酮诱导,而在呼吸道及嗅黏膜、大脑皮质、小脑、中脑和海马没有诱导作
用[18-20]。
P450的遗传多态性是造成不同个体对同一药物反应差异的主要原因之一,是人类个体化用药方案的重要理论依据[21]。在导致人CYP1A2活性个体差异的因素中,基因多态性起决定性作用[22],目前已发现4个单核苷酸多态性可以影响人CYP1A2的活性[3]。NCBI数据库显示,猪CYP1A2基因DNA序列登录号为NC_010449.4,全长6 596bp,由6个外显子、5个内含子和上下游调控序列组成,共发现228个SNP;CDS全长1 551bp,包含24个错义突变和25个同义突变。其中,第1外显子长831个核苷酸,编码277个氨基酸;包含25个SNP,11个为错义突变。第2外显子长121个核苷酸,编码(含参加编码)41个氨基酸;包含3个SNP,1个为错义突变。第3外显子长90个核苷酸,编码(含参加编码)31个氨基酸;包含1个SNP,且此SNP为错义突变。第4外显子长124个核苷酸,编码(含参加编码)42个氨基酸;包含10个SNP,5个为错义突变。第5外显子长87个核苷酸,编码(含参加编码)30个氨基酸;包含3个SNP,2个为错义突变。第6外显子长298个核苷酸,编码(含参加编码)100个氨基酸;包含7个SNP,4个为错义突变。因此,猪CYP1A2基因cSNP主要分布于外显子1、4、5和6。目前,猪CYP1A2基因所有SNP位点均未登记有等位基因频率,也未见有关等位基因频率的文献报道。鉴于此,应用直接测序法分析从江香猪CYP1A2基因第1、4、5和6外显子的单核苷酸多态性,以获取这些位点的群体遗传学数据,为CYP1A2标签SNPs的筛选提供参考依据,为从江香猪药物代谢模型的开发提供基础资料。
1 材料与方法
1.1 组织样品
从江香猪141头,来自贵州省从江县宰便、加鸠、加勉、光辉、加榜和刚边等乡镇,健康无病,2~3月龄,体重8~11kg。屠宰后取出肝脏组织,经生理盐水冲洗血污后,置液氮中冻存。
1.2 肝脏DNA的提取
取5~20mg肝脏,加液氮研磨成粉末,转移至1.5mL离心管中,按照离心柱型细胞/组织基因组DNA提取试剂盒(上海捷瑞生物工程有限公司,GK0122)说明书提取DNA,稀释至5~10ng/μL备用。
1.3 引物的设计与合成
根据猪CYP1A2基因(登录号:NC_010449.4)DNA序列及其第1、4、5和6外显子的位置,应用primer premier 5.0设计PCR引物(表1),由上海捷瑞生物工程有限公司合成。
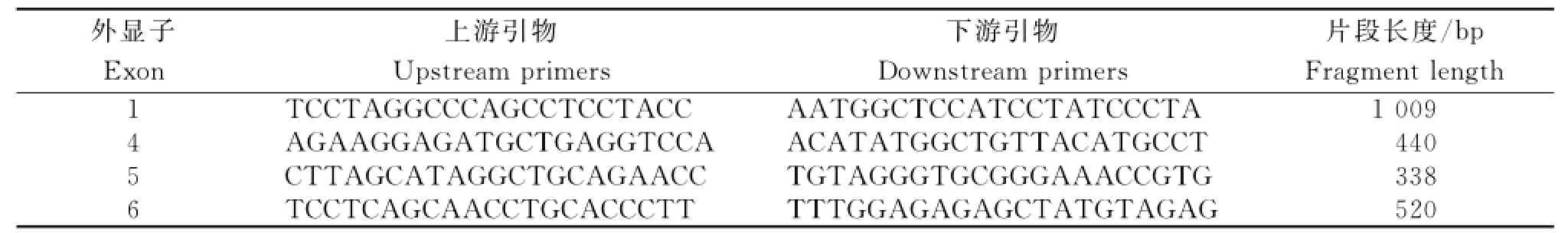
表1 CYP1A2基因4个外显子的PCR引物信息Table1 PCR primer informations of four exons of gene CYP1A2
1.4 PCR扩增
反应体系50μL:基因组DNA 1μL,10×buffer 5μL,25mmol/L MgCl25μL,10mmol/L dNTP 1μL,10μmol/L上、下游引物各1μL,5U/μL Taq DNA聚合酶1μL,加去离子水补足至50μL。反应程序:94℃预变性3min;94℃变性15s,55℃退火15s,72℃延伸30s,35个循环;72℃延伸3min。
1.5 扩增产物的电泳及纯化
PCR产物经2%琼脂糖凝胶电泳后,切割目的条带,按照PCR产物纯化试剂盒(上海捷瑞生物工程有限公司,GK2051)进行纯化。
1.6 DNA测序
PCR产物回收纯化后,由上海捷瑞生物工程有限公司测序,平台为ABI 3730XL DNA序列分析仪,测序方法为sanger法。
1.7 基因型判定
应用ContigExpress Application(InforMax公司)打开测序生成后缀为“ab1”的文件,得到测序图谱。测序图谱经拼接后,如果某一核苷酸位置在不同个体之间出现2种或2种以上颜色波峰即视为多态位点。多态位点是单一波峰的个体为纯合子,是2个波峰的个体为杂合子。测序峰图颜色与碱基(核苷酸)的对应关系:A-绿色,T-红色,C-蓝色,G-黑色。
1.8 统计分析
采用基因计数法计算基因型频率,用软件Pop-Gen 32统计等位基因频率、有效等位基因数、纯合度、杂合度、香农信息指数、多态位点数以及Hardy-Heinberg平衡的χ2值和P值,用软件PIC_Calc 0.6计算多态信息含量(polymorphism information content,PIC)。
2 结果与分析
2.1 PCR扩增
经2%琼脂糖凝胶电泳发现,第1、4、5和6外显子的扩增产物片段大小均与预期结果一致,且条带清晰明亮、无杂带(图1),说明扩增具有特异性,PCR产物可用于后续试验。

图1 CYP1A2基因4个外显子PCR产物的电泳图谱Fig.1 Electropherogram of PCR products of four exons of gene CYP1A2
2.2 基因测序及基因型
第1外显子共有139份从江香猪样品获得测序结果,发现11个变异,分别为g.98G→A、g.147C→G、g.189C→T、g.198C→T、g.211A→G、g.231C→T、g.328T→C、g.338C→A、g.352T→C、g.458G→A和g.778G→A。经NCBI数据库检索,这些变异均已有登记,对应的SNP位点分别为rs696347208、rs330578830、 rs341454408、rs325811564、rs343586092、rs336994947、rs328324843、rs343560684、rs334669395、rs345763403和rs321841283。g.98G→A位点的基因型分别为GG和GA,g.147C→G位点分别为CC、CG和GG,g.189C→T位点分别为CC、CT和TT,g.198C→T位点分别为CC、CT和TT,g.211A→G位点分别为AA、AG和GG,g.231C→T位点分别为CC、CT和TT,g.328T→C位点分别为TT、TC和CC,g.338C→A位点分别为CC、CA和AA,g.352T→C位点分别为TT、TC和CC,g.458G→A位点分别为GG、GA和AA,g.778G→A位点分别为GG、GA和AA(图2)。
第4外显子有141份从江香猪样品获得测序结果,发现1个变异,即g.1087C→G,该变异在NCBI数据库中也有登记,对应SNP位点为rs334218835。g.1087C→G位点的基因型分别为CC、CG和GG(图3)。第5、6外显子在所有从江香猪样品中均未发现多态位点。
2.3 遗传变异
第1外显子有11个位点呈现多态,多态位点数为11,核苷酸序列的变异频率为1.32%(11/831),核苷酸变异位点占第1外显子已知核苷酸变异总位点数的44.00%(11/25)。11个变异位点中,错义突变7个,氨基酸序列的变异频率为2.53%(7/277),氨基酸变异位点占第1外显子已知氨基酸变异总位点数的63.64%(7/11)。第4外显子只有1个位点呈现多态,多态位点数为1,核苷酸序列的变异频率为0.81%(1/124),核苷酸变异位点占第4外显子已知核苷酸变异总位点数的10.00%(1/10);该位点变异类型为错义突变,氨基酸序列的变异频率为2.38%(1/42),氨基酸变异位点占第4外显子已知氨基酸变异总位点的20.00%(1/5)。第5、6外显子均未发现多态,多态位点数为0。
2.4 基因型频率、基因频率和多态信息含量
从表2看出,第1外显子多态位点g.98G→A的优势基因型为GG,频率为0.920 9;G是优势等位基因,频率为0.960 4。g.147C→G位点的优势基因型为CC,频率为0.820 1;C是优势等位基因,频率为0.902 9。g.189C→T位点的优势基因型为TT,频率为0.8201;T是优势等位基因,频率为0.906 5。g.198C→T位点的优势基因型为CC,频率为0.820 1;C是优势等位基因,频率为0.902 9。g.211A→G位点的优势基因型为GG,频率为0.820 1;G是优势等位基因,频率为0.902 9。g.231C→T位点的优势基因型为CC,频率为0.827 3;C是优势等位基因,频率为0.906 5。g.328T→C位点的优势基因型为CC,频率为0.820 1;C是其优势基因,频率为0.902 9。g.338C→A位点的优势基因型为AA,频率为0.820 1;A是优势等位基因,频率为0.9 0 2 9。g.352T→C位点的优势基因型为CC,频率为0.820 1;C是优势等位基因,频率为0.902 9。g.458G→A位点的优势基因型为AA,频率为0.820 1;A是优势等位基因,频率为0.902 9。g.778G→A位点的优势基因型为AA,频率为0.834 5;A是优势等位基因,频率为0.913 7。第4外显子多态位点g.1087C→G的优势基因型为CC,频率为0.439 7;C是优势等位基因,频率为0.602 8。

图2 CYP1A2基因第1外显子11个变异位点的测序Fig.2 Sequencing maps of 11polymorphism loci of gene CYP1A2 exon 1

图3 CYP1A2基因第4外显子g.1087C→G位点的测序Fig.3 Sequencing maps of g.1087C→G polymorphism locus of gene CYP1A2 exon 4
第1外显子的11个多态位点均处于Hardy-Weinberg平衡状态(P>0.05),第4外显子的多态位点g.1087C→G偏离Hardy-Weinberg平衡状态(P<0.05)。
第1外显子11个多态位点的多态信息含量介于0.073 2~0.160 0,第4外显子为0.364 2。
2.5 遗传多样性
12个多态位点的等位基因数均为2,未发现复等位基因。第1外显子11个多态位点的有效等位基因数介于1.082 3~1.212 7,纯合度介于0.827 3~0.920 9,杂合度介于0.0791~0.172 7,香农信息指数介于0.166 6~0.318 7;第4外显子多态位点的有效等位基因数为1.918 8,纯合度为0.673 8,杂合度为0.326 2,香农信息指数为0.671 8(表3)。

表2 CYP1A2基因第1、4外显子的基因型频率、等位基因频率和多态信息含量Table2 Genotype frequences,allele frequences and polymorphism information contents of gene CYP1A2 exon 1and 4

表3 CYP1A2基因第1、4外显子的遗传多样性指标Table3 Genetic diversity indexes of gene CYP1A2 exon 1and 4
3 结论与讨论
从江香猪CYP1A2基因第1外显子多态位点数量较多,核苷酸变异位点、对应氨基酸变异位点占总变异位点的比例均较高,说明多态位点较丰富,DNA序列及氨基酸序列的保守性较低。然而,这些变异位点的最小等位基因频率很小,优势基因的基因频率与最小等位基因频率差异几乎相差1个数量级,优势基因占绝对地位,表明这些位点的纯合度高。而且这些位点的PIC值都低于0.25,属于低度多态,也说明这些位点核苷酸变异较小,多态性低。香农信息指数、杂合度和有效等位基因数作为度量群体遗传变异的最适参数及衡量遗传多样性的重要指标[2324],也证实这些位点的变异性小,遗传多样性匮乏,基因纯合,稳定性好,具备药物代谢动物模型开发的良好基础。第4外显子的多态位点数量少,核苷酸变异位点、对应氨基酸变异位点占总变异位点的比例均较低,说明多态位点不足。该变异位点优势基因的基因频率与最小等位基因频率差异不大,PIC介于0.25~0.5,属于中度多态,基因杂合度较高,纯合度相对较低,有效等位基因数接近实际等位基因数,香农信息指数较高,表明该位点的遗传变异较大,遗传多样性较丰富,选育空间大,在药物代谢动物模型培育方面具有潜力。
第1外显子的多态位点丰富,群体中各位点的基因型频率和等位基因频率符合Hardy-Weinberg平衡,但遗传多样性匮乏;第4外显子的多态位点不足,但群体遗传多样性丰富,各位点的基因型频率和等位基因频率偏离Hardy-Weinberg平衡。产生这一现象的原因可能与样本量偏小有关。多态位点较多而检测样本量偏少,部分多态位点仅在少数个体中出现[25]。猪CYP1A2基因第4外显子共有10个多态位点,但本研究中仅检测出1个,极有可能是包含这些变异的个体没有录入样本库。此外,上述现象也可能包含了品种形成中的自然选择和人工选择效应。第4外显子的杂合度较高,第1外显子的杂合度低,或许还与基因“永不纯合”现象有关。冯书堂等[26]对五指山小型猪近交家系的研究发现,涉及代谢过程和细胞过程、维持生命活动所必需的基因总是存在一些杂合位点,且各对染色体之间的杂合度不尽相同。
第5、6外显子未发现多态位点,除了与这2个片段自身包含的多态位点总数较少以及检测的样本数量不大有关以外,或许还与SNP分布的品种差异有关。商海涛等[27]研究小型猪CYP3A29基因时发现,SNP的分布与遗传背景有关,贵州小型猪与巴马香猪的SNP位点存在差异。
在生物学功能与SNP关联性的分析中,等位基因频率是标签SNPs筛选的一个重要参考因素[28]。实际工作中,人们常选择最小等位基因频率大于0.25的位点。从江香猪第1外显子11个多态位点的最小等位基因频率均小于0.25,因此这些位点在关联分析时意义不大。多态信息含量用于连锁分析时对标志基因(或标志序列)的多态性进行估计[29],大于0.5的(共显性遗传的)标志基因具有高度信息,小于0.5而大于0.25的则具有合适信息,小于0.25的包含很少信息[30]。本研究中,PIC显示这些位点属于低度多态,在进行家系连锁分析或功能关联研究时应用价值不大,应谨慎选择。第4外显子虽然仅检测到1个多态位点,但其最小等位基因频率大于0.25,且多态信息含量大于0.25,属于中度多态,具有合适的信息量,加上该位点变异类型属于错义突变,其变异导致氨基酸一级结构的改变,对应的氨基酸替代为P363A,即由脯氨酸突变为丙氨酸。脯氨酸是一种带有环状结构的亚氨基酸,在二级结构中常常出现在β-转角处,导致肽链拐弯转向,突变成丙氨酸后肽链就有可能不再拐弯而是变成α-螺旋或β-折叠结构总体向前延伸,最终有可能改变CYP1A2的酶特性和药物代谢能力。因此,该位点在家系连锁分析和功能关联研究中意义更大,可用作标签SNP。
致谢:在样本收集过程中得到贵州省从江县农业局副局长谌洪光、从江香猪特色食品有限责任公司从江香猪加工厂厂长兰学铭的帮助,在此一并感谢!
[1]田玉龙,钟红珊.五指山小型猪在心血管系统疾病建模中的应用[J].介入放射学杂志,2016,25(4):363-366.
[2]杨秀江.从江香猪[J].特种经济动物养殖,2002(2):8.
[3]王黎青,王勇,邓勋,等.药物代谢酶细胞色素P4501A2的研究[J].今日药学,2010,20(12):9-11.
[4]庞莉萍,崔景荣.细胞色素P450 1A1的研究进展[J].国外医学遗传学分册,2005,28(2):80-84.
[5]蒋卉,陈一岳.常用药物及蔬果对CYP450各亚型活性的影响[J].现代食品与药品杂志,2007,17(2):10-13.
[6]李晓宇,刘皋林.CYP450酶特性及其应用研究进展[J].中国临床药理学与治疗学,2008,13(8):942-946.
[7]崔颖,张永旺.P450酶的研究进展[J].中国新技术新产品,2009(16):7-8.
[8]SKAANILD M T,FRIIS C.Characterization of the P450 system in Gottingen minipigs[J].Pharmacology&Toxicology,1997,80(l/2):28-33.
[9]ANZENBACHER P,SOUCEK P,Anzenbacherová E,et al.Presence and activity of cytochrome P450 isoforms in minipig liver microsomes.Comparison with human liver samples[J].Drug metabolism and disposition,1998,26(1):56-59.
[10]李健,刘勇,张江伟,等.贵州小型香猪与人五种CYP酶活性的比较[J].中国比较医学杂志,2006,16(3):157-161.
[11]LI J,LIU Y,ZHANG J W,et al.Characterization of hepatic drug-metabolizing activities of Bama miniature pigs(Sus scrofa domestica):comparison with human enzyme analogs[J].Comparative medicine,2006,56(4):286-290.
[12]SKAANILD M T,FRIIS C.Cytochrome P450 sex differences in minipigs and conventional pigs[J].Pharmacology &Txicology,1999,85(4):174-180.
[13]KOJIMA M,SEKIMOTO M,DEGAWA M.A novel gender-related difference in the constitutive expression of hepatic cytochrome P4501Asubfamily enzymes in Meishan pigs[J].Biochemical pharmacology,2008,75(5):1076-1082.
[14]ZAMARATSKAIA G,ZLABEK V,CHEN G,et al.Modulation of porcine cytochrome P450 enzyme activities by surgical castration and immunocastration[J].Animal,2009,3(8):1124-1132.
[15]BRUNIUS C,RASMUSSEN M K,LACOUTIèRE H,et al.Expression and activities of hepatic cytochrome P450(CYP1A,CYP2Aand CYP2E1)in entire and castrated male pigs[J].Animal,2012,6(2):271-277.
[16]MONSHOUWER M,VAN'T KLOOSTER G A,NIJMEIJER S M,et al.Characterization of cytochrome P450 isoenzymes in primary cultures of pig hepatocytes[J].Toxicology in vitro,1998,12(6):715-723.
[17]MYERS M J,FARRELL D E,HOWARD K D,et al.Identification of multiple constitutive and inducible hepatic cytochrome P450 enzymes in market weight swine[J].Drug metabolism and disposition,2001,29(6):908-915.
[18]MESSINA A,NANNELLI A,FIORIO R,et al.Expression and inducibility of CYP1A1,1A2,1B1 by beta-naphthoflavone and CYP2B22,3A22,3A29,3A46 by rifampicin in the respiratory and olfactory mucosa of pig[J].Toxicology,2009,260(1/2/3):47-52.
[19]MESSINA A,PUCCINELLI E,GERVASI P G,et al.Expression and inducibility of CYP1A1,1A2,1B1 by β-naphthoflavone and CYP2B22,CYP3As by rifampicin in heart regions and coronary arteries of pig[J].Research in veterinary science,2013,94(1):77-83.
[20]NANNELLI A,ROSSIGNOLO F,TOLANDO R, et al.Effect of beta-naphthoflavone on AhR-regulated genes(CYP1A1,1A2,1B1,2S1,Nrf2 and GST)and antioxidant enzymes in various brain regions of pig[J].Toxicology,2009,265(3):69-79.
[21]王一珂,马旭,焦园园,等.药物基因组学个体化用药证据基础分析与评价[J].中国药房,2016,27(8):1009-1012.
[22]张小梅,冯毅凡,陈耕夫,等.细胞色素P450与中草药代谢关系的研究进展[J].广东药学院学报,2011,27(3):327-331.
[23]SU Y,LONG R,CHEN G,et al.Genetic analysis of six endangered local duck populations in China based on microsatellite markers[J].Journal of genetics and genomics,2007,34(11):1010-1018.
[24]赵勤涛,刘桂琼,姜勋平,等.湖北乌羊与3个地缘邻近山羊品种间的遗传趋异性研究[J].农业生物技术学报,2015,23(4):521-529.
[25]张鸣明,李少斌,王继卿,等.藏绵羊孕酮受体基因第4外显子多态性分析[J].扬州大学学报(农业与生命科学版),2014,35(3):29-32.
[26]冯书堂,高倩,刘岚.哺乳动物近交系资源创新百年[J].遗传,2016,38(3):181-195.
[27]商海泓,杨家大,魏泓,等.小型猪肝脏细胞色素P450基因CYP3A29克隆与序列分析[J].畜牧与兽医,2008,40(5):21-25.
[28]刘媛,钟诗龙,杨敏,等.华法林药代学和药动学通路突变等位基因在中国汉族人群中的分布[J].北京大学学报(医学版),2011,43(6):798-803.
[29]吕宝忠.多态信息量(PIC)等于杂合度吗?[J].遗传,1994,16(4):31-33.
[30]BOTSTEIN D,WHITE RL,SKOLNICK M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].American journal of human genetics,1980,32(3):314-331.
(责任编辑:冯 卫)
Polymorphisms of Four Exons in Congjiang Xiang-pig Gene CYP1A2
YANG Jiada1,REN Qiong2,WU Shengrong3
(1.College of Environmental and Life Sciences,Kaili University,Kaili,Guizhou556011;2.Agricultural Bureau,Congjiang County of Guizhou Province,Congjiang,Guizhou557400;3.Library,Kaili University,Kaili,Guizhou 556011,China)
Polymorphisms of Congjiang Xiang-pig gene CYP1A2 exon 1,4,5and 6were detected,in order to discover the tag SNPs in pig gene CYP1A2 and accumulate basic data of drug metabolism enzyme of Congjiang Xiang-pig.Results showeDThat 11polymorphic loci(g.98G>A,g.147C>G,g.189C>T,g.198C>T,g.211A>G,g.231C>T,g.328T>C,g.338C>A,g.352T>C,g.458G>A and g.778G>A)existed in exon 1,the preponderant genotype were GG,CC,TT,CC,GG,CC,CC,AA,CC,AA and AA respectively,the preponderant allele were G,C,T,C,G,C,C,A,C,A and A respectively,polymorphism information contents were 0.0732to 0.1600,the numbers of effective alleles were 1.082 3 to 1.212 7,homozygosities were 0.8273to 0.9209,heterozygosities were 0.079 1to 0.172 7,Shannon information indexes were 0.166 6to 0.3187,and population was in Hardy-Weinberg equilibrium state(P>0.05).one polymorphic locus,i.e.g.1087C>G existed in exon 4,the preponderant genotype was CC,the preponderant allele was C,polymorphism information content was 0.3642,the effective number of alleles was 1.9188,homozygosity was 0.6738,heterozygosity was 0.326 2,Shannon’s information index was 0.6718,and population deviated from Hardy-Weinberg equilibrium(P<0.05).No polymorphism was detected in exon 5and 6.It was indicateDThat genetic polymorphism loci of CYP1A2 gene exon 1in Congjiang Xiang-pig are rich,and have properties of high homozygosities and low genetic variabilities,which lay the foundation for using Congjiang Xiang-pig as animal model of drug metabolism.But,because polymorphism information contents are insufficient,these polymorphism loci should be cautious when linkage analysis and(or)association analysis are conducted.In exon 4,the number of genetic polymorphism loci is few,but polymorphism information content is appropriate,which hint this genetic polymorphism locus can be used as the tag SNP for linkage analysis and(or)association analysis.
Congjiang Xiang-pig;CYP1A2;tag SNP;polymorphism
S828
A
1001-3601(2016)10-0430-0084-07
2016-08-02;2016-09-26修回
国家自然科学基金项目“贵州小型香猪细胞色素氧化酶P450酶系的分子生物学基础研究”(81460572)
杨家大(1975-),副教授,博士,从事地方特色畜禽品种资源的开发利用研究。E-mail:yangjiada2@163.com
———从江加车村

