GA合成酶GA3OX1参与拟南芥避荫反应
董康梅,朱亚萍,王梅玲,陶 懿(厦门大学生命科学学院,福建厦门361102)
GA合成酶GA3OX1参与拟南芥避荫反应
董康梅,朱亚萍,王梅玲,陶 懿*
(厦门大学生命科学学院,福建厦门361102)
摘要:避荫反应是避荫植物针对光这一环境信号做出的可塑性反应,对其适应环境胁迫和生存具有极其重要的意义.本研究以拟南芥避荫突变体sav8为材料,通过对其表型鉴定,发现sav8在模拟遮荫后下胚轴较短,其成年植株矮小、分枝较多、顶端优势不明显;在模拟遮荫条件下的激素处理实验中,sav8对赤霉素(GA)表现出超敏感.通过图位克隆,我们确定了sav8是在赤霉素合成基因GA3OX1序列上第1 358位碱基由C突变为T,引起编码蛋白第309位谷氨酰胺的密码子变为终止子.进一步研究表明,遮荫处理诱导赤霉素合成基因GA3OX1表达上调,并且此上调不依赖于色氨酸氨基转移酶基因TAA1.结果说明GA3OX1是避荫反应途径中赤霉素合成调控的关键基因.
关键词:拟南芥;避荫反应;GA3OX1;赤霉素
由于光对植物生存的重要性,植物对光环境的变化尤其敏感.当植物密度过高,其叶片会相互交叠并因此产生互相遮荫.导致避荫反应的光信号主要有两种:一种是光强度的减弱,另一种是红光强度与远红光强度比例(R∶FR)的降低,而后者为诱导避荫反应最为有效的光信号.当阳光从植物叶片透射或反射后,其中的红光和蓝光被叶绿素等植物色素选择性地吸收,而远红光则可以透过叶片或被反射,因此这类透射或反射光具有较低的R∶FR,也提示植物其周围存在其他的竞争者.当避荫植物感受到R∶FR降低后,会产生一系列形态和生理生化的变化,这一系列变化被称为避荫综合症(shade avoidance syndrome,SAS)[1].具SAS的植物最明显的形态变化就是下胚轴、茎秆和叶柄的快速伸长[2].此外,避荫反应还包括叶片角度改变、衰老加速、顶端优势加强、分枝减少等[3].
植物激素对植物的生长发育有重要的调控作用.在遮荫诱导下,部分编码与植物激素合成和代谢相关的酶或植物激素信号传导途径组分的基因会快速被诱导[4],说明植物激素在避荫反应中可能发挥着重要的作用.已有研究表明,生长素(auxin)[5-6]、赤霉素(gibberellins,GA)[5]、油菜素内酯(brassinosteroids)[5]、乙烯(ethylene)[7]等多种激素参与到避荫反应中.在拟南芥(Arabidopsis thaliana)中,生长素水平与遮荫调控的植物生长和发育密切相关.拟南芥色氨酸氨基转移酶(tryptophan aminotransferase of Arabidopsis 1, TAA1)是由吲哚丙酮酸(IPA)途径合成生长素IAA的重要合成酶.拟南芥TAA1基因突变体sav3是首个通过正向遗传学的方法分离到的避荫反应突变体. sav3突变体在白光和黑暗条件下的表型与野生型相比无明显变化,但在模拟遮荫处理后,sav3突变体则缺少某些避荫反应,如其下胚轴和叶柄的伸长明显短于野生型,而叶子的面积大于野生型等[6].拟南芥中, 低R∶FR的光处理促进GA相关基因如GA合成基因GA20OX1[4]的表达,同时导致幼苗下胚轴伸长,而这一表现在GA合成缺陷或GA不敏感植株中消失[8].这些都说明GA参与了植物的避荫反应.
糖类不仅是植物的碳源,也是植物生长的信号分子.高浓度糖类可以引起对拟南芥幼苗生长的抑制[9],但这一影响依赖于光[10].花青素是植物的防晒剂,在高光强条件下,可以通过吸收蓝绿光和紫外光来保护植物.研究表明,糖与花青素的积累密切相关[11],糖类中二糖如蔗糖和麦芽糖会诱导花青素合成.花青素积累使植株子叶或叶片呈现出紫色.多种植物激素如脱落酸、茉莉酸、细胞分裂素以及GA也参与调节花青素的合成,在拟南芥中,茉莉酸和脱落酸与蔗糖有协同作用,增强花青素合成途径中的大部分基因的表达,而GA却抑制这一类基因的表达[12].
我们应用正向遗传学(forward genetics)通过筛选甲基磺酸乙酯(EMS)诱变得到的突变体种子库,获得避荫反应缺陷型突变体sav8(shade avoidance 8).通过表型分析及图位克隆(map-based cloning)技术[13],我们对突变基因进行定位,最终确定突变基因为GA合成基因GA3OX1.随后,我们进一步探究该突变基因与避荫反应的关系,发现其表达受遮荫调控,说明该基因是避荫反应机制中的重要组成部分.
1 材料与方法
1.1实验材料
拟南芥野生型植株:Colunmbia(Col-0)生态型, Landsberg erecta(L er)生态型.拟南芥突变体植株: sav8,sav3-1.大肠杆菌(Escherichia coli)菌株DH5α,根癌农杆菌(Agrobacterium tumefacieus)菌株GV3101.双元载体质粒:pJHA212K(由本实验室保存).
1.2拟南芥的遮荫处理
拟南芥幼苗在22℃光照培养箱中连续白光光照培养7 d,再转入22℃模拟遮荫培养箱遮荫处理3 d后取出.模拟遮荫条件(R∶FR=0.6~0.7):红光,13 μmol/(m2·s);远红光,21μmol/(m2·s);蓝光,3.5 μmol/(m2·s).
1.3拟南芥的黑暗处理
将种有拟南芥种子的培养基用锡箔纸和黑色塑料袋包裹,放入4℃冰箱低温处理2 d后,转入22℃培养箱中黑暗培养3 d后取出.
1.4拟南芥的激素处理实验
将要种植的拟南芥种子放入干净的EP管中,加入含有0.05%(体积分数)Triton X-100的70%(体积分数)乙醇溶液处理10 min,吸出该溶液;再加入无水乙醇处理10 min,在超净台内吸去无水乙醇,加入无菌的0.1%(质量分数)琼脂溶液,悬浮种子.将上述灭菌的种子均匀散布于含有实验用的激素(生长素类似物Picloram、油菜素内酯epi-brassinolide和GA)的1/2 MS培养基上,并分别以添加等量体积的激素对应溶剂(无水乙醇、无水乙醇和二甲基亚砜(DMSO))的1/2 MS培养基作为对照.培养基表面风干后用透气胶布封好培养皿,置于4℃冰箱中低温处理2 d后,将培养皿置于22℃光照培养箱中连续白光(R∶FR= 1.2,总光强为60μmol/(m2·s))光照培养,待其发芽生长.
1.5TRIpure法提取总RNA
取0.1 g拟南芥幼苗置于1.5 m L EP管中,置入液氮中速冻,用研磨棒将幼苗磨碎,在组织样品化冻前加1 m L TRIpure(Roche),并在漩涡振荡器上振荡使细胞彻底破碎,室温静置10 min;往EP管中加入200μL三氯甲烷,在漩涡振荡器上振荡20 s使之混匀,室温静置10 min;4℃,12 000 g离心15 min,取上清转入无RNA酶的新EP管中;往上清中加入600 μL异丙醇沉淀RNA,震荡混匀,冰上放置10 min; 4℃,12 000 g离心15 min,弃上清;用1 m L 70%乙醇洗涤沉淀;4℃,7 500 g离心5 min,将乙醇倒尽,快速离心后吸干剩余乙醇,常温干燥数分钟;加40μL焦碳酸二乙酯(DEPC)水溶解沉淀;用NanoDrop分光光度计测总RNA质量分数,琼脂糖凝胶电泳检测确定RNA的完整性.
1.6实时荧光定量PCR(qRT-PCR)
首先使用反转录试剂盒(Thermo)将500~ 1 000 ng总RNA反转录成cDNA第一链.cDNA第一链合成后,用超纯水将其稀释25倍作为qRT-PCR模板使用.qRT-PCR反应[14]以SYBR Green为荧光染料,在Stratagene Mx3000P实时荧光定量PCR仪(Agilent)上完成,用REF3(AT1g13320)基因作为内参[15].所用的引物(序列为5'→3')如下:
REF3(AT1g13320)-F:GGAGCCAACTAGGACGGATCTGG;
REF3(AT1g13320)-R:GTAGATCAATCCCAATAACCTGGTTCACTT;
IAA19-F:GGGTTAGGGTATGTGAAAGTGAGC;
IAA19-R:CGTATTCGCAGTTGTCACCATC;
IAA29-F:GGCCAGCCCAACGAGGAAGAC;
IAA29-R:CGCAATCTTCATATTCGGTAAACATAGTG;
HFR1-F:CACAAGACGGACAAGGTTTCGGTTC;
HFR1-R:GGAACCAAACCGTGAAGAGACTGAG;
PIL1-F:TACAAGGATGATAAGGCTTCATTGTTGG;
PIL1-R:CGGACGCAGACTTTGGGAATTG;
GA20OX1-F:CGATACTTTCATGGCTCTATCGAACG;
GA20OX1-R:GATGGGTTTGGTGAGCCAATCTG;
GA3OX1-F:CACCATCACTGGCTCGCCTCTC;
GA3OX1-R:GCCCATTCAATGTCTTCTTCGCTG.
1.7遗传分析与图位克隆的杂交制种
将突变体种子种于营养土中,培养至开花,以野生型(Col-0)为父本,突变体为母本,杂交得Fl代种子;Fl代种子继续播种,进行自交,得F2代种子;F2代种子种于1/2 MS培养基上,在模拟遮荫处理下生长一段时间后检测其性状分离情况,统计结果用于遗传分析.将突变体作为父本,野生型(L er)作为母本,杂交得C1代种子;C1代种子自交后得到的C2代种子种在培养基上,连续光照培养7 d后,模拟遮荫筛选出下胚轴较短的植株用于图位克隆.
1.8互补质粒构建及互补实验
用植物基因组提取试剂盒(生工生物工程有限公司)提取野生型(Col-0)的基因组DNA,用以下引物(序列为5'→3')扩增GA3OX1基因序列.
pJHA212K-GA3OX1 genomic-F:GAGCTCGGTACCCGGGAAAAGGCAAGTCATGTTGTGG;
pJHA212K-GA3OX1 genomic-R:CTTGCATGCCTGCAGACCAAAAGTTCCATAAACATGGG .
采用DNA凝胶回收试剂盒(Axygene)回收该DNA片段,然后使用不依赖于连接反应克隆(LIC)的方法[16]构建pJHA212K-GA3OX1重组质粒,其中核酸外切酶Ⅲ(ExoⅢ)是Ta KaRa公司的.然后使用化学方法转化大肠杆菌[17],获得阳性菌落后提取质粒再电击转化农杆菌[17],接着使用农杆菌介导的拟南芥浸染花序转化法[18]获得转基因阳性植株.
1.9花青素含量测定
将培养7 d的拟南芥幼苗用无菌去离子水洗涤3 遍,然后用吸水纸擦干并称量后放入液氮中;将拟南芥幼苗在液氮中研磨,在组织样品化冻前加入300μL 7%(体积分数)盐酸甲醇溶液,于4℃冰箱中摇晃过夜;次日加入200μL无菌去离子水,震荡混匀,而后加入500μL三氯甲烷,混匀后13 000 r/min离心2 min;将上层溶液转移到新离心管后,加入600μL 1%(体积分数)盐酸甲醇溶液,混匀后13 000 r/min离心2 min;转移上清,分别测量其在530 nm和657 nm处吸光度(OD)值,计算相对花青素含量(OD530-OD657).
2 实验结果
2.1突变体sav8表型分析
sav8是由野生型(Col-0)经EMS诱变后的M2代种子在人工模拟遮荫条件筛选出来的避荫缺陷型突变体.我们将野生型(Col-0)种子、TAA1基因突变体(sav3-1)种子,以及筛选得到的sav8种子分2组种在1/2 MS培养基上;连续光照培养7 d后,试验组转至模拟遮荫培养箱培养,对照组继续留在光照培养箱中,3 d后同时取出并测量幼苗下胚轴长度.与野生型相比,sav8突变体与sav3-1突变体类似,在模拟遮荫条件下下胚轴不能正常伸长(图1).
sav8成年植株也明显不同于野生型(Col-0),其整体株高小于野生型,顶端优势不明显,分枝较多,似丛状生长(图2).sav8的上述生长表型说明了突变的功能基因不仅影响拟南芥幼苗在遮荫条件的生长,还可能参与调控成年植株的整体生长发育.
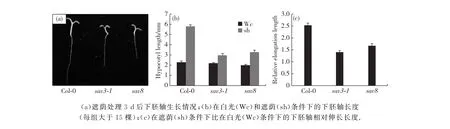
图1 突变体在白光和遮荫条件下的下胚轴生长状况Fig.1 Hypocotyl growth of mutants in Wc and shade

图2 营养土中生长4周左右的野生型(Col-0)(a)和突变体sav8(b)成年植株生长状况Fig.2 Growth of adult wild type(Col-0)(a)and sav8 mutant(b)after growing in nutrient soil for about 4 weeks
对于避荫突变体我们大致可将其分为两类:一类是不能感受遮荫信号,其下游信号转导受阻,无法诱导避荫反应;另一类则是由于其下胚轴伸长缺陷而无法在遮荫条件下长高.为了鉴定sav8属于哪一类型,我们将野生型(Col-0)和sav8在黑暗中萌发、生长3 d 后,观察并测量其下胚轴长度(图3).由图可以看出,在黑暗条件下sav8的下胚轴相对于Col-0较短,说明sav8属于第2种类型,即由于突变基因影响了下胚轴的伸长而导致产生避荫缺陷.
2.2sav8不影响早期避荫应答基因的表达
遮荫处理能引起一系列基因表达变化,部分基因表达在遮荫处理后被快速诱导,这些基因被称为避荫应答基因.在这些避荫应答基因中一部分是转录因子,如PIL1[19]、HFR1[20]等;另一部分是编码催化植物激素合成的酶或植物激素信号传导途径组分的基因,如生长素应答基因IAA19、IAA29[6],赤霉素合成基因GA20OX1[4]等.为确定突变体在分子层面避荫应答是否正常,我们检测了sav8中这些基因的表达水平(图4).检测结果显示,这些避荫应答基因在sav8中的表达水平与在Col-0中相比差异不显著,这说明所检测的这些基因在sav8中的遮荫应答都是正常的.
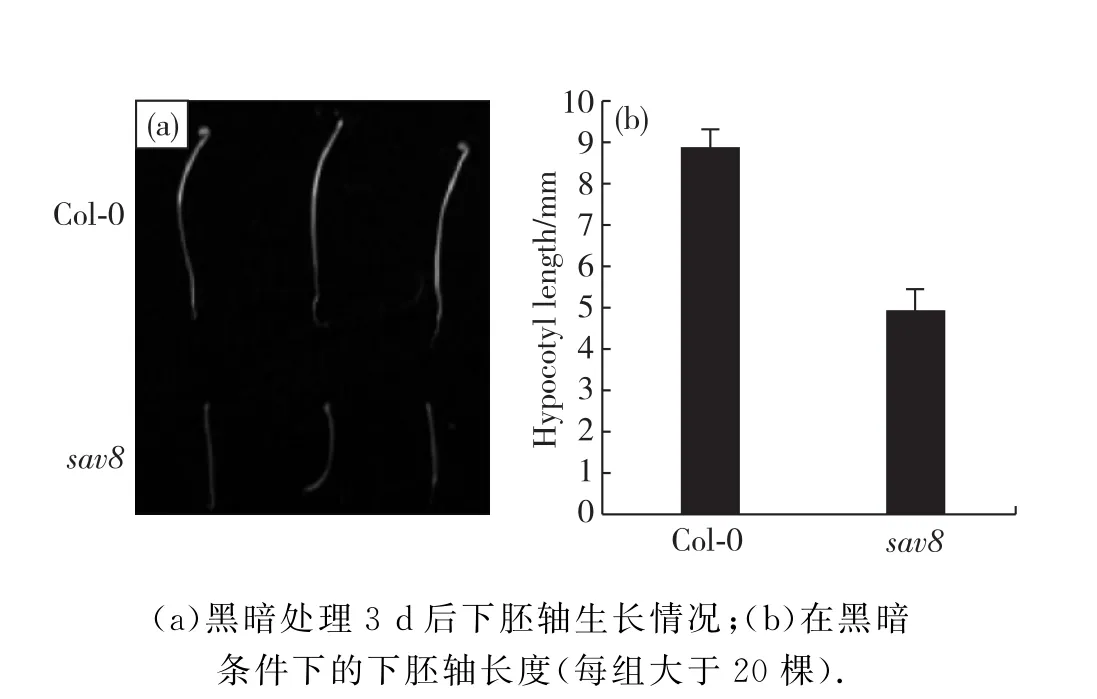
图3 突变体sav8在黑暗条件下的下胚轴生长状况Fig.3 Hypocotyl growth of sav8 mutants in dark
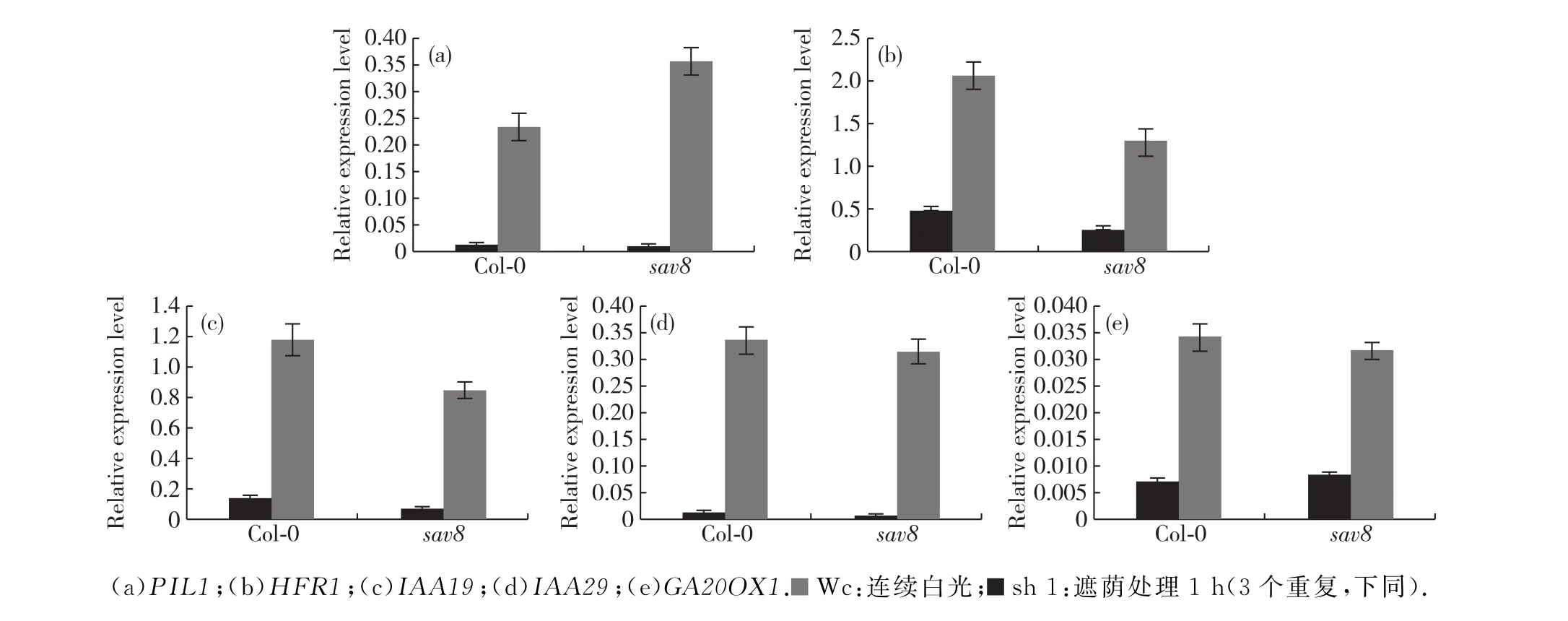
图4 RT-PCR检测避荫相关基因表达水平Fig.4 Expression levels of SAS-related genes using RT-PCR
2.3GA处理回复sav8的避荫表型
在已报道的避荫缺失突变体中,有一部分是由于参与避荫反应的植物激素合成或信号通路缺陷造成的,如sav1-1为油菜素内酯合成基因DWF4突变体[6],sav3为生长素合成基因TAA1的突变体[6]等.因此,我们用不同浓度的生长素类似物Picloram(以下简称Pic)、油菜素内酯epi-brassinolide(eBL)和GA3这些参与避荫反应的激素处理野生型(Col-0)和sav8(图5).从图中可以看出:sav8对生长素和油菜素内酯不敏感,Pic和eBL都不能回复sav8下胚轴在遮荫条件下较短的现象(图5(a)和(b));相反,sav8下胚轴在低浓度0.5μmol/L GA3处理下有明显伸长,伸长增幅远远大于Col-0,而2μmol/L GA3处理时下胚轴长度基本接近Col-0,说明GA可以回复sav8下胚轴在遮荫条件下较短的现象(图5(c));此外,由相对伸长长度(图5(d))可以看出sav8下胚轴伸长对GA表现出超敏感.鉴于激素合成突变体通常会表现出对相应激素的超敏感表型,我们推测sav8可能是参与GA合成基因的突变体.
2.4sav8中蔗糖诱导的花青素含量升高
蔗糖作为营养物质可以促进拟南芥的生长,但当用过高浓度蔗糖处理拟南芥幼苗时,其叶片中花青素会过多积累,叶片也会出现发紫的现象,该反应受GA的抑制.为了进一步检测sav8是否与GA途径相关,我们检测了sav8中蔗糖对花青素合成诱导的情况.当用梯度浓度的蔗糖处理Col-0和sav8时,在相同浓度下sav8叶片发紫程度比Col-0深,尤其在用3%(质量分数)的蔗糖处理时,sav8整个叶片都呈现深紫色,而这时Col-0叶片只有轻微发紫(图6(a)).同时测定两者花青素的相对含量可以看出,梯度浓度的蔗糖处理下,Col-0和sav8中花青素合成随浓度增加而增加,且在相同浓度的蔗糖处理下sav8的花青素的相对含量都远远大于Col-0(图6(b)),由此可见sav8中花青素的合成对蔗糖表现出超敏感,该表型与其为赤霉素合成基因突变体的推测相符.
2.5遗传分析确定sav8为单基因隐性突变体
首先我们分析了突变体sav8的遗传学特性.我们以突变体sav8为母本,Col-0为父本杂交得F1代并种植,统计各植株在遮荫条件下下胚轴的表型.经统计,杂交获得的F1代80个个体在遮荫处理后下胚轴全部正常伸长,即均为野生型表型,由此可以判定该突变表型为隐性基因控制.F1代自交后得到F2代,将F2代幼苗经人工模拟遮荫筛选后,统计其表型分离比例(共134棵植株)为98∶36[χ2(3∶1)=0.248;p> 0.95],符合孟德尔遗传定律.综上可以确定突变体sav8避荫缺陷表型是由隐性单基因控制的.

图5 在遮荫条件下突变体下胚轴对不同激素的反应Fig.5 Hypocotyl response of mutants to different hormones under shade
2.6图位克隆确定sav8为GA3OX1突变体
为了定位sav8中的突变基因,我们进行了基因的图位克隆.将突变体sav8(Col-0背景)与另一生态型野生型L er杂交得C1代种子.C1种子自交后得到的C2代种子种在培养基上,模拟遮荫筛选后出现性状分离,从中分离得到71棵下胚轴较短的突变体植株.提取这71棵植株DNA,从拟南芥5条染色体上先分别选出一个分子标记的引物对上述DNA进行PCR扩增,电泳检测后,统计双交换、单交换与不交换的个体数目,计算交换率.如表1所示,可以看到除1号染色体T28K15分子标记处交换率为20.42%外,其他染色体上分子标记处的交换率均在50%左右.再选择了1号染色体上其他位置的分子标记F12K11、F3O9、T22J18,计算交换率分别为23.24%,22.86%, 26.05%(表1).根据图位克隆的原理,由以上结果可以推断sav8突变基因位于1号染色体上.
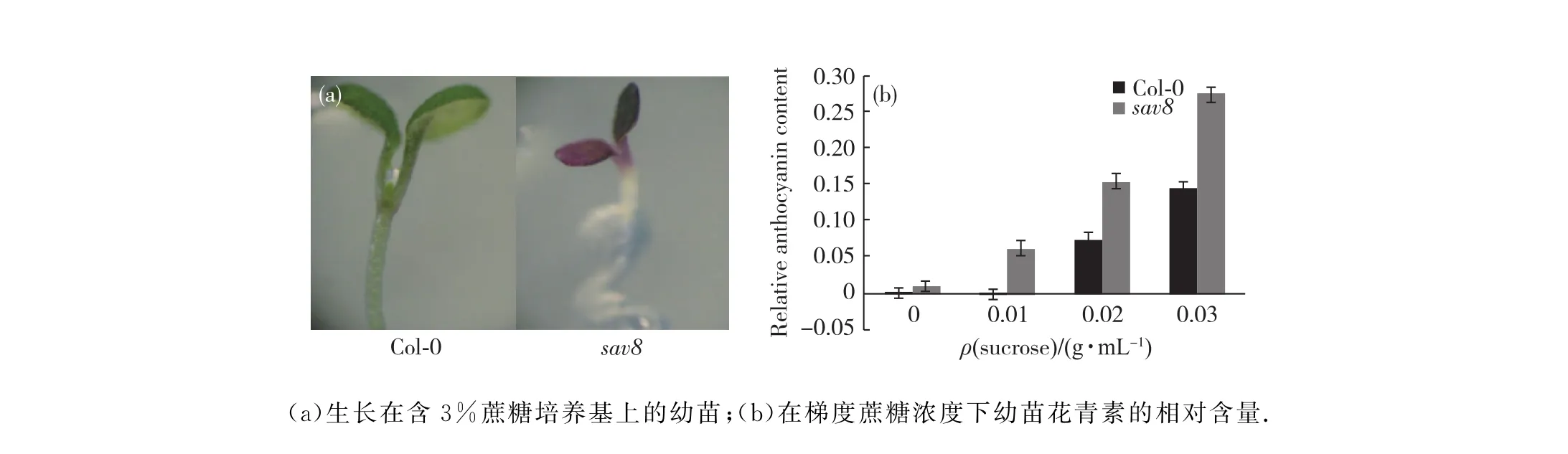
图6 突变体sav8幼苗对蔗糖诱导花青素合成超敏感Fig.6 Seedlings of sav8 mutants were hyper-sensitive to sucrose-induced anthocyanin synthesis
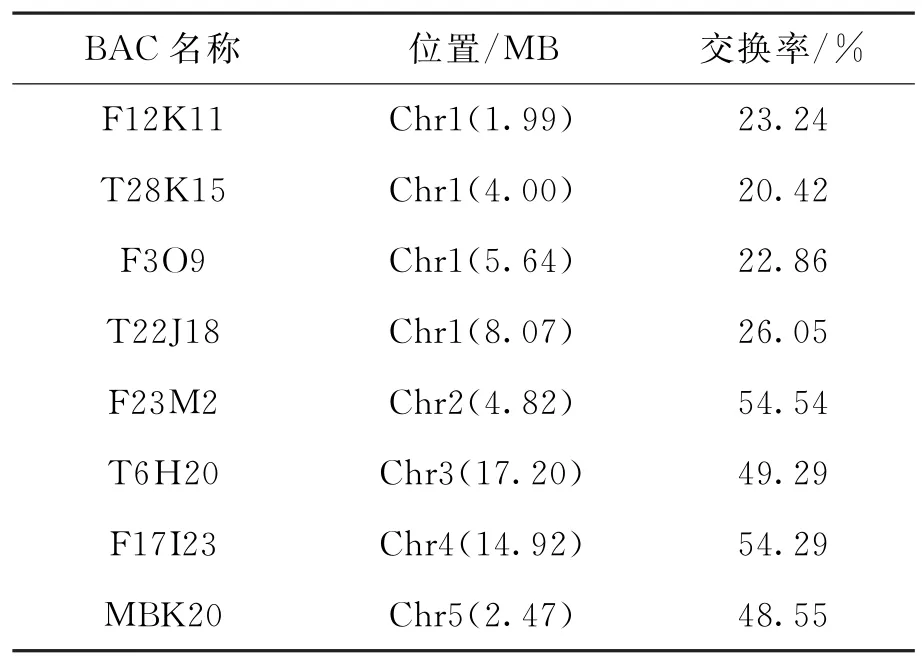
表1 sav8突变体基因粗定位结果Tab.1 The primary mapping result of the mutant gene
为进一步定位突变基因,我们在1号染色体的分子标记T28K15附近设计更多的分子标记,筛选并分析了1 200株左右的C2代避荫突变植株,最终将突变基因定位在1号染色体T28K15(4.00 MB)和F3O9(5.64 MB)之间大约1.64 MB的范围内.在此范围内有621个基因,其中与GA合成相关的基因只有GA3OX1 (AT 1g15550),所以我们从sav8基因组DNA上通过PCR扩增得到GA3OX1基因序列进行测序.测序结果显示,在sav8中GA3OX1基因的第1 358位碱基由胞嘧啶(C)突变为胸腺嘧啶(T),造成相应氨基酸序列的第309位谷氨酰胺(Gln309)密码子(CAA)变为终止子(TAA),使其编码蛋白提前终止.
为了确定sav8的突变体表型是否是由GA3OX1基因突变引起的,我们做了遗传互补实验,将包括基因启动子、基因组DNA及3'非编码区的序列(4 142 bp)克隆到pJHA212K载体上构建重组质粒,并将其转化到sav8植株中获得3个SAV8pro:: SAV8/sav8转基因植株.我们测量了这3个转基因植株幼苗在模拟遮荫下的下胚轴长度(图7),由图可见, 这3个转基因植株幼苗在模拟遮荫条件下下胚轴均能正常伸长,回复到和野生型(Col-0)相当的长度;此外,这3个转基因植株的成年植株也都回复到野生型表型.以上结果说明基因GA3OX1突变造成了sav8避荫缺陷,即sav8是GA3OX1基因突变体.
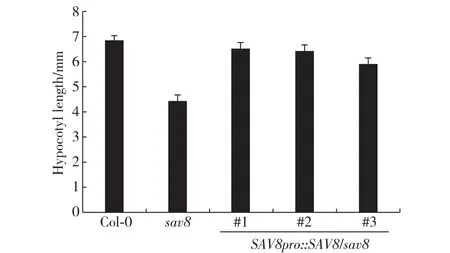
图7 突变体sav8的遗传互补实验Fig.7 Genetic complementation assay of sav8 mutant
2.7GA3OX1表达受避荫诱导且不依赖于TAA1
GA参与了避荫反应,但是遮荫对GA水平的调控方式目前并不清楚.拟南芥中,低R∶FR的光处理促进GA相关基因,如GA合成基因GA20OX1[4]的表达.TAA1是遮荫诱导拟南芥生长素快速合成途径中的关键基因[6].为了分析GA合成基因在遮荫处理下的表达是否受到TAA1调控,我们检测了Col-0和sav3-1在遮荫处理1,2,24 h后GA合成相关基因GA20OX1和GA3OX1的表达水平,结果如图8所示,遮荫处理1 h后,Col-0中GA20OX1的表达出现上调,当遮荫处理2 h时其表达继续上调,但当遮荫时间的增加至24 h后,其表达又下调至与遮荫1 h时相当的水平;但在sav3-1中,遮荫诱导GA20OX1的表达上调不显著(图8(a)).GA3OX1在Col-0遮荫处理1 h后表达上调,遮荫时间增加到2 h时表达水平无明显变化,到遮荫处理24 h后其表达水平对比遮荫1 h 和2 h明显下调;而在sav3-1中,遮荫处理后GA3OX1基因表达模式较Col-0中没有明显变化(图8(b)).上述结果说明GA合成相关基因GA20OX1和GA3OX1受遮荫调控表达的途径是不同的:遮荫诱导GA20OX1的表达上调依赖于TAA1,而诱导GA3OX1的表达上调不依赖于TAA1.

图8 遮荫诱导GA3OX1基因表达不依赖于TAA1Fig.8 The induced expression of GA3OX1 under shade is TAA1-independent
3 讨 论
通过对拟南芥避荫突变体sav8的一系列表型鉴定,我们发现sav8突变体植株在模拟遮荫后下胚轴较短,黑暗中生长下胚轴也较短,成年整体植株矮小,分枝较多,顶端优势不明显.在模拟遮荫条件下的激素处理实验中发现,sav8下胚轴伸长对生长素类似物Pic及油菜素内酯eBL敏感性降低,而对GA表现出超敏感.此外,sav8中花青素的合成对蔗糖也表现出超敏感.通过图位克隆,我们确定了sav8是在赤霉素合成基因GA3OX1(AT1g15550)上第1 358 bp位碱基由C突变为T,引起相应氨基酸序列的Gln309密码子变为终止子,使编码蛋白提前终止.而在sav8的遗传互补实验中,我们得到的3个SAV8pro::SAV8/sav8转基因植株在模拟遮荫条件下的避荫表型及成年植株表型都回复到和野生型一致,证明了sav8是GA3OX1基因突变体.
GA3OX1突变造成了sav8避荫缺陷,说明GA对拟南芥避荫反应是必需的.由于遮荫对GA水平的调控方式目前并不十分清楚,我们检测了Col-0和 TAA1突变体sav3-1在遮荫处理1,2,24 h后GA合成相关基因GA20OX1和GA3OX1的表达水平,观察到遮荫诱导GA20OX1和GA3OX1的表达均上调,但遮荫下GA3OX1的表达模式在Col-0和sav3-1中没有明显差异,说明GA3OX1的表达上调不依赖于TAA1;而我们同时观察到遮荫诱导的GA20OX1上调则是TAA1依赖型的.由上述差异可见遮荫通过不同的途径调控GA合成.
综上所述,我们的研究表明GA合成酶GA3OX1参与了拟南芥的避荫反应,GA3OX1基因的表达受遮荫调控,遮荫诱导GA3OX1的表达上调且不依赖于TAA1,而遮荫诱导的GA20OX1的表达上调依赖于TAA1,说明遮荫信号通过不同途径对GA合成酶进行调控,进而达到对植物体内GA含量的精确控制和对植物生长的调节.关于GA3OX1基因在避荫反应中具体的调控机制还需进一步研究.
参考文献:
[1] SMITH H,WHITELAM G C.The shade avoidance syndrome:multiple responses mediated by multiple phytochromes[J].Plant Cell & Environment,1997,20: 840-844.
[2] MORGAN D C,SMITH H.Linear relationship between phytochrome photoequilibrium and growth in plants under simulated natural radiation[J].Nature,1976,262 (5565):210-212.
[3] WHITELAM G C,JOHNSON C B.Photomorphogenesis in Impatiens parviflora and other plant species under simulated natural canopy radiation.[J].New Phytologist, 1982,90(4):611-618.
[4] DEVLIN P F,YANOVSKY M J,KAY S A.A genomic analysis of the shade avoidance response in Arabidopsis [J].Plant Physiology,2003,133(4):1617-1629.
[5] CASAL J J.Shade avoidance[J].The Arabidopsis Book,2012,10:e0157.
[6] TAO Y,FERRER J L,LJUNG K,et al.Rapid synthesis of auxin via a new tryptophan-dependent pathway is required for shade avoidance in plants[J].Cell,2008,133 (1):164-176.
[7] VANDENBUSSCHE F,VRIEZEN W H,SMALLE J,et al.Ethylene and auxin control the Arabidopsis response to decreased light intensity[J].Plant Physiology,2003,133 (2):517-527.
[8] REED J W,FOSTER K R,MORGAN P W,et al.Phytochrome B affects responsiveness to gibberellins in Arabidopsis[J].Plant Physiology,1996,112(1):337-342.
[9] SMEEKENS S.Sugar-induced signal transduction in plants[J].Annual Review of Plant Physiology and Plant Molecular Biology,2000,51(1):49-81.
[10] ZHANG Y,LIU Z,WANG L,et al.Sucrose-induced hypocotyl elongation of Arabidopsis seedlings in darkness depends on the presence of gibberellins[J].Journal of Plant Physiology,2010,167(14):1130-1136.
[11] MOALEM-BENO D,TAMARI G,LEITNER-DAGAN Y,et al.Sugar-dependent gibberellin-induced chalcone synthase gene expression in Petunia corollas[J].Plant Physiology,1997,113(2):419-424.
[12] LORETI E,POVERO G,NOVI G,et al.Gibberellins,jasmonate and abscisic acid modulate the sucrose-induced expression of anthocyanin biosynthetic genes in Arabidopsis [J].New Phytologist,2008,179(4):1004-1016.
[13] COULSON A,SULSTON J,BRENNER S,et al. Toward a physical map of the genome of the nematode Caenorhabditis elegans[J].Proceedings of the National Academy of Sciences of the United States of America, 1986,83(20):7821-7825.
[14] YU J,QIU H,LIU X,et al.Characterization of tub4P287L,aβ-tubulin mutant,revealed new aspects of microtubule regulation in shade [J].Journal of Integrative Plant Biology,2015,57(9):757-769.
[15] CZECHOWSKI T,STITT M,ALTMANN T,et al.Genome-wide identification and testing of superior reference genes for transcript normalization in Arabidopsis[J].Plant Physiology,2005,139(1):5-17.
[16] 刘超,林陈水.不依赖于连接反应克隆(LIC)的技术进展[J].基因组学与应用生物学,2011,30:1081-1085.
[17] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南:上册[M].3版.黄培堂,译.北京:科学出版社,2002:93-102.
[18] CLOUGH S J,BENT A F.Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J].Plant Journal,1998,16(6): 735-743.
[19] SALTER M G,FRANKLIN K A,WHITELAM G C. Gating of the rapid shade-avoidance response by the circadian clock in plants[J].Nature,2003,426(6967): 680-683.
[20] SESSA G,CARABELLI M,SASSI M,et al.A dynamic balance between gene activation and repression regulates the shade avoidance response in Arabidopsis[J].Genes & Development,2005,19(23):2811-2815.
GA Biosynthetic Enzyme GA3OX1 Required for Shade Avoidance in Arabidopsis
DONG Kangmei,ZHU Yaping,WANG Meiling,TAO Yi*
(School of Life Sciences,Xiamen University,Xiamen 361102,China)
Abstract:Shade avoidance response is a plastic response induced in the shade-avoiding species in response to shade.It is an important adaptive response that allows plants to compete for light when it is under or near vegetative shade.In this study,we isolated a sav8 (shade avoidance 8)mutant that was defective in multiple shade avoidance responses.We characterized the phenotypes of sav8 and conducted map-based cloning to identify the mutation in it.Compared with wild type(Col-0),sav8 had shorter hypocotyls under simulated shade and dark,and adult sav8 was smaller,more branchy,and with reduced apical dominance.Under simulated shade,sav8 was hypersensitive to gibberellins(GA).Through map-based cloning,we identified that sav8 contains a C-to-T mutation in a GA synthetic gene GA3OX1(AT1g15550),which converted Gln309 to a stop codon and encoded a truncated protein.TAA1(tryptophan aminotransferase of Arabidopsis 1)is a key gene required for the shade avoidance responses.Our study showed that GA3OX1 was up-regulated by shade in a TAA1-independent manner.Taking together,our study demonstrated that GA3OX1 is a key gene required for shade avoidance response.
Key words:Arabidopsis;shade avoidance response;GA3OX1;gibberellins(GA)
*通信作者:yitao@xmu.edu.cn
基金项目:福建省科技计划项目(2008F3102)
收稿日期:2015-03-31 录用日期:2015-05-25
doi:10.6043/j.issn.0438-0479.2016.02.007
中图分类号:Q 945.7
文献标志码:A
文章编号:0438-0479(2016)02-0184-08
引文格式:董康梅,朱亚萍,王梅玲,等.GA合成酶GA3OX1参与拟南芥避荫反应[J].厦门大学学报(自然科学版),2016,55 (2):184-191.
Citation:DONG K M,ZHU Y P,WANG M L,et al.GA Biosynthetic enzyme GA3OX1 required for shade avoidance in Arabidopsis[J].Journal of Xiamen University(Natural Science),2016,55(2):184-191.(in Chinese)

