阳离子卟啉衍生物的体外光动力抗菌活性研究
洪阁 纪海莹 庞丽云 苏喆 刘天军
300192天津,中国医学科学院北京协和医学院生物医学工程研究所,天津市生物医学材料重点实验室
阳离子卟啉衍生物的体外光动力抗菌活性研究
洪阁 纪海莹 庞丽云 苏喆 刘天军
300192天津,中国医学科学院北京协和医学院生物医学工程研究所,天津市生物医学材料重点实验室
目的 研究阳离子卟啉衍生物介导的光动力抗菌化学疗法(CPD-PACT)对体外培养的绿脓杆菌的抑制作用,为研究其高效的抗菌作用特点提供依据。方法 采用二倍稀释法考察培养条件对CPD最小抑菌浓度(MIC)的影响,扩散法测定CPD的抑菌圈,活菌计数法测定CPD的体外抗菌后效应,并通过激光扫描共聚焦显微镜(CLSM)观察绿脓杆菌的活力和形态变化。结果 细菌接种量对MIC值存在一定的影响;培养基pH值的升高会使化合物的MIC值相应升高;血清蛋白体积分数的增加会使光反应的MIC值升高,而暗反应的MIC值降低。抑菌圈的大小主要取决于激光能量密度的强弱,而受光敏剂浓度的影响较小。CPD对绿脓杆菌有较强的抑制和杀灭作用,且存在明显的抗菌后效应,但光疗结束后存活的细菌会继续增殖。CLSM观察结果表明,CPD-PACT可破坏细菌外膜完整性,使细菌内容物泄露,活力减弱,最终导致细菌死亡。结论CPD-PACT对绿脓杆菌具有高效的抗菌活性和明显的抗菌后效应,适合作为新一代抗菌候选药物进行深度开发。
阳离子卟啉衍生物; 绿脓杆菌; 光动力抗菌; 抑菌活性
Fund program:Key Technology Research and Development Program of Tianjin(12ZCDZSY11900); Fundamental Research Funds for the Central Universities(1517);Open Project of Key Laboratory of Disaster& Emergency Rescue Medicine in People's Liberation Army(JY1405)
0 引言
绿脓杆菌又称铜绿假单胞菌,是一种无芽孢的革兰氏阴性菌,广泛分布于自然界及正常人的皮肤、呼吸道和肠道中。当机体免疫功能下降时(如大面积烧伤、创伤等),绿脓杆菌易引发肺炎、中耳炎、脑膜炎、尿道炎、脓毒症和败血症等继发感染类疾病。目前,临床上治疗绿脓杆菌感染的药物主要是抗生素。近年来,由于抗生素的不合理使用和细菌的变异导致绿脓杆菌出现获得性耐药,甚至多重耐药,给临床抗感染治疗带来了极大的挑战[1]。因此,寻找新的抗感染策略和抗菌药物迫在眉睫。
光动力抗菌化学疗法(photodynamic antimicrobial chemotherapy,PACT)是目前最具前景的新疗法之一,其原理是利用光敏剂在适当波长的光照射下,与生物组织中的分子氧反应,生成单线态氧、自由基等活性氧成分,从而杀灭机体内的病原微生物。与传统的抗生素治疗相比,PACT具有抗菌谱广、细菌选择性强、毒副作用低、不易产生耐药性、可用于局部治疗等诸多优势[2],有望成为一种专门治疗耐药菌感染的新型替代疗法[3-6]。光、光敏剂和氧是PACT必备的3个基本要素,其中光敏剂是PACT的关键。本研究主要介绍一种新型的阳离子卟啉衍生物(cationic porphyrin derivative,CPD)光敏剂——5,10,15,20-四{4-[(S)-2,6-二氨基己酰胺基]苯基}卟啉(化学结构式见图1)及其对体外培养的绿脓杆菌的抗菌活性,并初步探讨其可能的抗菌作用机制,为其在临床外伤感染治疗中的应用提供理论依据。
1 材料与方法
1.1 主要材料与仪器
绿脓杆菌(ATCC27853)(武警后勤学院附属医院灾害应急救援医学全军重点实验室赠予),CPD(深紫色固体粉末,经HPLC检测纯度>98%)(中国医学科学院生物医学工程研究所分子设计与纳米技术实验室自行合成),LIVE/DEAD细菌活力检测试剂盒(美国Thermo Fisher Scientific公司)。LB液体培养基:胰蛋白胨1.0 g,酵母提取物0.5 g,氯化钠0.5 g,加入100 ml蒸馏水溶解,调节pH值为7.2~7.4,高压灭菌,置于4℃保存备用。LB固体培养基(琼脂平板):胰蛋白胨10.0 g,酵母提取物5.0 g,氯化钠5.0 g,琼脂15.0 g,加入1 000 ml蒸馏水溶解,调节pH值为7.2~7.4,高压灭菌,倒入有盖的培养皿中,使琼脂凝固,置于4℃保存备用。
HF90 CO2培养箱(力康生物医疗科技控股有限公司),1110离心机(德国Hettich公司),3001多功能酶标仪(美国Thermo Fisher Scientific公司),LSM710激光扫描共聚焦显微镜(confocal laser scanning microscopy,CLSM)(德国Carl Zeiss公司),7404型半导体激光器(美国Intense公司)。
1.2 方法
1.2.1 细菌悬液的制备
取-80℃冻存的绿脓杆菌100 μl接种于10 ml LB液体培养基中,37℃摇床中培养至对数生长期;将菌液划线接种于LB固体培养基上,37℃培养过夜;挑取单菌落接种于5 ml LB液体培养基中,37℃摇床中培养过夜;再以LB液体培养基调整菌液浓度为1×108CFU/ml,4℃保存备用。
1.2.2 光敏剂溶液的配制
精密称取CPD固体粉末11.9mg,用少量水溶解,定容至1 ml,得浓度为1×104μmol/L的CPD母液,4℃避光保存,实验时以磷酸盐缓冲液(phosphate buffered saline,PBS)稀释CPD母液至所需浓度。
运用拟人手法编出这一段菊花与主人公的对话,这是菊花对主人公的提问,因为菊花不能从大地吸收养分而衰弱下去,这是表现菊花对大地的渴望。这话也是主人公即作者中野重治的自白。被带到监狱里来,被和人民大众隔离,监狱的生活又很艰苦,可以理解为作者也不能从大地吸收养分的比喻。巧妙地借菊花的口把这话说出来表达自己的思念劳苦大众的内心。
1.2.3 不同培养条件对CPD抑菌活性的影响
取制备好的细菌悬液用LB液体培养基稀释成2×105CFU/ml,取稀释后的菌液和不同浓度的光敏剂溶液各100 μl加入96孔板中,使最终反应液中CPD的浓度依次为 250.00、125.00、62.50、31.25、15.62、7.81、3.91、1.95 μmol/L,每个浓度设3个复孔;同时设无药对照孔(只加菌液,不加光敏剂溶液)和无菌对照孔(只加LB液体培养基),混匀后37℃暗孵育30 min;以波长为650 nm的红色激光进行照射,激光能量密度为3 J/cm2,光照时间为30 min,暗反应则无光照过程;光照结束后,37℃培养18 h,观察细菌生长情况,无肉眼可见细菌生长的最低药物浓度即为 CPD对绿脓杆菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。
按上述方法,在测定过程中分别将细菌接种量设为108、107、106、105、104、103CFU/ml;LB液体培养基的pH值设为5、6、7、8、9;血清蛋白的体积分数设为0、25%、50%、75%,测定CPD在不同细菌接种量、培养基pH值和血清蛋白体积分数培养条件下的抑菌效果。
1.2.4 抑菌圈的测定
按文献[3]测定抑菌圈:取制备好的细菌悬液用LB液体培养基稀释成2×107CFU/ml,再将稀释后的菌液和不同浓度的光敏剂溶液等体积混合,使最终反应液中CPD的浓度依次为 62.50、31.25、15.62 μmol/L,无药对照组则以PBS代替光敏剂溶液,混匀后37℃暗孵育30 min;吸取上述反应液100 μl,均匀涂布于LB固体培养基中;以波长为650 nm的红色激光进行照射,激光能量密度分别为0、64、128、192 J/cm2,光照时间分别为0、10、20、30 min,光斑直径为1 cm;光照结束后,37℃培养18 h,用游标卡尺测量抑菌圈的直径(mm)。
1.2.5 体外抗菌后效应的测定
取制备好的细菌悬液用LB液体培养基稀释成2×105CFU/ml,再将稀释后的菌液和不同浓度的光敏剂溶液等体积混合,使最终反应液中CPD的浓度依次为3.91、1.95、0.98、0.49、0.24 μmol/L,无药对照组则以PBS代替光敏剂溶液,混匀后37℃暗孵育30 min;以波长为650 nm的红色激光进行照射,激光能量密度为3 J/cm2,光照时间为30 min;光照结束后0、1、2、4、8、12、24 h,分别吸取100 μl反应液,以培养液10倍系列稀释,均匀涂布于LB固体培养基上,每个稀释度涂布3次,37℃培养18 h后进行菌落计数。以各时间点菌落数的对数为纵坐标,光照后的孵育时间为横坐标,绘制细菌恢复生长动力学曲线,并按以下公式计算各浓度组的体外抗菌后效应(postantibiotic effect,PAE)
PAE=T-C
式中:T为各实验组细菌数量(CFU/ml)高于光疗结束时10倍所需的时间(h),C为对照组细菌数量(CFU/ml)高于光疗结束时10倍所需的时间(h)。1.2.6 SYTO9/碘化丙啶染色法检测细菌活力
取制备好的细菌悬液用LB液体培养基稀释成2×107CFU/ml,再将稀释后的菌液和光敏剂溶液等体积混合,使最终反应液中CPD浓度为7.81 μmol/L,无药对照组则以生理盐水代替光敏剂溶液,混匀后37℃暗孵育30 min;以波长为650 nm的红色激光进行照射,激光能量密度为3J/cm2,光照时间为30min;光照结束后,9 000 r/min离心5 min,弃上清;沉淀用生理盐水洗涤2次,9000r/min离心5min;加1ml生理盐水重悬沉淀,再加入1.5 μl浓度为3.34 mmol/L的SYTO9和1.5 μl浓度为20 mmol/L的碘化丙啶(propidium iodide,PI),室温避光孵育15 min后加至共聚焦培养皿中,避光晾干;最后用CLSM观察细菌的形态变化和微观结构。
2 结果
2.1 不同培养条件对CPD抑菌活性的影响
细菌接种量对MIC值的影响如表1所示:随着细菌接种量的增加,CPD对绿脓杆菌的MIC值有一定的影响;当细菌接种量为103~105CFU/ml时,CPD对绿脓杆菌光反应和暗反应的MIC值均无变化;当细菌接种量为106~108CFU/ml时,光反应的MIC值有所升高,且只有接种量为108CFU/ml时暗反应的MIC值升高了3倍。培养基pH值对MIC值的影响如表2所示:随着培养基pH值的升高,CPD对绿脓杆菌的MIC值也增大;当pH值为5时,光反应和暗反应的MIC值均很小,推测该pH环境不适宜绿脓杆菌的生长;而当pH值升至9时,光反应的MIC值较pH为6~7时约升高了7倍,暗反应的MIC值升高了1倍,说明碱性环境会减弱CPD对绿脓杆菌的抑菌效果。培养基中血清蛋白体积分数对MIC值的影响如表3所示:随着血清蛋白体积分数的增加,CPD对绿脓杆菌光反应的MIC值也升高,而暗反应的MIC值则有所降低;当培养基中血清蛋白的体积分数升至25%、50%和75%时,光反应的MIC值与血清蛋白体积分数为0时相比分别升高了约7倍、7倍和15倍,而暗反应则分别降低了约87.5%、87.5和75.0%。

表1 细菌接种量对MIC值的影响(μmol/L)
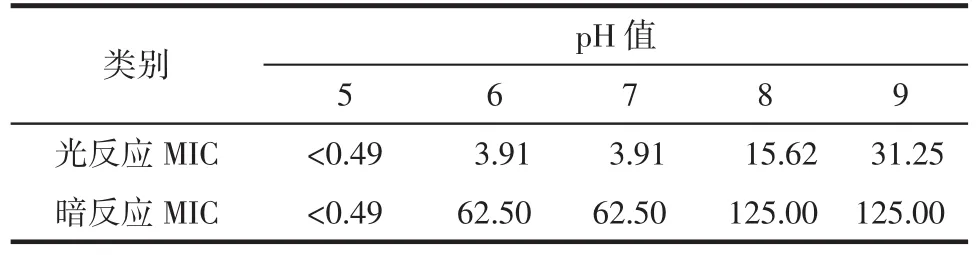
表2 培养基pH值对MIC值的影响(μmol/L)

表3 培养基中血清蛋白体积分数对MIC值的影响(μmol/L)
2.2 抑菌圈的测定
CPD浓度和激光能量密度对绿脓杆菌抑菌圈直径的影响见表4。结果表明:随着激光能量密度的增强,CPD对绿脓杆菌的抑菌圈直径也逐渐增大;当激光能量密度为0时,光敏剂没有抑菌圈,提示无抗菌效果;当激光能量密度增强至64、128、192 J/cm2时,光敏剂的抑菌圈直径相应增大,分别为15、20、25 mm;当激光能量密度相同时,光敏剂的抑菌圈直径也相同。因此,在一定的浓度范围内(15.62~62.50 μmol/L),光敏剂的抑菌圈直径主要取决于激光能量密度的强弱,而受光敏剂浓度的影响较小。
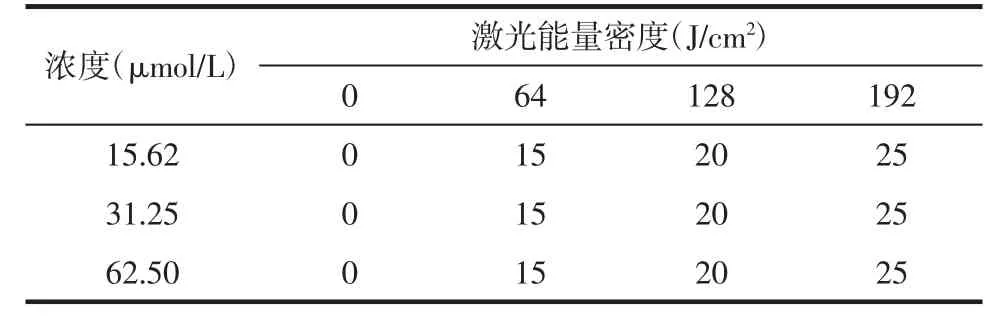
表4 阳离子卟啉衍生物浓度和激光能量密度对绿脓杆菌抑菌圈直径的影响(mm)
2.3 体外PAE的测定
经不同浓度的CPD介导的PACT(CPD-PACT)后,绿脓杆菌恢复生长的情况见图2。当CPD的浓度为0~0.49 μmol/L时,光疗结束时细菌数量未明显减少,PAE值为0~1.5 h;当CPD的浓度为0.98~1.95 μmol/L时,光疗结束时细菌数量明显减少,PAE值为1.5~2.5 h;当CPD的浓度为3.91 μmol/L时,光疗结束时细菌已全被杀死。因此,CPD-PACT对绿脓杆菌存在明显的抗菌后效应(PAE),且PAE值呈浓度依赖性,随着光敏剂浓度的增大,存活细菌数量逐渐减少,体外PAE时间逐渐延长。当光疗结束2 h后,各实验组存活的细菌会继续增殖,经对数生长期到达平台期。
2.4 绿脓杆菌活力的检测
在CLSM下,无药对照组的细菌在明场图像中呈杆状分布,轮廓清晰,外观饱满,并在荧光图像中呈明显的绿色荧光(SYTO9),无红色荧光信号(PI),说明样本中均为活菌;CPD-PACT组的细菌在明场图像中呈团状分布,轮廓模糊,大部分细菌胞壁破裂,内容物泄露,并在荧光图像中呈红绿相间的荧光信号,说明部分细菌死亡,部分细菌存活,两者数量基本相当。(图3)
3 讨论与结论
近年来,随着新的耐药机制的不断出现和传播,越来越多的细菌感染变得难以治疗,有时甚至无法治疗[7]。抗生素耐药性正在严重威胁着人类治疗医院和社区普通感染的能力,若无有效的抗感染治疗,许多标准的治疗方法均会失败或变成高风险程序;一旦全世界进入后抗生素时代,普通感染和轻微损伤都将会再次造成死亡[8]。因此,研发新的抗感染策略和抗菌药物已迫在眉睫。大量研究证实,阳离子卟啉光敏剂可有效杀灭体外培养的多种耐药菌[9],显示出高效低毒的抗菌作用特点,但其抗菌作用机制尚不明确,推测与光动力疗法(PDT)的抗肿瘤机制相似[10-11],即光敏剂分子在激光照射下发生能级跃迁和能量转移,释放出大量活性氧物质,诱导细菌微生物氧化失活。本研究的细菌活力检测实验证实PACT的作用机理与光敏剂选择性攻击细菌表面的膜性结构有关。
卟啉是4个吡咯环通过亚甲基相连形成的具有18个π电子的大环共轭体系,国内外多项研究表明,卟啉类光敏剂对革兰氏阳性菌和革兰氏阴性菌均具有良好的抗菌活性[5,12-14],特别是带正电荷的阳离子卟啉光敏剂,由于微生物细胞膜内正外负的特殊结构,而具有更好的细菌选择性。本研究介绍的CPD是通过赖氨酸对氨基四苯基卟啉进行结构修饰得到的阳离子卟啉光敏剂,从培养条件对CPD抑菌活性的影响、抑菌圈和体外PAE的测定3个实验可看出,带正电荷的赖氨酸分子的引入,可明显提高四苯基卟啉母核的光动力抗菌活性,同时由于修饰产物CPD的水溶性明显提高,也为改善生物利用度和制剂研究提供了便利。
与传统抗生素治疗相比,PACT具有抗菌谱广、不易产生耐药性和毒副作用低的优势,本研究结果亦证实阳离子卟啉光敏剂CPD具有高效的抗菌作用特点。目前有关PACT的研究主要集中于体外抗菌药效学,也有部分研究将PACT应用于口腔细菌感染和局部创伤感染的治疗[15-16]。相信随着新型光敏剂的开发和作用机制研究的深入,可预见将PACT应用于临床治疗病原微生物感染一定会成为现实。
利益冲突 无
(图1~3见插页4-11)
[1]张伟,李闻,张伟尉,等.基于PCR技术的绿脓杆菌快速检测方法研究[J].中国卫生检验杂志,2005,15(9):1065-1067.DOI:10.3969/ j.issn.1004-8685.2005.09.016. Zhang W,Li W,Zhang WW,et al.The methodological study on rapid identification of Pseudomonas aeruginosa based on PCR technique[J].Chin J Health Lab Techol,2005,15(9):1065-1067. DOI:10.3969/j.issn.1004-8685.2005.09.016.
[2]Chen Z,Zhou SY,Chen JC,et al.An effective zinc phthalocyanine derivative for photodynamic antimicrobial chemotherapy[J].J Lumin, 2014,152:103-107.DOI:10.1016/j.jlumin.2013.10.067.
[3]Park JH,Moon YH,Bang IS,et al.Antimicrobial effect of photodynamic therapy using a highly pure chlorin e6[J].Lasers Med Sci,2010,25(5):705-710.DOI:10.1007/s10103-010-0781-1.
[4]Liu C,Zhou Y,Wang L,et al.Mechanistic aspects of the photodynamic inactivation of vancomycin-resistant Enterococci mediated by 5-aminolevulinic acid and 5-aminolevulinic acid methyl ester[J]. Curr Microbiol,2015,70(4):528-535.DOI:10.1007/s00284-014-0757-7.
[5]Latief MA,Chikama T,Shibasaki M,et al.Antimicrobial action from a novelporphyrin derivative in photodynamic antimicrobialchemotherapy in vitro[J].Lasers Med Sci,2015,30(1):383-387.DOI: 10.1007/s10103-014-1681-6.
[6]Ragàs X,Sánchez-García D,Ruiz-González R,et al.Cationic porphycenesaspotentialphotosensitizersforantimicrobialphotodynamic therapy[J].J Med Chem,2010,53(21):7796-7803.DOI:10.1021/ jm1009555.
[7]Maisch T.Resistance in antimicrobial photodynamic inactivation of bacteria[J].Photochem Photobiol Sci,2015,14(8):1518-1526.DOI: 10.1039/c5pp00037h.
[8]Mcdermott PF,Walker RD,White DG.Antimicrobials:Modes of action and mechanisms of resistance[J].Int J Toxicol,2003,22(2): 135-143.DOI:10.1080/10915810305089.
[9]孙实,靳衡,袁瑶,等.新型抗菌活性氨基酸卟啉光敏剂4I体外研究[J].国际生物医学工程杂志,2015,38(6):340-344.DOI: 10.3760/cma.j.issn.1673-4181.2015.06.005. Sun S,Jin H,Yuan Y,et al.In vitro study of the antibacterial activity of novel amino acid-porphyrin photosensitizer 4I[J].Int J Biomed Eng,2015,38(6):340-344.DOI:10.3760/cma.j.issn.1673-4181.2015.06.005.
[10]洪阁,郭江红,杨晓姣,等.亚氨基二乙酸修饰四苯基卟啉光敏剂介导的光动力疗法对H22肝癌小鼠体内抗肿瘤作用的研究[J].国际生物医学工程杂志,2013,36(3):139-142.DOI:10.3760/cma. j.issn.1673-4181.2013.03.003. Hong G,Guo JH,Yang XJ,et al.Photodynamic therapeutic effect of iminodiacetic acid modified tetraphenylporphyrin in mice bearing H22liver cancer[J].Int J Biomed Eng,2013,36(3):139-142.DOI: 10.3760/cma.j.issn.1673-4181.2013.03.003.
[11]雷万华,王雪松.光动力抗菌光敏剂的研究进展[J].影像科学与光化学,2013,31(5):321-334.DOI:10.7517/j.issn.1674-0475.2013. 05.321. LeiWH,Wang XS.Research progress ofphotodynamic antimicrobial photosensitizers[J].Imag Sci Photochem,2013,31(5): 321-334.DOI:10.7517/j.issn.1674-0475.2013.05.321.
[12]Hanakova A,Bogdanova K,Tomankova K,et al.The application of antimicrobial photodynamic therapy on S.aureus and E.coli using porphyrin photosensitizers bound to cyclodextrin[J].Microbiol Res, 2014,169(2/3):163-170.DOI:10.1016/j.micres.2013.07.005.
[13]Banfi S,Caruso E,Buccafurni L,et al.Antibacterial activity of tetraaryl-porphyrin photosensitizers:an in vitro study on Gram negative and Gram positive bacteria[J].J Photochem Photobiol B, 2006,85(1):28-38.DOI:10.1016/j.jphotobiol.2006.04.003.
[14]Meng S,Xu Z,Hong G,et al.Synthesis,characterization and in vitro photodynamic antimicrobial activity of basic amino acid-porphyrin conjugates[J].Eur J Med Chem,2015,92:35-48.DOI:10.1016/j. ejmech.2014.12.029.
[15]Sun Y,Xing D,Shen L,et al.Bactericidal effects of hematoporphyrin monomethylether-mediated photosensitization against pathogenic communities from supragingival plaque[J].Appl Microbiol Biotechnol,2013,97(11):5079-5087.DOI:10.1007/s00253-013-4903-0.
[16]Huang L,Wang M,Dai T,et al.Antimicrobial photodynamic therapy with decacationic monoadducts and bisadducts of[70]fullerene:in vitro and in vivo studies[J].Nanomedicine(Lond),2014,9(2):253-266.DOI:10.2217/nnm.13.22.
In vitro photodynamic antibacterial activity of cationic porphyrin derivative
Hong Ge,Ji Haiying,Pang Liyun,Su Zhe,Liu Tianjun
Insitute of Biomedical Engineering,Chinese Academy of Medical Sciences&Peking Union Medical College,Tianjin Key Laboratory of Biomedical Materials,Tianjin 300192,China
Liu Tianjun,Email:liutianjun@hotmail.com
Objective To investigate susceptibility and antibacterial activity of cationic porphyrin derivative mediated photodynamic antimicrobial chemotherapy(CPD-PACT)against Pseudomonas aeruginosa,to provide experimental evidence for its high efficiency antibacterial activity.Methods The impacts of culture environments on minimum inhibitory concentration(MIC)were measured by double dilution method.The formation of inhibition zone was determined by diffusion plate method.The postantibiotic effect was analyzed by colony forming units.The viability and morphology of Pseudomonas aeruginosa were observed by confocal laser scanning microscopy (CLSM).Results The inoculum size of bacterial had a certain effect on the MIC.The MIC values increased as the pH of medium rose.When the calf serum content of culture medium increased,the MIC rose in light reaction and dropped in dark reaction.The diameter of inhibition zone mainly depended on the laser energy density,but not the concentration of photosensitizer.Though CPD possessed strong antimicrobial activity and persistent suppression on bacterial growth,the surviving Pseudomonas aeruginosa would soon continue to proliferate after PACT.The fluorescence images captured by CLSM showed that CPD-PACT could destroy the membrane integrity,leak the cytoplasmic component,decrease the bacterial activity and finally lead Pseudomonas aeruginosa to death. Conclusions CPD has strong inhibitory activity and obvious postantibiotic effect on Pseudomonas aeruginosa,which is suitable to be developed as an drug candidate for PACT.
Cationic porphyrin derivative; Pseudomonas aeruginosa; Photodynamic antimicrobial chemotherapy;Antibacterial activity
刘天军,Email:liutianjun@hotmail.com
10.3760/cma.j.issn.1673-4181.2016.04.006
天津市科技支撑计划项目(12ZCDZSY11900);中央高校基本科研业务费专项(1517);中国人民武装警察部队后勤学院灾害应急救援医学全军重点实验室开放基金(JY1405)
2016-04-29)

