原发性结节性皮肤淀粉样变研究进展
郑蕾,刘巧
·综述·
原发性结节性皮肤淀粉样变研究进展
郑蕾,刘巧

郑 蕾
原发性结节性皮肤淀粉样变是原发性皮肤淀粉样变的最少见亚型,其特征为蜡样光泽的黄棕色结节或斑块,组织病理改变为在真皮、皮下及血管壁弥漫性淀粉样蛋白沉积。研究发现,结节性淀粉样变可能与创伤、IL-6家族细胞因子受体基因突变、免疫功能异常等有关。手术切除、电干燥法、刮除术、冷冻术、局部糖皮质激素注射和皮肤磨削术为结节性淀粉样变的主要治疗手段。近年来研究发现局部注射淀粉样蛋白抗体的免疫疗法有望成为该病新的有效的治疗手段。
淀粉样变,皮肤,结节性;病因;诊断;治疗
[J Pract Dermatol, 2016, 9(6):380-382]
研究认为淀粉样变是一种淀粉样蛋白在组织、器官的细胞外异常沉积的疾病。临床上淀粉样变可以分为原发性(继发)皮肤淀粉样变及原发性(继发)系统性淀粉样变。根据临床及组织学特征,原发性皮肤淀粉样变可分为:斑状淀粉样变、苔藓性淀粉样变及结节性淀粉样变,其共同特征是在细胞外有异常的淀粉样蛋白的沉积。其中结节性淀粉样变临床上较为少见,本病的发病机制病因尚不明确。近年来,在免疫、基因等领域进行了研究,现就其病因、发病机制、诊断及治疗等方面最新进展进行阐述。
1 淀粉样物质
原发性皮肤淀粉样变中异常沉积的淀粉样蛋白主要由淀粉样原纤维蛋白、淀粉样蛋白P成分及细胞外基质成分构成,其中淀粉样原纤维蛋白为淀粉样蛋白的主要成分,通过免疫组化,可将淀粉样蛋白分为含免疫球蛋白轻链的AL蛋白、非免疫球蛋白的AA蛋白、变性的角蛋白(altered keratin,AK)、β2微球蛋白等。斑状及苔藓性淀粉样变患者淀粉样蛋白局限于真皮乳头层,目前大多认为淀粉样蛋白来源于表皮角质形成细胞纤维变性凋亡,胶样小体脱落到真皮转变而来,故淀粉样蛋白主要为变性的AK。结节性淀粉样变中淀粉样蛋白可弥漫性沉积于真皮、皮下及血管壁,沉积物周围可见浆细胞及淋巴细胞浸润。免疫组化研究显示结节性淀粉样变中淀粉样沉积物主要成分为免疫球蛋白轻链(γ和κ)及β-微球蛋白等,而在其他类型的皮肤淀粉样变中未发现这些物质[1]。基因重排研究证实分泌淀粉样蛋白的浆细胞在皮肤中克隆增生而非骨髓中增生,提示结节性淀粉样变可能是一种局部髓外浆细胞瘤,淀粉样蛋白可能由邻近沉积区的浆细胞分泌产生,然而浆细胞局部分泌淀粉样蛋白的机制尚不清楚[2]。结节型淀粉样变中淀粉样物质并非全来源于免疫球蛋白轻链,Cornejo等报道1例结节性淀粉样变,组织病理示真皮全层嗜酸无定形物质沉积,刚果红染色呈红色,偏振显微镜下呈苹果绿双折光,沉淀物免疫组化示免疫球蛋白轻链γ和κ均阴性,AK阳性,脂质色谱串联质谱分析确定沉积物为来源于AK的AK型[3]。
2 病因
结节性皮肤淀粉样变的病因及发病机制目前尚不清楚,有相关文献表明与创伤、自身免疫、遗传等相关。原创伤部位发生结节性淀粉样变的报道并不少见,提示创伤可能是结节性淀粉样变的病因之一。Ritchie等[4]报道1例42岁中年男性双足跖结节性淀粉样变,部分皮损部位之前曾因运动发生过水疱。Trignano等[5]报道1例左颞部反复外伤后发生结节性淀粉样变。Lee 等[6]报道1例50岁中年韩国男性头皮结节性淀粉样变,其头部皮损部位曾常受到足球冲撞,且在结节形成前几天受到过一次严重的撞击。这些提示局部创伤可能是结节性淀粉样变发生的一个潜在触发点,然而仍需更多的研究验证局部创伤与结节性淀粉样变之间的因果关系。
结节性淀粉样变与一些自身免疫性疾病相关,如干燥综合征、CREST综合征(calcinosis,Raynaud's phenomenon,esophagealmotilitydisorders,sclerodactyly and telangiectasia)、糖尿病、原发性胆汁性肝硬化等,推测结节性淀粉样变的发生可能与免疫功能异常有关[7-9]。Fujisawa 等[10]报道1例患有严重特应性皮炎的患者,使用环孢素治疗后发生结节性淀粉样变,虽然不能确定是特应性皮炎或环孢素,亦或是二者共同引起结节性淀粉样变,但作者推测可能是由于免疫系统异常造成淀粉样蛋白在皮肤中沉积所致。Ung等[11]报道1例银屑病背景下的结节性淀粉样变病,既往研究发现Th17细胞在促进浆细胞疾病和多发性骨髓瘤中发挥重要作用,且在关节病性银屑病患者中更易出现副球蛋白血症,而Th17细胞产生的白细胞介素(IL)-17是银屑病发病机制中的重要细胞因子。结合这些研究,作者推测银屑病皮损微环境中Th17可能激发B淋巴细胞的活化,参与结节性淀粉样变的形成过程,但仍需相关实验证实。对蛋白结构折叠异常疾病的新认知揭示,小的错误折叠蛋白即低聚物比纤维蛋白物质在疾病发病机制中发挥更为重要的作用。Clos 等[12]运用双免疫荧光证实结节性淀粉样变存在淀粉样蛋白低聚物和淀粉样原纤维,细胞内外均有分布,而在正常对照组中未发现,提示淀粉样蛋白低聚物具有特异性。在细胞毒性试验中低聚物对角质形成细胞有毒性作用,在疾病的进展中角质形成细胞周边的淀粉样免疫球蛋白低聚物可能造成角质形成细胞的死亡。因此,结节性淀粉样变可能与其他淀粉样变病具有共同的致病途径。浆细胞产生的免疫球蛋白低聚物具有细胞毒性,而淀粉样纤维蛋白的形成可能是对抗低聚物毒性的一种自我保护机制。Clos等[13]给小鼠皮内注射从系统性淀粉样变小鼠肝脏中提取的淀粉样蛋白纤维,结果造成小鼠皮肤淀粉样物质沉积,提示Cross-seeding是淀粉样沉积物形成机制之一。Crossseeding是指预先存在的蛋白聚集体可促进其他种类的蛋白质的构象变化和聚集的现象。作者接着给这些小鼠皮损局部注射淀粉样纤维及低聚物抗体,与未治疗的对照组相比,真皮中淀粉样物质明显减少。免疫疗法可能成为治疗结节性淀粉样变的新方法。在基因水平的研究中,Arita等[14]指出抑瘤素Mβ受体(oncostatin M receptor beta,OSMRβ)与IL-31 A受体(interleukin-31 receptor A,IL31-RA)中基因突变造成其纤维连接蛋白Ⅲ型结构域中的氨基酸的改变可能影响了OSMRβ与IL31-RA偶联,同时对患者角质形成细胞培养中发现 OSM和IL-31降低了信号传导及转录激活因子(signal transducers and activators of transcription,STATs)、细胞外调节蛋白激酶1/2(extracellular regulated protein kinases,ERK1/2)、蛋白激酶B(proteinkinase B,Akt/PKB)磷酸化水平,导致信号传导通路异常,进而促进角质形成细胞的凋亡和淀粉样物质的沉积。Lin等[15]对29个原发性皮肤淀粉样变的台湾家系进行基因研究,发现了3个新的OSMR基因突变位点和1个新的IL-31RA基因突变位点,并再次证实OSMR和IL-31RA这两种编码IL-6家族细胞因子受体基因与家族原发皮肤淀粉样变有关,但由OSMR和IL31-RA突变造成的信号传导异常如何引起原发皮肤淀粉样变的具体机制仍待进一步研究。作者的研究结果为家族皮肤淀粉样变具有遗传异质性提供了新的有力证据。
3 临床表现及组织病理改变
3.1 临床表现
结节性皮肤淀粉样变发病年龄24~87岁,平均发病年龄为57岁,无明显的性别差异[16]。皮损最常见双下肢,其他好发部位为头面部、躯干、上肢及生殖器[3,4,11,16,17]。典型皮损为单发或多发的数毫米至数厘米的黄棕色结节或斑块,蜡样光泽,界限清楚,可有毛细血管扩张,结节中央皮肤有时可发生萎缩和松弛,或呈大疱样[18,19](图1)。亦有报道初发皮损呈干燥性湿疹样改变[20]。皮损可无症状,也可伴发瘙痒、疼痛。
3.2 组织病理表现
结节性淀粉样变典型的组织病理表现为表皮萎缩,真皮全层及皮下组织可见大量嗜酸性的无定型均一物质沉积。小血管壁及脂肪细胞周围也可见沉积物。沉积物周围可有浆细胞局灶性浸润。沉积物荧光硫代黄素T染色呈黄绿色荧光,结晶紫染色阳性,刚果红染色阳性,在偏振光显微镜下,刚果红染色呈针芒状苹果绿色双折光性[4-7,10,18,19]。电子显微镜下,淀粉样蛋白由直且不分叉、不吻合的原纤维构成,直径为7~10 mm。
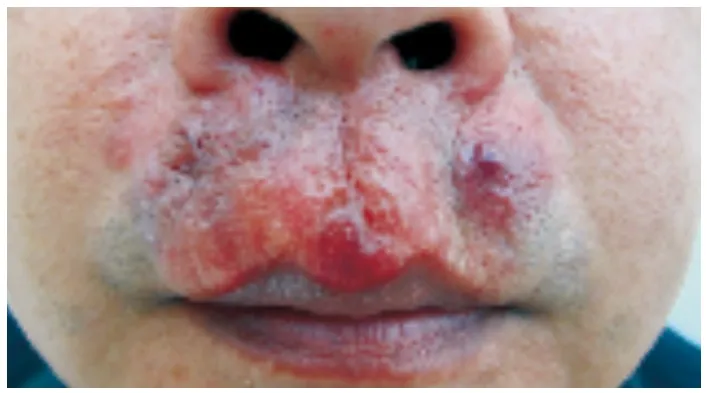
图1 结节性皮肤淀粉样变病患者面部皮损
4 诊断
依据典型临床表现、组织病理改变及排除系统性淀粉样变即可确诊。原发性系统性淀粉样变皮损及皮肤组织病理与皮肤结节性淀粉样变相似,但系统性淀粉样变侵袭全身多个器官,需行系统性检查确认是否有其他器官受累。
5 治疗与预后
5.1 局部治疗
结节性淀粉样变是一十分少见的疾病,治疗上尚未达成共识。目前治疗主要目的是改善外观,达到美容效果,非病因治疗。主要的治疗手段有电干燥法、刮除术、冷冻术、局部糖皮质激素注射和皮肤磨削术或联合治疗,治疗效果不一。CO2激光有报道取得良好效果[21]。手术切除治疗可能是一个很好的选择,尤其是Mohs显微外科手术,预后良好[5,18,22]。但均存在治疗效果维持时间短,皮损易复发的缺点,复发率约为9%[16]。近年来有研究表明,在药物诱发的小鼠皮肤淀粉样物质沉积区局部注射淀粉样蛋白低聚物抗体,真皮中淀粉样物质明显减少,由此为治疗淀粉样变病提供了新思路,而其可能存在的不良反应仍需进一步研究[13]。
5.2 系统治疗
系统使用免疫抑制药是否有效目前尚有争议。Tong等[23]使用环磷酰胺治疗并发CREST综合征的结节性淀粉样变患者,成功抑制新的淀粉样物质的产生。然而亦有长期服用免疫抑制剂的肾移植患者发生结节性淀粉样变的病例报道,提示系统免疫抑制剂可能不能影响局部浆细胞的分泌[24]。
5.3 预后
有报道认为结节性淀粉样变可转变为系统性淀粉样变,近期一项长达23年的临床随访研究发现,转变率较过去报道的50%明显降低,仅为7%左右[25]。系统性淀粉样变早期发现预后较好,因此对此类患者的长期随访仍是十分必要的。
综上所述,国内外对结节性皮肤淀粉样变病的研究较少,对其病因及发病机制尚不明确,且在治疗上缺乏新的、行之有效的方法,尚待更多的研究。
[1]Fernandez-FloresA. Cutaneous amyloidosis: a concept review [J]. Am J Dermatopathol, 2012,34(1):1-14; quiz 15-17.
[2]Grünewald K, Sepp N, Weyrer K, et al. Gene rearrangement studies in the diagnosis of primary systemic and nodular primary localized cutaneous amyloidosis [J]. J Invest Dermatol, 1991, 97(4):693-696.
[3]Cornejo KM, Lagana FJ, Deng A. Nodular amyloidosis derived from keratinocytes:an unus-ual type of primary localized cutaneous nodular amyloidosis [J]. Am J Dermatopathol, 2015, 37(11):129-133.
[4]Ritchie SA, Beachkofsky T, Schreml S, et al. Primary localized cutaneous nodular amyloidosis of the feet: a case report and review of theliterature [J]. Cutis, 2014, 93(2):89-94.
[5]Trignano E, Ciudad P, Fallico N, et al. Nodular cutaneous amyloidosis of the scalp reconstructed with a free anterolateral thigh flap: a case report [J]. J Oral Maxillofac Surg, 2012, 70(8):481-483.
[6]Lee DY, Kim YJ, Lee JY, et al. Primary localized cutaneous nodular amyloidosis following local trauma [J]. Ann Dermatol, 2011, 23(4):515-518.
[7]Ueno M, Yamamoto T, Yamanaka M, et al. Nodular amyloidosis in a patient with liver cirrhosis [J]. Dermatol Online J, 2011, 17(7):10.
[8]Mazori DR, Femia AN. Primary cutaneous nodular amyloidosis in association with Sjögren's syndrome [J]. Joint Bone Spine, 2016, 83(3):350.
[9]Tong PL, Walker WA, Glancy RJ, et al. Primary localized cutaneous nodular amyloidosis successfully treated with cyclophosphamide [J]. Australas J Dermatol, 2013, 54(1):12-15.
[10]Fujisawa T, Shu E, Ikeda T, et al. Primary localized cutaneous nodular amyloidosis that appeared in a patient with severe atopic dermatitis [J]. J Dermatol, 2012, 39(3):312-313.
[11]Ung CY, Carr NJ, Ardern-Jones MR. Primary cutaneous nodular amyloidosis associated with psoriasis [J].Clin Exp Dermatol, 2014, 39(5):608-611.
[12]Clos AL, Lasagna-Reeves CA, Castillo-Carranza DL, et al. Formation of immunoglobulin li-chain amyloid oligomers in primary cutaneous nodular amyloidosis [J]. Br J Dermatol, 2011, 165(6):1349-1354.
[13]Clos AL, Lasagna-Reeves CA, Wagner R, et al. Therapeutic removal of amyloid deposits in cutaneous amyloidosis by localised intralesional injections of anti-amyloid antibodies [J]. Exp Dermatol, 2010, 19(10):904-911.
[14]Arita K, South AP, Hans-Filho G, et al. Oncostatin M receptor-beta mutations underlie familial primary localized cutaneous amyloidosis [J]. Am J Hum Genet, 2008, 82(1):73-80.
[15]Lin MW, Lee DD, Liu TT, et al. Novel IL31RA gene mutation and ancestral OSMR mutant allele in familial primary cutaneous amyloidosis [J]. Eur J Hum Genet, 2010, 18(1):26-32.
[16]Kaltoft B, Schmidt G, Lauritzen AF, et al. Primary localised cutaneous amyloidosis-a systematic review [J]. Dan Med J, 2013, 60(11):4727.
[17]Stigall LE, Maroon M, Troutman DL. Nodular amyloidosis: clinicalrecognition of an unusual entity [J]. J Am Podiatr Med Assoc, 2014, 104(5):544-547.
[18]Sanusi T, Li Y, Qian Y, et al. Primary localized cutaneous nodular amyloidosis with bullous lesions [J]. Indian J Dermatol Venereol Leprol, 2015, 81(4):400-402.
[19]LaChance A, Phelps A, Finch J, et al. Nodular localized primary cutaneous amyloidosis: a bullous variant [J]. Clin Exp Dermatol, 2014, 39(3):344-347.
[20]Gan EY, Tey HL. Primary cutaneous nodular amyloidosis initially presenting with eczema [J]. Singapore Med J, 2010, 51(9):158-160.
[21]Lesiak A, Rakowski A, Brzezinska A, et al. Effective treatment of nodular amyloidosis with carbon dioxide laser [J]. J Cutan Med Surg, 2012, 16(5):372-374.
[22]Gérard E, Ly S, Cogrel O, et al. Primary localized cutaneous nodular amyloidosis: A diagnostic and therapeutic challenge [J]. Ann Dermatol Venereol, 2016, 143(2):134-138.
[23]Tong PL, Walker WA, Glancy RJ, et al. Primary localized cutaneous nodular amyloidosis successfully treated with cyclophosphamide [J]. Australas J Dermatol, 2013, 54(1):12-15.
[24]Yong AS, Murphy JG, Shah N. Nodular localized cutaneous amyloidosis in an immunosu-ppressed patient [J]. Int J Dermatol, 2015, 54(6):708-709.
[25]Woollons A, Black MM. Nodular localized primary cutaneous amyloidosis: a long-term follow-up study [J]. Br J Dermatol, 2001, 145(1):105-109.
Advances in primary nodular cutaneous amyloidosis
ZHENG Lei,LIU Qiao
Department of Dermatology, Hainan Province Hospital of Skin Disease, HaiKou 570206, China
Primary nodular cutaneous amyloidosis is a rare variant of primary cutaneous amyloidosis characterized by waxy yellowish-brown nodules or plaques. Histopathologic changes include diffuse deposits of amyloid in the dermis, subcutaneous tissue and blood vessel walls. It has been found that the nodular amyloidosis may be related with trauma, IL-6 family cytokine receptor gene mutations and immune dysfunction. Surgical excision, electrodesication, curettage, cryotherapy, intralesional steroid injection and dermabrasion are the main methods for the treatment of nodular myloidosis. Recently, immunotherapy which means subcutaneous injection of antibodies is expected to be a new effective therapy for the disease.
Nodular,cutaneous,amyloidosis;Pathogeny;Diagnosis;Therapy
R597.2
A
1674-1293(2016)06-0380-03
2016-06-17
2016-09-07)
(本文编辑 敖俊红)
10.11786/sypfbxzz.1674-1293.20160609
570206 海口,海南省皮肤病医院(郑蕾,刘巧);安徽医科大学(郑蕾)
郑蕾,硕士研究生在读,研究方向:中西医治疗皮肤病和损容性皮肤病,E-mail: 1297829514@qq.com
刘巧,E-mail: Drliuqiao@163.com

