离子液体在CO2电还原反应过程中的催化作用与机理研究
杨冬伟, 李 露, 王 琴, 王晓春, 李青远, 施 锦
(昆明理工大学省部共建复杂有色金属资源清洁利用国家重点实验室,
冶金与能源工程学院, 昆明 650093)
离子液体在CO2电还原反应过程中的催化作用与机理研究
杨冬伟, 李露, 王琴, 王晓春, 李青远, 施锦
(昆明理工大学省部共建复杂有色金属资源清洁利用国家重点实验室,
冶金与能源工程学院, 昆明 650093)
摘要在1-丁基3-甲基咪唑三氟甲基磺酸盐([Bmim][CF3SO3])/碳酸丙烯酯(PC)溶液中, 采用循环伏安曲线、交流阻抗谱及阻抗模拟方法, 研究了CO2在Au上发生电还原反应的速率控制步骤与离子液体的催化作用. 结果表明, 在CO2电还原反应过程中, 吸附态CO2经单电子还原生成自由基是速率控制步骤. 由于离子液体的催化作用, CO2在[Bmim][CF3SO3]/PC溶液中电还原的过电位比在四丁基三氟甲基磺酸铵([Bu4N][CF3SO3])/PC溶液中降低了239 mV. 交流阻抗测试结果表明, 离子液体中的阳离子[Bmim]+吸附在Au电极表面, 形成离子液体吸附层, 吸附态的CO2分子经单电子还原后生成自由基, 与周围离子液体发生相互作用, 形成中间体[Bmim-CO2]ad, 降低了的能量状态, 使得CO2电还原反应的过电位大幅度降低.
关键词二氧化碳; 电化学还原; 离子液体; 交流阻抗; 催化机理
CO2是造成温室效应的主要气体, 同时也是一种来源丰富、价格低廉的潜在碳资源[1,2]. 将CO2转化为有用化学品, 是能源和环境领域备受关注的重大科学问题[3~5]. 近年来, 一些研究者尝试将CO2转化为汽油替代燃料, 其研究思路如下[6~8]: 以可再生电能电解CO2制取CO, 电解H2O制取H2, 然后利用传统的Fischer-Tropsch合成法合成CH3OH. 利用上述方法, 可将可再生电能转化为化学能储存于液态燃料之中, 使之成为能够储存、便于运输的能源形式, 并实现碳资源的循环利用.
由于电解H2O制H2和CO氢化还原制甲醇技术是较成熟的工业技术[9], 因此, 要将CO2转化为甲醇需要解决的关键问题是将CO2连续、高效地电还原为CO. 为达到此目的, 电解液的选择至关重要. 传统KHCO3水溶液虽然价格低廉, 而且可提供CO2电还原反应所需的质子, 但却存在一些难以解决的问题[10~13]: (1) CO2溶解度小, 导致CO2电还原反应的电流密度过低; (2) 由于存在析氢反应, 导致CO2电还原反应的电流效率降低; (3) 在长周期电解过程中, 电极易中毒失活, 导致电极的长期稳定性变差. 为了解决上述问题, 一些研究者尝试在有机溶剂中电还原CO2. 碳酸丙烯酯(PC)是一种工业上常用的CO2吸收剂, 同时也是一种优良的电化学溶剂[14]. 离子液体是一种常温下呈液态的有机盐, 具有溶解CO2能力强、电化学窗口宽、稳定性好等优点, 在CO2电还原研究中展现出良好的应用前景[15,16].
本课题组采用1-丁基3-甲基咪唑三氟甲基磺酸盐([Bmim][CF3SO3])/PC为电解液, 研究了CO2的电还原反应, 相比于KHCO3水溶液, 该电解液生成CO的效率大幅度提高, 析氢反应的电流效率降低, 电极材料的长周期稳定性得到改善[17], 但离子液体[Bmim][CF3SO3]的催化机理尚不明确. 本文采用循环伏安曲线、电化学阻抗谱和交流阻抗模拟方法研究了CO2电化学还原过程中离子液体[Bmim][CF3SO3]的催化作用及作用机理.
1实验部分
1.1试剂与仪器
[Bmim][CF3SO3](纯度99.99%, 实验前在80 ℃真空干燥箱中干燥24 h)、四丁基三氟甲基磺酸铵([Bu4N][CF3SO3])(纯度99.99%)、碳酸丙烯酯(分析纯)和二茂铁(分析纯)购于国药集团化学试剂有限公司; 离子交换膜(Nafion 117)购于美国杜邦公司; CO2和Ar(纯度≥99.999%)购于昆明梅塞尔气体产品有限公司; 实验用水均为二次蒸馏水.
CHI 660E电化学工作站(上海辰华仪器有限公司). 在平衡电位下进行交流阻抗测试, 振幅为10 mV, 频率范围为1~105Hz, 阻抗结果用ZsimpWin 3.10软件进行拟合.
1.2实验方法

Fig.1 Schematic of the electrolysis cell for CO2 reduction


(1)

(2)
2结果与讨论
2.1非水体系参比电极


从图2(B)可以看出, 当阴极电解液为0.1 mol/L的[Bmim][CF3SO3]/PC溶液时, 在扫描范围内未出现氧化还原峰; 当向上述溶液中加入10 mmol/L二茂铁时, 测得一对可逆性较好的氧化峰和还原峰, 氧化峰和还原峰位置分别为0.4551和0.0541 V, 半波电位为0.2546 V. 以下电位数据均为采用二茂铁电对校正后的数据.

Fig.2 Cyclic voltammograms in [Bu4N][CF3SO3]/PC(A) and [Bmim][CF3SO3]/PC(B) Scan rate: 20 mV/s. a. Blank; b. 10 mmol/L ferrocene.
2.2循环伏安测试

Fig.3 Cyclic voltammograms of CO2 electrochemical reduction in [Bu4N][CF3SO3]/PC(a) and [Bmim][CF3SO3]/PC(b)Scan rate: 50 mV/s.
在饱和CO2的0.1 mol/L [Bu4N][CF3SO3]/PC溶液(CO2溶解度为0.127 mol/L)和0.1 mol/L [Bmim][CF3SO3]/PC溶液(CO2溶解度为0.134 mol/L)中, CO2发生电还原反应的循环伏安测试结果分别如图3曲线a和b所示. 从图3曲线a可以看出, 当支持电解质为[Bu4N][CF3SO3]时, 循环伏安曲线在-2.224 V(vs. Fc/Fc+)开始出现还原电流, 且还原电流逐渐增大, 说明在[Bu4N][CF3SO3]/PC溶液中, CO2在-2.224 V(vs. Fc/Fc+)开始发生电还原. 从图3曲线b可以看出, 当支持电解质为离子液体[Bmim][CF3SO3]时, 循环伏安曲线在-1.985 V(vs. Fc/Fc+)开始出现还原电流, 且还原电流逐渐增大, 说明在[Bmim]5[CF3SO3]/PC溶液中, CO2在-1.985 V(vs. Fc/Fc+)开始发生电还原. 二者比较可知, 当以离子液体[Bmim][CF3SO3]为支持电解质时, CO2电还原的起始还原电位比以[Bu4N][CF3SO3]为支持电解质时降低了239 mV, 且CO2电还原的电流密度明显增加, 说明离子液体[Bmim][CF3SO3]在CO2电还原反应过程中起到了催化作用.
2.3离子液体的吸附及阻抗特征
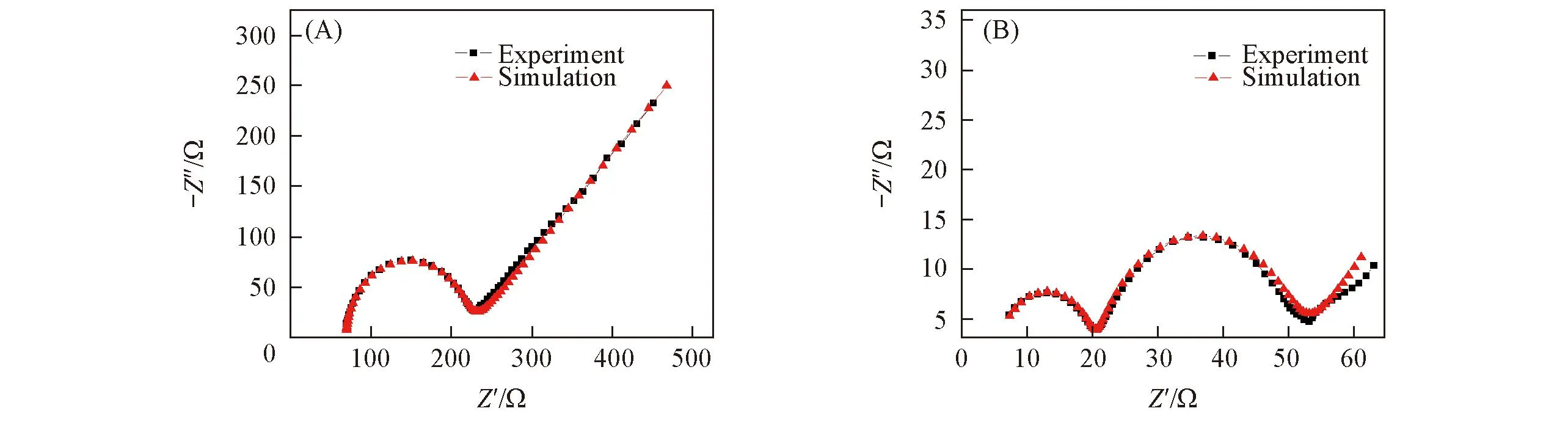
Fig.4 EIS of CO2 electrochemical reduction in [Bu4N][CF3SO3]/PC(A) and [Bmim][CF3SO3]/PC(B) catholytes
为了研究离子液体在CO2电还原反应过程中所起的催化作用及作用机理, 分别测定了CO2在[Bu4N][CF3SO3]/PC和[Bmim][CF3SO3]/PC溶液中发生电还原反应时的交流阻抗谱(图4), 并进行了等效电路模拟. 当CO2在[Bu4N][CF3SO3]/PC溶液中发生电化学反应时[图4(A)], Nyquist曲线在高频区出现一个半圆弧, 在低频区出现一条直线, 符合典型的Randles曲线特征[21]. 当CO2在[Bmim][CF3SO3]/PC溶液中发生电化学反应时[图4(B)], Nyquist曲线在高频区出现一个较小的容抗弧, 在中频区出现一个较大的容抗弧, 在低频区出现一段“扩散尾”. 图4(A)和(B)的Nyquist曲线有明显的差别, 主要原因在于: 当CO2在[Bmim][CF3SO3]/PC溶液中发生电化学反应时, 离子液体在Au电极表面发生了吸附, 形成了吸附层[22,23], 在CO2电化学反应过程中, 本体溶液中的CO2首先经外扩散迁移到阴极表面, 而后经离子液体吸附层中离子液体之间的空隙扩散到Au电极表面, 并吸附在Au电极表面, 经电还原后生成CO, 再经离子液体吸附层扩散到修饰电极表面, 最后溢出溶液.

Fig.5 Equivalent circuits for CO2 reduction in [Bu4N][CF3SO3]/PC(A) and [Bmim][CF3SO3]/PC catholyte(B)
根据上文的分析, 设计了CO2在[Bu4N][CF3SO3]/PC和[Bmim][CF3SO3]/PC溶液中发生电还原反应时的等效电路(图5). 当CO2在[Bu4N][CF3SO3]/PC溶液中发生电化学反应时, 其等效电路如图5(A)所示, 其中,Rs为溶液电阻,C为双电层电容,R1为电荷转移电阻,W为韦伯(Warburg)阻抗. 当CO2在[Bmim][CF3SO3]/PC溶液中发生电化学反应时, 考虑到电极表面存在离子液体吸附层, CO2须经吸附层中离子液体之间的空隙扩散到电极表面, 而后发生电还原反应, 因此, 设计等效电路时, 在图5(A)的基础上并联了一个RC电路, 得到如图5(B)所示等效电路. 其中,R2为离子液体吸附层内的离子迁移电阻,Q为离子液体吸附层的常相位元件. 由于离子液体在电极表面的吸附具有不均匀性, 故采用常相位元件代替其容抗行为[24]. 对于常相位元件, 其阻抗ZQ定义为
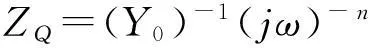
(3)
式中:Y0为常相位系数,j为虚部单位,ω为角频率,n为与频率无关的常数, 又称为弥散指数, 其数值范围为0≤n≤1, 当n=1时, 为理想电容器. 等效电路图5(A)和(B)所对应的总阻抗(Z)数学表达式分别为:
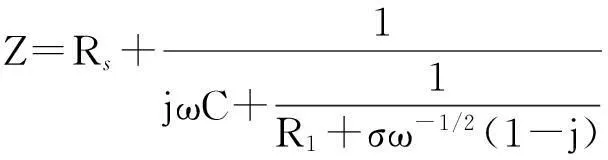
(4)
(5)
式中:σ为Warburg阻抗系数, 其余参数含义与图5及式(3)中相同.
根据图5设定的等效电路及相应的阻抗数学表达式, 利用ZsimpWin 3.10 软件对所测得的阻抗进行了拟合, 拟合结果误差均小于1×10-3, 结果列于表1中. 由表1可知, 在[Bu4N][CF3SO3]/PC溶液中,Rs为68.66 Ω·cm2,R1为148.6 Ω·cm2; 而在[Bmim][CF3SO3]/PC溶液中,Rs为5.175 Ω·cm2,R1为15.4 Ω·cm2. 说明CO2在[Bmim][CF3SO3]/PC溶液中发生电还原的阻力远比在[Bu4N]5[CF3SO3]/PC溶液中的小, 离子液体在CO2电还原过程中起了催化作用. 另外, 在[Bmim][CF3SO3]/PC溶液中, 常相位元件对应的弥散指数n为0.8, 偏离理想电容, 说明由于离子液体在Au电极表面吸附形成吸附层, 导致电极表面出现不均匀性, 由此引起了弥散效应[25].

Table 1 Parameter values of elements in the equivalent circuit model
2.4离子液体的催化作用机理分析

Fig.6 Mechanism of CO2 electrochemical reduction in [Bmim][CF3SO3]/PC catholyte
前、后2个电子转移过程分别为
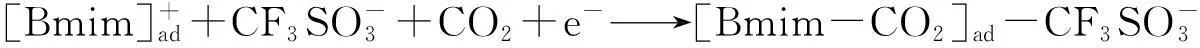
(6)
(7)
还原反应生成的CO经离子液体吸附层扩散到本体溶液中, 最后溢出阴极电解液.
参考文献
[1]Qiao J. L., Liu Y. Y., Hong F., Zhang J. J.,Chem.Soc.Rev., 2014, 43(2), 631—675
[2]Zhang L., Luo Y. W., Niu D. F., Xiao L. P., Lu J. X.,Chem.J.ChineseUniversities, 2007, 28(9), 1660—1662(张丽, 罗仪文, 钮东方, 肖丽平, 陆嘉星. 高等学校化学学报, 2007, 28(9), 1660—1662)
[3]Centi G., Perathoner S.,Catal.Today, 2009, 148(3), 191—205
[4]Hu B., Guild C., Suib S. L.,JournalofCO2Utilization, 2013, 1, 18—27
[5]Zhang K., Wu L. X., Hu L. L., Ding X. Y., Wang H., Lu J. X.,Chem.J.ChineseUniversities, 2010, 31(7), 1410—1415(张凯, 吴腊霞, 胡磊磊, 丁小燕, 王欢, 陆嘉星. 高等学校化学学报, 2010, 31(7), 1410—1415)
[6]Charles D., Paul L. R., John B. K., John N. J.,Electrochem.Soc., 2008, 155(1), B42—B49
[7]Smestad G. P., Steinfel A.,Ind.Eng.Chem.Res., 2012, 51(37), 11828—11840
[8]Olah G. A., Surya P. G. K., Goeppert A.,J.Am.Chem.Soc., 2011, 133(33), 12881—12898
[9]Devin T. W., Paul J. A. K.,J.Phys.Chem.Lett., 2010, 1(24), 3451—3458
[10]Yano H., Shirai F., Nakayama M., Ogura K.,J.Electroanal.Chem., 2002, 533(1), 113—118
[11]Hori Y., Konishi H., Futamura T., Murata A., Koga O., Sakurai H., Oguma K.,Electrochim.Acta, 2005, 50(27), 5354—5369
[12]Li H., Olomn C.,J.Appl.Electrochem., 2006, 36(10), 1105—1115
[13]Luo J., Lin Z. H., Tian Z. W.,Chem.J.ChineseUniversities, 1992, 13(5), 666—669(罗瑾, 林仲华, 田昭武. 高等学校化学学报, 1992, 13(5), 666—669)
[14]Jitaru M., Lowy D. A., Toma M., Toma B. C., Oniciu L.,J.Appl.Electrochem., 1997, 27(8), 875—889
[15]Laura E. B. A., Richard G. C.,Chem.Commun., 2009, (25), 3744—3746
[16]Neil V. R., Richard G. C.,EnergyEnviron.Sci., 2011, 4(2), 403—408
[17]Shi J., Shi F., Song N., Liu J. X., Yang X. K., Jia Y. J., Xiao Z. W., Du P.,J.PowerSources, 2014, 259, 50—53
[18]Izutsu K., Electrochemistry in Nonaqueous Solutions, Wiley-VCH, Weinheim, 2002, 167—168
[19]Gritzner G., Kuta J.,Pure&Appl.Chem., 1984, 56(4), 461—466
[20]Coetzee J. F., Gardner J. C. W.,Anal.Chem., 1982, 54(14), 2625—2626
[21]Lates V., Falch A., Jordaan A., Peach R., Kriek R. J.,Electrochim.Acta, 2014, 128, 75—84
[22]Rosen B. A., Haan J. L., Mukherjee P., Braunschweig B., Zhu W., Salehi-Khojin A., Dlott D. D., Masel R. I.,J.Phys.Chem.C, 2012, 116(29), 15307—15312
[23]Sun L. Y., Ramesha G. K., Kamat P. V., Brennecke J. F.,Langmuir, 2014, 30(21), 6302—6308
[24]Köleli F., Röpke T., Hamann C. H.,Electrochim.Acta, 2003, 48(11), 1595—1601
[25]Pajkossy T.,SolidStateIonics, 2005, 176(25), 1997—2003
[26]Savéant J. M.,Chem.Rev., 2008, 108(7), 2348—2378
[27]Gennaro A., Isse A. A., Severin M. G., Vianello E., Bhugun I., Savéant J. M.,J.Chem.Soc., 1996, 92(20), 3963—3968
[28]Amatore C., Savéant J. M.,J.Am.Chem.Soc., 1981, 103(17), 5021—5023
[29]Viva F. A.,Adv.Chem.Lett., 2013, 1(3), 225—236
[30]Benson E. E., Kubiak C. P., Sathrum A. J., Smieja J. M.,Chem.Soc.Rev., 2009, 38(1), 89—99
Catalytic Mechanism of Ionic Liquid for CO2Electrochemical Reduction†
YANG Dongwei, LI Lu, WANG Qin, WANG Xiaochun, LI Qingyuan, SHI Jin*
(StateKeyLaboratoryofComplexNonferrousMetalResourcesCleanUtilization,FacultyofMetallurgicaland
EnergyEngineering,KunmingUniversityofScienceandTechnology,Kunming650093,China)
KeywordsCarbon dioxide; Electrochemical reduction; Ionic liquid; Electrochemical impedance; Catalytic mechanism
(Ed.: S, Z, M)
† Supported by the National Natural Science Foundation of China(No.51164020) and the Scientific Research Foundation for the Returned Overseas Chinese Scholars.
doi:10.7503/cjcu20150472
基金项目:国家自然科学基金(批准号: 51164020)和教育部留学回国人员科研启动基金资助.
收稿日期:2015-07-02. 网络出版日期: 2015-12-20.
中图分类号O646
文献标志码A
联系人简介: 施锦, 男, 博士, 教授, 主要从事有机电化学研究. E-mail: shijin1118@163.com

