黄河口潮滩春季细菌群落的分布特征及其影响因素研究*
王 凯, 邹 立**, 高冬梅, 刘 陆
(1. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100; 2. 中国海洋大学环境科学与工程学院, 山东 青岛 266100)
黄河口潮滩春季细菌群落的分布特征及其影响因素研究*
王凯1,2, 邹立1,2**, 高冬梅1,2, 刘陆2
(1. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100; 2. 中国海洋大学环境科学与工程学院, 山东 青岛 266100)
摘要:为研究黄河口潮滩细菌群落结构特征及其影响因素,本文于2012年5月在黄河口口门的潮间带区域,以变性梯度凝胶电泳(DGGE)为主要手段,分析了沉积物的生物学信息和主要理化参数(颗粒中值粒径、总氮、总磷、有机碳和叶绿素a)。结果显示,研究区域大致呈现出低有机碳、高营养盐的环境特征;DGGE图谱分析共获得38个不同位置的条带;多样性指数在表层沉积物中变化范围为2.38~2.64,垂直方向上从表到底逐渐降低(2.45~2.78)。NMDS分析显示,环境特征相近的细菌群落,其组成相似性较高。CCA分析中总氮、总磷、有机碳和叶绿素a对细菌群落组成影响显著。测序结果表明,该区域优势菌群隶属变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria),以及一些未分类的生物类群。
关键词:黄河口;潮间带;细菌群落;细菌多样性
潮间带作为陆地和海洋的混合地区,其物质循环和能量流动迅速,是海洋生态系统中极具代表性的部分,也孕育着一群特殊的微生物群落[1-2]。潮间带微生物作为湿地生物地球化学循环的重要参与者,在碳、氮、磷和硫循环中发挥重要作用[2-5]。此外,潮间带微生物还能降解一些大分子污染物质,阻止其进入海洋环境[6]。作为潮间带生物,微生物响应于多种环境因子。通常,潮间带微生物群落与沉积物环境有机碳[7]和营养物质[7-8]的含量呈现显著正相关关系,与沉积环境盐度和沉积物颗粒粒径[9]呈负相关关系[10-12],也会受到潮间带植被分布[13]的影响。
黄河三角洲是中国暖温带保存最完整、最年轻的湿地生态系统,在世界范围河口湿地系统中发育速度最快[13-14,16-17]。黄河口潮滩沉积环境中细菌丰度相对较低[18],且受盐度梯度变化的影响[12,19-20]。微生物在黄河口湿地系统的作用已被关注,包括其在芦苇湿地中的消化作用[21],植被根际效应对微生物群落组成的影响[13,21]。而人类活动、石油污染以及土壤盐渍化,使得黄河三角洲湿地退化严重[19,22-24],并且威胁到微生物繁殖和动植物生长,乃至整个生态系统的结构和功能[23,25]。
黄河口潮滩的地理位置更接近于海洋,对潮滩环境微生物群落和功能的认识,是深入研究黄河口及其邻近海域陆海相互作用的重要内容。本文以聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)为主要手段,研究黄河口潮滩环境春季细菌群落的分布特征,探讨区域环境因子对细菌群落结构特征的影响。
1研究区域和实验方法
1.1 研究区域和样品采集
黄河三角洲位于山东省的东北部(36°55′N~38°12′N; 118°07′E~119°18′E),其形成主要受黄河的影响。该地区年平均气温在11.7~12.6℃,年降水量为530~630mm,大约70%的降雨发生在5-8月,同时年蒸发量却达到1962mm[13]。本研究区域春季初级生产力和营养盐水平都较高[14-15],因此采样进行于2012年5月大潮期,采样断面位于黄河潮间带最靠近黄河口的潮滩(见图1)。在该断面的高、中、低潮位处依次设置3个采样站位,记为H、M和L,并在高潮站位H处采集柱状样。以无菌方式采集表层沉积物(0~1cm)样品和柱状样(~50cm)。表层样品装入无菌袋;柱状样在充满氮气的试验箱中从表层到底层,依次以1、2和4cm间隔切割后,装入无菌袋。所有样品分成两份,一份冻存于-4℃用于分析理化参数(颗粒中值粒径、总氮、总磷、有机碳和叶绿素a),一份冻于-80℃用于分子生物学分析。采样同时监测沉积物上覆水盐度信息 (WTW, Multi 340i)。
1.2 分析方法
沉积物颗粒粒径采用激光粒度仪(Rise-2002)测定;有机碳(OC)和总氮(TN)含量使用PE2400 II型(PE2400 II, UK)元素分析仪测定,检出限为0.05%;总磷(TP)含量使用碱性过硫酸钾氧化法[26],利用QUAATRO型营养盐自动分析仪(德国BRAN+LUEBBE公司)测定,检出限为0.01μmol/L;叶绿素a(Chla)含量采用荧光光度法[27],使用Trilogy型荧光分析仪(Turner Designs, USA)测定,检出限为0.02μg/L。
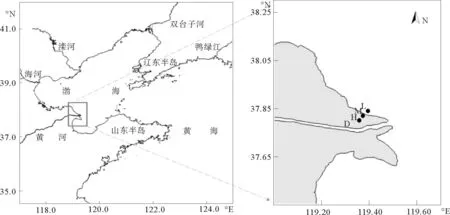
(H-高潮位;M-中潮位;L-低潮位。H-High tidal flat; M-Middle tidal flat; L-Low tidal flat.)
1.3 沉积物DNA的提取和PCR扩增
沉积物DNA提取(PowerSoil DNA Isolation Kit, MOBIO, USA)按照试剂盒手册操作,选用细菌16S rDNA V3区的通用引物GC-338F和518R,以提取的DNA为模板进行PCR扩增[28]。PCR扩增体系(50μL):1μLDNA模板,引物GC-338F/518R (20mM)各1μL,5μL10×PCR缓冲液,3.2μLdNTP(2.5mM),rTaq(5U/μL)聚合酶0.4μL,补灭菌水至50μL。PCR反应使用T-gradient (Biometra, Germany) PCR仪,反应条件为94℃预变性5 min,94℃预变性1 min,55℃复性45s,72℃延伸1min,30个循环,最终72℃延伸10min。
1.4 变性梯度凝胶电泳(DGGE)及优势条带测序
10μL PCR产物经纯化回收(DNA Gel Extraction Kit, OMEGA)后进行变性梯度凝胶电泳(DGGE)。PAGE(聚丙烯酰胺)胶浓度为8% (w/v),变性梯度为35%~55%。在1×TAE缓冲液中150V 60℃条件下电泳5 h(Bio-Rad Dcode System, USA),电泳终止后,采用银染法染色,Milli-Q水冲洗后,用Gel-Doc2000(Bio-Rad, USA)凝胶成像系统观察并拍照。
将DGGE凝胶在紫外分析仪的照射下切胶,回收纯化(Poly-Gel DNA Extraction Kit, OMEGA Bio-Tek Inc., GA),以2 μL回收产物为模板,以不带GC夹的引物进行PCR扩增。将重新扩增后的产物回收、纯化(Qiagen, Valencia, CA),连接pMD18-T载体,并转化大肠杆菌DH5α感受态细胞,摇菌培养,送至上海立菲生物技术有限公司进行测序。所得序列在NCBI中去除嵌合体,将目标序列在NCBI中以BLAST程序进行同源性比较,获得最相似典型菌株的16SrDNA序列。测序获得的序列上传至NCBI,获得序列号为:KP122987-KP122992。
1.5 统计学分析
采用Quantity One 4.6.2(Bio-Rad)软件对DGGE图谱进行识别。基于灰度值矩阵,借助R 3.1.2软件进行相似性聚类分析,对分析结果进行非度量多维度排序(Non-metric Multidimensional Scaling,NMDS)[29]。采用Shannon-Weaver指数进行多样性评价,计算公式如下:
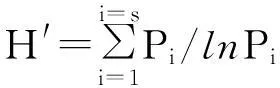
其中:在研究细菌群落多样性中,Pi是泳道条带的重要性,用Ni/N表示;Ni是条带的峰值;N是密度曲线中峰值的总和。
Pearson相关性分析用于探讨物理化学参数及其与H′指数的关系。典型对应分析(Canonical Correspondence Analysis, CCA)用来分析微生物群落结构与环境因子的关系。CCA分析以灰度值矩阵和环境因子为数据进行计算,并进行499次蒙特卡罗置换检验(Monte Carlo Permutation Test),以及判定显著环境因子(p<0.05),使用CANOCO 4.5 (Microcomputer Power, USA)软件,用包含环境因子和DGGE样品的双排序图来解释二者的关系。
2 结果与讨论
2.1 黄河口潮滩沉积物理化特性
研究断面表层沉积物的理化参数如表1所示。OC和TN含量从潮上带到潮下带逐渐降低,变化范围分别为0.19%~0.22%和0.33~0.41mg/g,TP和Chla含量最高值出现在潮中带,最高值分别为0.17mg/g和4.54μg/g,上覆水盐度和沉积物颗粒粒径在表层沉积物中无显著差异,平均值分别为29.3和38.6μm。垂直方向上(见图2),沉积物颗粒粒径波动较大(中值粒径范围为4.5~28.7μm),这可能与黄河每年携带大量泥沙(1.05×
107t)堆积于黄河三角洲河口处有关,其沉积速率快,沉积物混合作用强,使得沉积物颗粒垂直分布上不均匀[30]。TN含量高值区出现在13~25cm,其中在15和25cm附近出现2个高值,分别为0.46和0.48mg/g,0~15cm之间随深度增加缓慢减小,从25cm处到底层TN含量逐渐减小至0.20mg/g,总体呈现逐渐降低的趋势。黄河三角洲湿地TN的垂直变化规律与此相似[31],这可能与底栖生物的活动、微生物调节和氧含量有关[32],从Pearson相关性分析可知沉积物颗粒粒径也是影响TN剖面分布的重要因素(r=-0.508,p<0.05)。TP含量的剖面变化特征较为复杂,总体呈现随深度增加先降后升的趋势(个别层次异常),具体表现为在0~6cm之间随深度增加逐渐增大,在6cm出现最大值(0.36mg/g),迅速降低至0.13mg/g后又缓慢升高至0.22mg/g,同样在25cm出现一个高值(0.28mg/g),25cm至底层逐渐降低到0.13mg/g。OC的垂直分布特征与TP相似,在0~13cm呈S型波动,在13cm处出现一个小高值(0.32%),迅速下降之后开始缓慢上升,在25cm处达到最大值(0.35%),25cm之后逐渐降低至0.13%,在底层又有开始升高的趋势。叶绿素a含量表层最高(1.2μg/g),由表层至5cm迅速降低至0.05μg/g,在13cm出现一个小高值(0.23μg/g),直至深层都维持在0.01~0.03μg/g的较低水平。
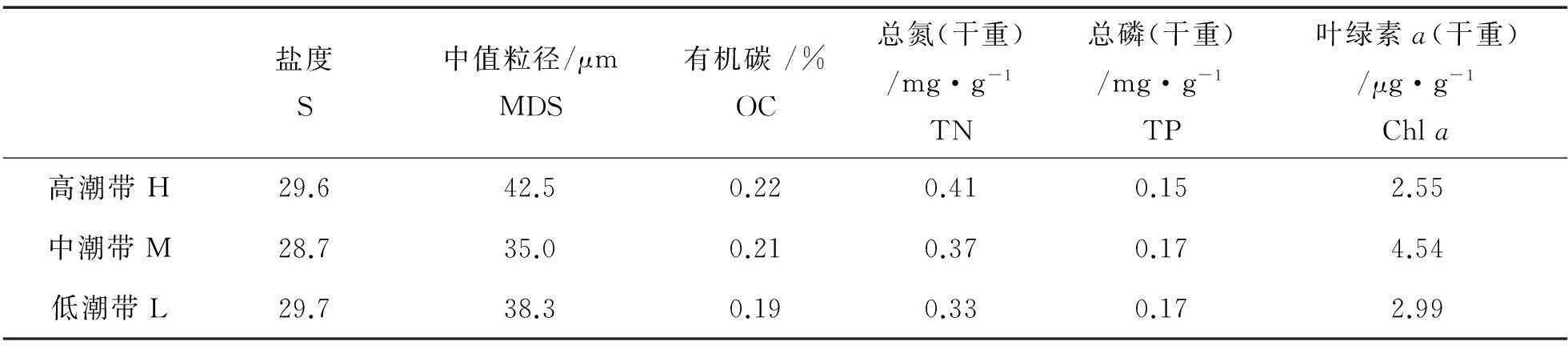
表1 黄河口潮间带表层沉积物理化参数状况
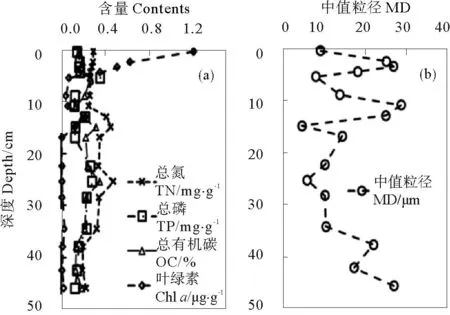
图2 黄河口潮滩沉积环境理化参数的垂直分布状况(干重)
如表2所示,Pearson相关性分析结果显示,颗粒粒径(MD)与H′指数呈极显著相关关系,总磷(TP)和有机碳(OC)与H′指数呈显著相关关系,总氮(TN)、总磷(TP)和有机碳(OC)的空间分布都与调查区域颗粒粒径(MD)呈现较好相关关系,有机碳(OC)与总氮(TN)极显著相关,与总磷(TP)显著相关。
2.2 微生物DNA的PCR-DGGE图谱
20个样品共计获得38个条带(见图3)。其中表层沉积物共获得24个不同位置的条带,条带数范围为18~21,条带数最多出现在潮中带(M),最低出现在潮下带(L)。垂直方向上,条带数随深度增加而逐渐减少,说明微生物多样性由表层向深层逐渐降低。出现次数超过10次的条带一共有9条,其中条带13、22和34出现16次,条带11出现14次;条带30主要出现在0~27cm层,条带20主要出现在27~48cm层,说明微生物群落组成在垂直方向上发生较明显的改变。
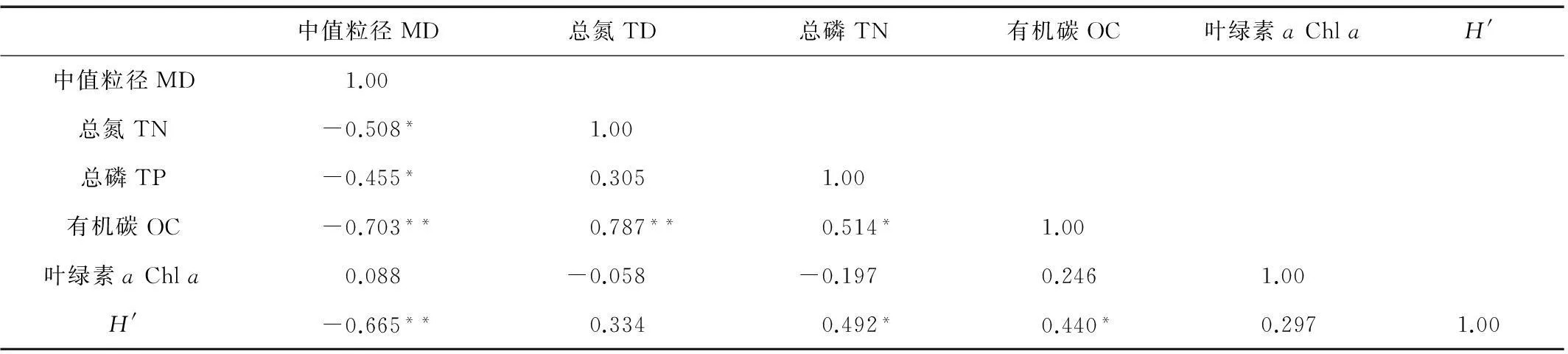
表2 沉积物理化特性与多样性指数的Pearson相关性分析(n=20)
注:*:表示在0.05水平上显著相关,**:表示在0.01水平上显著相关。Significant values reported as:*:P<0.05; **:P<0.01.
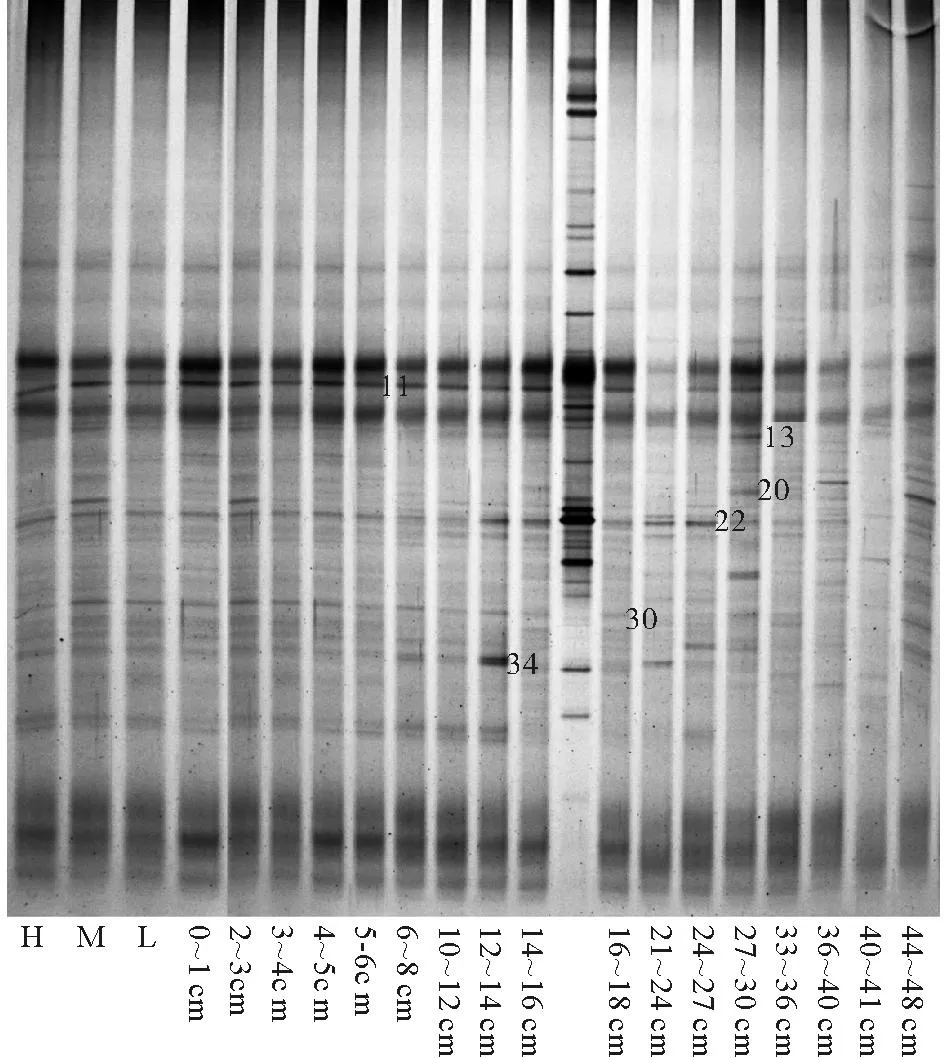
(H-高潮位,M-中潮位,L-低潮位。H-High tidal flat; M-Middle tidal flat; L-Low tidal flat.)
图316S rRNA PCR产物的DGGE分析谱图
Fig.3DGGE of 16S rRNA amplification fragments
and bands isolated for sequencing
2.3 细菌群落的优势门类
测序结果显示,黄河口潮滩春季的优势细菌为Proteobacteria(条带11和20),Acidobacteria(条带13)以及一些未分类的微生物类群(条带22、30和34)。Proteobacteria中,Gammaproteobacteria(条带20)和Deltaproteobacteria(条带11)广泛分布于海洋和潮间带环境[2,33-35]。其中,Gammaproteobacteria作为初级生产者参与潮间带环境的氮循环[36]和CO2的固定[37]。Deltaproteobacteria则与潮间带硫还原作用相关[2]。测序结果中还发现Acidobacteria为优势类群之一,报道称Acidobacteria多见于淡水环境[2,38],但并不是其所有亚门都表现出一样的分布特征,部分亚门在海洋和潮间带沉积环境中广泛存在,如Gp10、Gp21、Gp22和Gp26[36]。有研究认为,Acidobacteria的存在可能与pH有关,当pH<5.5时Acidobacteria的丰度较高[38],但是也有非酸性环境沉积物中发现较多Acidobacteria的现象[1,39]。本文研究区域沉积环境属于盐碱土,为非酸性环境,亦发现Acidobacteria存在。
2.4 潮滩细菌群落结构特征
黄河口潮间带表层沉积物H′范围为1.38~2.60(均值2.57),由潮下带、潮中带至潮上带逐渐降低。H′由表层到深层呈逐渐降低的趋势(见图4);表层最高为2.88,次表层迅速降低至几乎最低值,之后至20cm附近一直维持较低水平,25cm附近H′再次升高至2.80,之后逐渐降低至较低的2.45。细菌群落的NMDS分析结果显示(见图5),样品的空间差异明显。样品主要分为3个组,样品H、M和L表现出较高的相似性,聚类位置较为接近。柱状样中,2~16cm主要分布在第四象限,聚类位置较为接近;16~48cm作为第3组,主要分布在第1和第2象限。
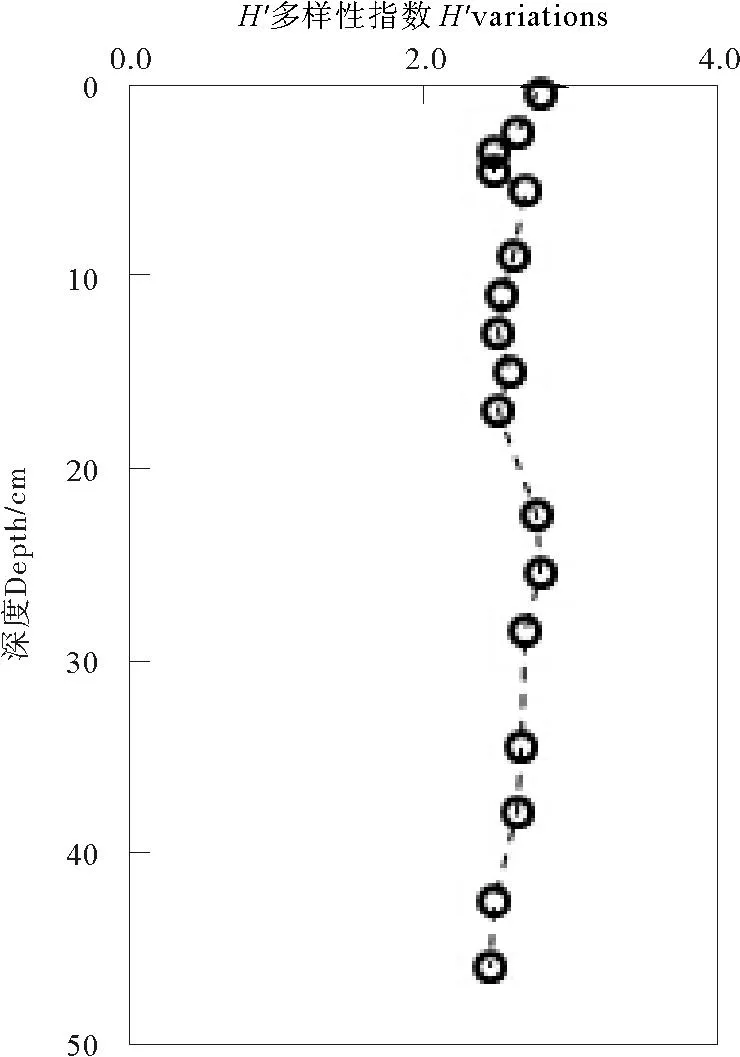
图4 黄河口潮间带沉积物细菌群落多样性指数

图5 黄河三角洲细菌群落的NMDS分析
2.5 沉积物理化性质对细菌群落结构的影响
采用CCA分析沉积物理化特征与细菌群落结构的关系,结果如图6所示。前两个排序轴一共解释了21.8%的物种信息。其中TN、TP和OC与第一排序轴呈现较好相关关系,相关系数分别为0.708,0.619,0.581,Chla与第二排序轴呈较好相关关系,相关系数为0.797。氮元素对细菌群落特征有重要指示作用,并作为主要成分影响着黄河口潮滩微生物群落的组成和分布[7,40]。本研究中沉积物TN含量较高,均值为0.37mg/kg;其从表到底逐渐降低,与细菌群落多样性的变化趋势相似。
TP亦是影响细菌群落组成和分布的主要因素,与细菌群落的组成差异之间关系密切[8]。研究区域沉积物TP含量变化范围为0.12~0.36mg/kg(均值为0.19mg/kg),从前人研究可知,该区域中可生物可利用性磷占总磷的比例为6%~24%[41],它们对维持该区域底栖藻类和微生物的生长和繁殖有重要作用。Pearson相关性分析也表明,本研究区域TP与H′之间存在较好相关关系(r=0.492,p<0.05),表明TP与TN一样,是影响该区域细菌结构和多样性的主要因素。
OC作为微生物生长的物质和能量基础,是影响和控制沉积物细菌群落组成的基本要素[7,42-44]。研究区域的OC含量较低,表层含量约为0.3%~0.7%,次表层以下含量小于0.4%。其与第一排序轴表现出较好的相关性(r=0.581,p<0.05),表明,随着沉积物深度增加OC含量逐渐降低,其对细菌群落的影响越来越显著。湿地环境OC与细菌群落的关系大多如此[7]。
Chla通常用来表征区域生物现存量和现场初级生产力状况,研究区域叶绿素a的分布特征与OC大体一致。CCA分析结果显示,Chla与第二排序轴相关性较好(r=0.797,p<0.05),尤其是对H、M、L、和Z1 4个表层样品的影响最为显著,表明黄河口潮滩的现场生产碳源可能是细菌再生产的主要碳源,进而影响该区域细菌生长和群落结构,这一现象和结果在海洋环境中也有报道[45]。
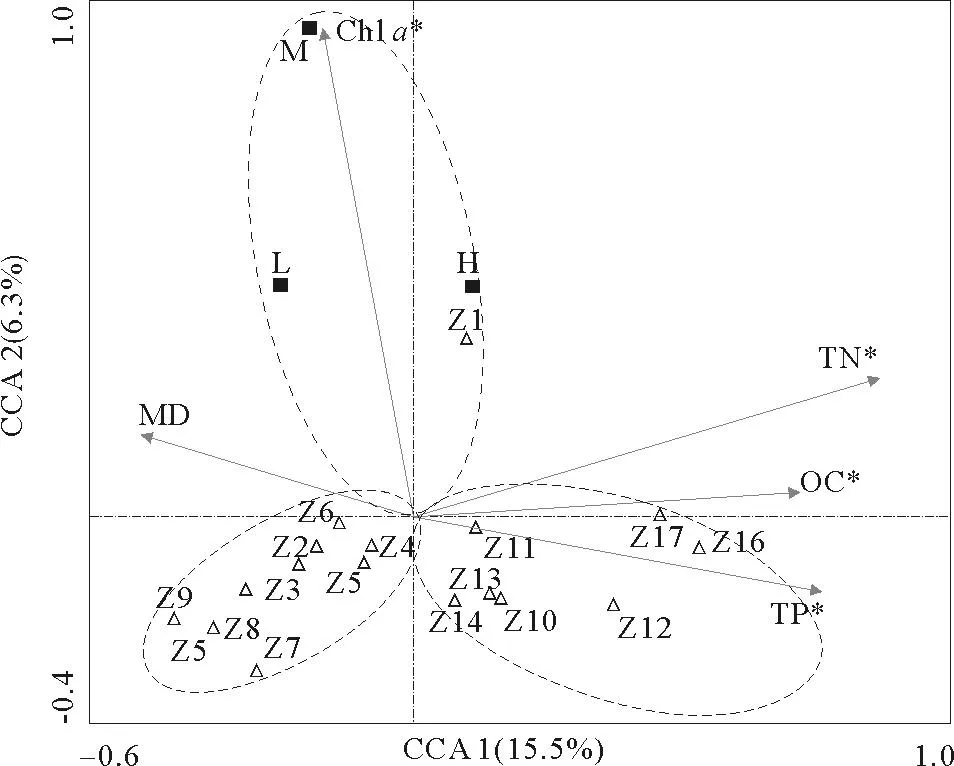
(MD-颗粒中值粒径,TN-总氮,TP-总磷,OC-有机碳,Chla-叶绿素a,*表示该因素显著性小于0.05。MD-sediment grain size; TN-total nitrogen; TP-total phosphorous; OC-organic carbon; Chla-chlorophylla. * means significant variables (p<0.05.)
图6DGGE图谱的典型对应分析
Fig.6Canonical correspondence analysis
biplot of DGGE fingerprints
3结论
黄河口潮滩是黄河和渤海相互作用的最前沿,本文于2012年5月,通过PCR-DGGE,研究黄河口潮间带泥滩环境细菌群落的分布特征,以及环境因子对其影响。主要结论如下:
(1) 黄河口潮滩春季细菌群落组成相对复杂,潮滩表层细菌群落多样性从潮上带到潮下带逐渐增大,随深度的增加多样性指数逐渐降低;
(2) 细菌群落的优势门类为变形菌门、酸杆菌门以及一些未确定分类地位的微生物类群,主要为海洋环境的常见门类;
(3) TN、TP、OC和Chla是影响细菌群落结构的主要因素,而细菌群落多样性与MD、TP和OC表现出较好相关性;其中OC在细菌群落结构的垂直分布上影响更为显著,现场生产的有机碳可能是细菌活动的主要碳源和影响因素。
参考文献:
[1]Röske K, Sachse R, Scheerer C, et al. Microbial diversity and composition of the sediment in the drinking water reservoir Saidenbach (Saxonia, Germany) [J]. Systematic and Applied Microbiology, 2012, 35(1): 35-44.
[2]Wang Y, Sheng H F, He Y, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags [J]. Applied and Environmental Microbiology, 2012, 78(23): 8264-8271.
[3]Vazquez P, Holguin G, Puente M E, et al. Phosphate-solubilizing microorganisms associated with the rhizosphere of mangroves in a semiarid coastal lagoon [J]. Biology and Fertility of Soils, 2000, 30(5-6): 460-468.
[4]Rojas A, Holguin G, Glick B R, et al. Synergism between Phyllobacterium sp.(N2-fixer) and Bacillus licheniformis (P-solubilizer), both from a semiarid mangrove rhizosphere [J]. FEMS Microbiology Ecology, 2001, 35(2): 181-187.
[5]Ortega-Morales B O, Chan-Bacab M J, De la Rasa-Garcia Sdel C, et al. Valuable processes and products from marine intertidal microbial communities [J]. Current Opinion in Biotechnology, 2010, 21(3): 346-352.
[6]刘芳, 叶思源, 汤岳琴, 等. 黄河三角洲湿地土壤微生物群落结构分析[J]. 应用与环境生物学报, 2007, 13(5): 691-696.
Liu F, Ye S Y, Tang Y Q, et al. Analysis of Microbial Community Structure in Costal Wetland Soil of the Yellow River Delta[J].Chinese Journal of Applied and Environmental Biology, 2007,13(5): 691-696.
[7]Peralta R M, Ahn C, Gillevet P M. Characterization of soil bacterial community structure and physicochemical properties in created and natural wetlands [J]. Science of the Total Environment, 2013, 443: 725-732.
[8]Lindström E S, Bergström A K. Community composition of bacterioplankton and cell transport in lakes in two different drainage areas [J]. Aquatic Sciences, 2005, 67(2): 210-219.
[9]Sessitsch A, Weilharter A, Gerzabek M H, et al. Microbial population structures in soil particle size fractions of a long-term fertilizer field experiment [J]. Applied and Environmental Microbiology, 2001, 67(9): 4215-4224.
[10]Yuan B C, Li Z Z, Liu H, et al. Microbial biomass and activity in salt affected soils under arid conditions [J]. Applied Soil Ecology, 2007, 35(2): 319-328.
[11]Yu Y, Wang H, Liu J, et al. Shifts in microbial community function and structure along the successional gradient of coastal wetlands in Yellow River Estuary [J]. European Journal of Soil Biology, 2012, 49: 12-21.
[12]Gao Y C, Wang J N, Guo S H, et al. Effects of salinization and crude oil contamination on soil bacterial community structure in the Yellow River Delta region, China [J]. Applied Soil Ecology, 2015, 86: 165-173.
[13]Nie M, Zhang X, Wang J, et al. Rhizosphere effects on soil bacterial abundance and diversity in the Yellow River Deltaic ecosystem as influenced by petroleum contamination and soil salinization [J]. Soil Biology and Biochemistry, 2009, 41(12): 2535-2542.
[14]张鹏, 邹立, 姚晓, 等. 黄河三角洲潮间带营养盐的输送通量研究[J]. 海洋环境科学, 2011, 30(1): 76-80.
Zhang P, Zou L, Yao X, et al.Transportation fluxes of nutrients in intertidal area of Yellow River Delta[J]. Marine Environmental Science, 2011, 30(1): 76-80.
[15]姚晓, 邹立, 高会旺, 等. 黄河三角洲南部潮间带沉积环境对底栖叶绿素a分布特征的影响[J]. 生态学杂志, 2010(9): 1762-1769.
Yoa X, Zou L, Gao H W, et al. Effects of sediment environment on distribution pattern of benthic Chlorophyll-ain southern intertidal area of Yellow River Delta[J].Chinese Journal of Ecology, 2010(9): 1762-1769.
[16]陈建, 王世岩, 毛战坡. 1976-2008年黄河三角洲湿地变化的遥感监测[J]. 地理科学进展, 2011, 30(5): 585-592.
Chen J, Wang S Y, Mao Z P. Monitoring Wetland Changes in Yellow River Delta byRemote Sensing during 1976-2008[J].Progress in Geography, 2011, 30(5): 585-592.
[17]Sun Z, Jiang H, Wang L, et al. Seasonal and spatial variations of methane emissions from coastal marshes in the northern Yellow River estuary, China [J]. Plant and Soil, 2013, 369(1-2): 317-333.
[18]张鹏, 邹立, 姚晓, 等. 黄河三角洲南部潮间带底栖异样细菌的分布特征研究[J]. 海洋湖沼通报, 2011(1): 101-108.
Zhang P, Zou L, Yao X, et al. Distribution of heterotrophic bacteria insediments in the southern intertidal area of yellow river delta[J]. Transactions of Oceanology and Limnology, 2011(1): 101-108.
[19]Wang Z Y, Gao D M, Zhao J, et al. Petroleum hydrocarbon degradation potential of soil bacteria native to the Yellow River Delta [J].Pedosphere, 2008, 18(6): 707-716.
[20]Wang Z Y, Xin Y Z, Gao D M, et al. Microbial community characteristics in a degraded wetland of the Yellow River Delta [J]. Pedosphere, 2010, 20(4): 466-478.
[21]Xia X H, Yang Z F, Huang G H, et al. Nitrification in natural waters with high suspended-solid content-A study for the Yellow River [J]. Chemosphere, 2004, 57(8): 1017-1029.
[22]Shi J Y, Yuan X F, Lin H R, et al. Differences in soil properties and bacterial communities between the rhizosphere and bulk soil and among different production areas of the medicinal plant Fritillariathunbergii [J]. International Journal of Molecular Sciences, 2011, 12(6): 3770-3785.
[23]陈为峰, 周维芝, 史衍玺. 黄河三角洲湿地面临的问题及其保护[J]. 农业环境科学学报, 2003, 22(4): 499-502.
Chen W F, Zhou W Z, Shi Y Y. Crisis of wetlands in the Yellow River Delta and its protection[J].Journal of Agro-Environmental Science, 2003, 22(4): 499-502.
[24]彭少麟, 任海, 张倩媚. 退化湿地生态系统恢复的一些理论问题[J]. 应用生态学报, 2003, 14(11): 2026-2030.
Peng S L, Ren H, Zhang Q M. Theories and techniques of degraded wetland ecosystem restoration[J].Chinese Journal of Applied Ecology, 2003, 14(11): 2026-2030.
[25]Xu X, Lin H, Fu Z. Probe into the method of regional ecological risk assessment—a case study of wetland in the Yellow River Delta in China [J]. Journal of Environmental Management, 2004, 70(3): 253-262.
[26]Grasshoff K, Kremling K, Ehrhardt M, et al. Methods of seawater analysis [M]. New York: John Wiley & Sons, 2009.
[27]Jeffery S W, Humphrey G F. New spectrophotometric equations for determining chlorophyllsa,b,c1 andc2 in higher plant, algae and natural phytoplankton [J]. Biochem Physio Pflanz BPP, 1975, 167: 191-194.
[28]Muyzer G, De Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA [J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700.
[29]Valentín-Vargas A, Toro-Labrador G, Massol-DeyáAA. Bacterial community dynamics infull-scale activated sludge bioreactors: operational and ecological factors drivingcommunity assembly and performance[J]. PLoS One, 2012, 7(8):e42524.
[30]Cui B S, Yang Q C, Yang Z F, et al. Evaluating the ecological performance of wetland restoration in the Yellow River Delta, China [J]. Ecological Engineering, 2009, 35(7): 1090-1103.
[31]王玲玲, 孙志高, 牟晓杰, 等. 黄河口滨岸潮滩不同类型湿地土壤氮素分布特征[J]. 土壤通报, 2011, 42(6): 1439-1445.
Wang L L, Sun Z G, Mou X J, et al. Spatial Distribution of Nitrogen in Different Wetlands’Soil in Intertidal Flat of Yellow River Estuary[J]. Chinese Journal of Soil Science, 2011, 42(6): 1439-1445.
[32]潘建明, 周怀阳, 扈传昱, 等. 夏季珠江口沉积物中营养盐剖面分布和界面交换通量[J]. 海洋学报, 2002, 24(3): 52-59.
Pan J M, Zhou H Y, Hu C Y, et al. Nutrient profiles in interstitial water and flux in water-sedimentin terface of Zhujiang Estuary of China in summer[J]. Acta Oceanologica Sinica, 2002, 24(3): 52-59.
[33]Bowman J P, McCuaig R D. Biodiversity, community structural shifts, and biogeography of prokaryotes within Antarctic continental shelf sediment [J]. Applied and Environmental Microbiology, 2003, 69(5): 2463-2483.
[34]Newton R J, Jones S E, Eiler A, et al. A guide to the natural history of freshwater lake bacteria [J]. Microbiology and Molecular Biology Reviews, 2011, 75(1): 14-49.
[35]Liu X, Xiao T, Luan Q S, et al. Bacterial diversity, composition and temporal-spatial variation in the sediment of Jiaozhou Bay, China[J]. Chinese Journal of Oceanology and Limnology, 2011, 29(3): 576-590.
[36]Orcutt B N, Sylvan J B, Knab N J, et al. Microbial ecology of the dark ocean above, at, and below the seafloor [J]. Microbiology and Molecular Biology Reviews, 2011, 75(2): 361-422.
[37]Lenk S, Arnds J, Zerjatke K, et al. Novel groups of gammaproteobacteriacatalyse sulfur oxidation and carbon fixation in a coastal, intertidal sediment [J]. Environmental Microbiology, 2011, 13(3): 758-774.
[38]Jones R T, Robeson M S, Lauber C L, et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses [J]. The ISME Journal, 2009, 3(4): 442-453.
[39]Zimmermann J, Portillo M C, Serrano L, et al. Acidobacteria in Freshwater Ponds at Doana National Park, Spain [J]. Microbial Ecology, 2012, 63(4): 844-855.
[40]Ahn C, Peralta R M. Soil bacterial community structure and physicochemical properties in mitigation wetlands created in the Piedmont region of Virginia (USA) [J]. Ecological Engineering, 2009, 35(7): 1036-1042.
[41]马钦, 李北罡, 焦小宝. 黄河表层沉积物中磷的分布特征及磷的生物可利用性[J]. 农业环境科学学报, 2009, 28(11): 2379-2384.
Ma Q, Li B G, Jiao X B. Distribution Characteristics andBioavailabilityof Phosphorus in Surface Sedimentsfrom theYellow River[J]. Journal of Agro-Environmental Science, 2009, 28(11): 2379-2384.
[42]Rysgaard S, Thamdrup B, Risgaard-Petersen N, et al. Seasonal carbon and nutrient mineralization in a high-Arctic coastal marine sediment, Young Sound, Northeast Greenland [J]. Marine Ecology Progress Series, 1998, 175: 261-276.
[43]Macalady J L, Mack E E, Nelson D C, et al. Sediment microbial community structure and mercury methylation in mercury-polluted Clear Lake, California [J]. Applied and Environmental Microbiology, 2000, 66(4): 1479-1488.
[44]Zeng J, Yang L Y, Li J Y, et al. Vertical distribution of bacterial community structure in the sediments of two eutrophic lakes revealed by denaturing gradient gel electrophoresis (DGGE) and multivariate analysis techniques [J]. World Journal of Microbiology and Biotechnology, 2009, 25(2): 225-233.
[45]Papaspyrou S, Gregersen T, Cox R P, et al. Sediment properties and bacterial community in burrows of the ghost shrimp Pestarellatyrrhena(Decapoda: Thalassinidea)[J]. Aquatic Microbial Ecology, 2005, 38(2): 181-190.
责任编辑庞旻
Characteristics of Bacterial Community and Associated Environmental Impacts in Intertidal Mudflat of Yellow River Estuary, China
WANG Kai1,2, ZOU Li1,2, GAO Dong-Mei1,2, LIU Lu2
(1. The Key Lab of Marine Environmental Science and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China; 2. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China)
Abstract:In order to study the bacterial community composition and distribution in the intertidal mudflat of the Yellow River Estuary (YRE), and issue the associated environmental factors, samples were collected in the high (H), middle (M) and low (L) tide lines in May, 2012, where was close to the mouth of Yellow River. Denaturing gradient gel electrophoresis(DGGE) was applied to obtain the bacterialinformation, sediments were also evaluated physical and chemical properties [i.e., sediment median grain size (MD), total nitrogen (TN), total phosphorus (TP), organic carbon (OC) and chlorophyll a (Chl a)]. Results showed that, the investigated section presented a pattern of high nutrients and low organic carbon. A total of 38 bands were indentifiedfrom DGGE gel, the diversity index ranged at 2.38~2.64 in surface sediment, and decreased from surface to deep layers (2.45~2.78). NMDSresults revealed thathigher similarity on bacterial community composition existed in more comparable environments, indicated by the closer position in clustering analysis.The first two CCA ordination axes suggested that bacterial community structure was strongly correlated with environmental variables [i.e., TN, TP, OC and Chla](F=1.38, p<0.05). The dominated phylogenic groups in intertidal mudflat of YRE includedProteobacteria, Acidobacteria and some unidentified bacteria.
Key words:Yellow River Estuary; intertidal mudflat; bacterial community; bacterial diversity
中图法分类号:X172
文献标志码:A
文章编号:1672-5174(2016)01-108-08
作者简介:王凯(1989-),男,硕士。E-mail:wangkai@ouc.edu.cn
收稿日期:2015-03-10;
修订日期:2015-04-18
*基金项目:国家自然科学基金项目(41176064) 资助
DOI:10.16441/j.cnki.hdxb.20150076
引用格式:王凯, 邹立, 高冬梅, 等. 黄河口潮滩春季细菌群落的分布特征及其影响因素研究[J]. 中国海洋大学(自然科学版), 2016, 46(1): 108-115.
WANG Kai , ZOU Li, GAO Dong-Mei, et al. Characteristics of bacterial community and associated environmental impacts in intertidal mudflat of Yellow River Estuary, China[J]. Periodical of Ocean University of China, 2016, 46(1): 108-115.
Supported by the National NaturalScience Foundation of China(41176064)
**通讯作者: E-mail:zouli@ouc.edu.cn

