ET-1在增生性糖尿病性视网膜病变患者血和玻璃体中的表达研究
陈 娟,吕红彬,周 琦,何 跃,欧阳科,石彦婷,曹小兰
(1西南医科大学附属医院眼科,四川泸州 646000;2成都市第五人民医院眼科)
ET-1在增生性糖尿病性视网膜病变患者血和玻璃体中的表达研究
陈 娟1,2,吕红彬1,周 琦1,何 跃1,欧阳科1,石彦婷1,曹小兰1
(1西南医科大学附属医院眼科,四川泸州 646000;2成都市第五人民医院眼科)
目的:通过定量检测内皮素1(endothelin-1,ET-1)在增生性糖尿病性视网膜病变(proliferative diabetic retinopathy, PDR)患者血和玻璃体中的表达及其相关性,探索ET-1在PDR的发病机制中的作用。方法:本研究共纳入需行玻璃体切除术的患者65例71眼,分为PDR组及对照组,记录所有患者年龄、性别、身高、体重、病史、空腹血糖、高密度脂蛋白、低密度脂蛋白、甘油三脂、总胆固醇及糖尿病患者糖尿病病程和糖化血红蛋白等情况。收集所有患者血清和玻璃体,离心后-80℃冰箱冻存,使用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测血清和玻璃体中ET-1的含量。结果:PDR组和对照组年龄、性别比较均无统计学意义(P>0.05)。PDR组血清ET-1浓度1.82(1.16,2.50)pg/ml高于对照组1.21(0.66,1.79)pg/ml(P= 0.007);PDR组玻璃体中ET-1浓度5.27(4.03,6.95)pg/ml高于对照组4.19(1.77,5.81)pg/ml(P=0.013)。两组玻璃体中ET-1浓度均高于血中ET-1浓度,两组玻璃体和血中ET-1浓度之间无明显相关性 (rPDR组=0.423,PPDR组=0.07;r对照组=-0.19,P对照组=0.601)。 PDR组空腹血糖、BMI均较对照组高 (P<0.05);PDR组患者糖化血红蛋白明显升高 (P=0.000)。结论:PDR患者血和玻璃体中ET-1水平较正常人群升高。PDR可能发生于血脂及BMI正常的糖尿病患者。
增生性糖尿病性视网膜病变;内皮素1;血清;玻璃体;血糖
糖尿病性视网膜病变(diabetic retinopathy,DR)已成为大多数发达国家工作人群(20~74岁)的首要致盲眼病[1]。2012年对我国大陆DR流行病学进行的第一份Meta分析表明,我国约有1.3%的人群患有DR,其中NPDR约1.1%,PDR约0.1%;而在糖尿病人群中,DR占23%,其中NPDR占19.1%,PDR占2.8%[2]。
目前对于DR的发病机制尚有争议,研究表明糖尿病患者的视网膜毛细血管内皮细胞发生功能障碍[3]。内皮细胞功能障碍主要表现为内皮起源的舒血管因子与缩血管因子间的不平衡。内皮素1(Endothelin,ET-1)主要是由内皮细胞合成分泌的,具有强大、有效、持久收缩血管功能,ET-1增加是内皮细胞功能障碍的一个重要特点。本研究旨在通过定量测定PDR患者血和玻璃体中ET-1浓度,探讨ET-1在PDR发病机制中可能的作用及PDR患者血和玻璃体中ET-1的相关关系,期望为预防及治疗PDR提供一种新的思路。
1 对象与方法
1.1 研究对象
1.1.1 一般情况
本实验选取在西南医科大学附属医院眼科就诊,需行睫状体平坦部20G标准三通道玻璃体切除术的患者65例71眼。
1.1.2 入选标准
实验组:均确诊为视网膜脱离、长时间未吸收的玻璃体积血或玻璃体积血合并视网膜脱离,经保守治疗无效的PDR患者。实验组患者46例51眼,男性17例19眼,女性29例32眼;年龄28~75岁,平均年龄55.82岁;玻璃体积血不伴视网膜脱离20眼,玻璃体积血伴视网膜脱离21眼,不伴玻璃体积血的视网膜脱离10眼;右眼24眼,左眼27眼;其中高血压患者21例24眼。
对照组:选择健康状况良好,无糖尿病及糖尿病家族史、高血压、高血脂,且年龄性别与实验组匹配的孔源性视网膜脱离或全层黄斑裂孔(full thickness macular hole,FTMH)的患者19例20眼,男性6例6眼,女性13例14眼;年龄29~71岁,平均年龄52.70岁;视网膜脱离12眼、FTMH 8眼;右眼11眼,左眼9眼。
1.1.3 排除标准
全身或患眼急性炎症反应期、患眼内眼手术史、合并其他视网膜血管性病变 (如视网膜中央静脉阻塞、视网膜静脉周围炎等)、本次行玻璃体切除手术前先行白内障手术且手术过程中晶状体后囊破损、术中眼压过低不宜在无灌注情况下行玻璃体切除术、肝肾功能不全、肺部疾病、妊娠期或哺乳期、精神疾病、自身免疫性疾病及恶性肿瘤等患者。
整个实验中所取得的血标本及玻璃体标本均已经过西南医科大学附属医院伦理审查委员会审查通过并取得患者及家属同意。
1.2 方法
记录所有患者年龄、性别、血压、身高、体重、眼部诊断、手术眼别等基本情况,测量随机血糖、空腹血糖(fasting blood glucose,FBG)、血脂包括高密度脂蛋白胆固醇 (high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、 甘油三脂(triglyceride, TG)、总胆固醇(total cholesterol,TC)等生化指标。PDR组患者需测HbA1c,记录是否使用胰岛素注射或者使用口服降糖药物、术前是否接受视网膜激光光凝治疗、糖尿病病程、是否患高血压病、每日血糖血压。另取静脉血约3 ml,4℃,3 000r/min,离心10 min,分离血清,分装后存放于-80℃超低温冰箱。在玻璃体切除术开始时未打开灌注管开关前,切取未稀释的中央玻璃体液0.6~1.0 ml,4℃,15 000 r/min,离心5 min,取上清液,分装后存放于-80℃冰箱。血清和玻璃体中ET-1水平测定采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA),操作步骤严格遵循ELISA试剂盒说明。ET-1试剂盒购自美国R&D公司。
1.3 统计学分析
采用 SPSS17.0软件统计系统对所得数据进行统计分析,数据均进行正态性检验,满足正态分布的各指标采用均数标准差(±s)表示,两样本均数比较采用两独立样本均数的t检验;偏态分布的计量资料用中位数(四分位间距)[M(QL,QU)]表示,采用两独立样本资料的Wilcoxon秩和检验(Z检验)进行分析。计数资料比较采用χ2比较。两资料均正态分布的相关性分析采用Pearson相关分析;其中一个不满足正态分布或均不满足正态分布的两资料相关性分析均采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PDR组与对照组患者临床资料的比较
PDR组与对照组在性别构成和年龄比较,差异均无统计学意义(P>0.05),两组具有可比性。PDR组与对照组相比,HDL-C、LDL-C、TG、TC等血脂指标差异均没有统计学意义(P>0.05)。PDR组FBG、BMI高于对照组,差异均具有统计学意义 (P<0.05)。2013年,美国FDA正式批准将HbA1c≥6.5%作为糖尿病的诊断标准。根据该诊断标准,PDR组HbA1c明显高于正常,差异具有统计学意义(P=0.000,表1)。
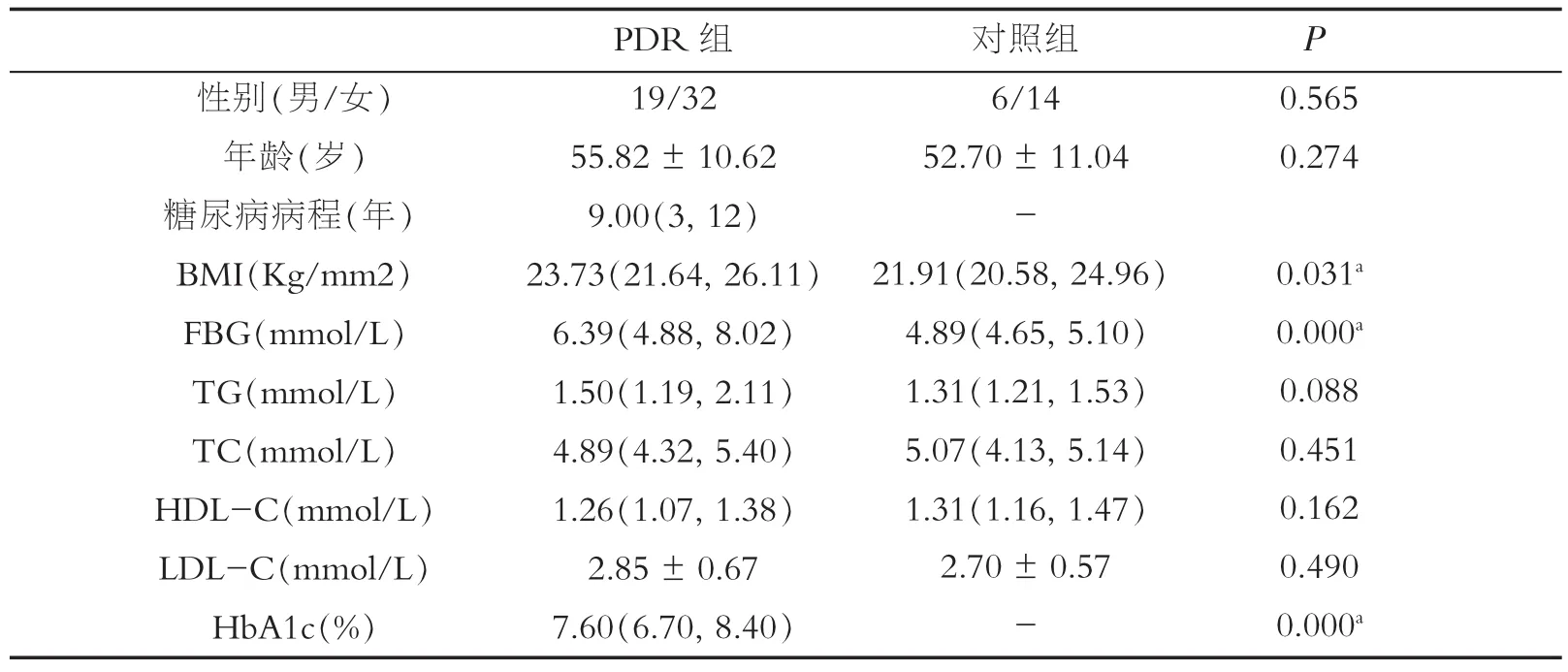
表1 PDR组与对照组临床资料比较
2.2 PDR组与对照组血清中和玻璃体中ET-1水平比较
PDR组血清中ET-1浓度显于对照组血清ET-1浓度,差异具有统计学意义 (Z=-2.68,P=0.007);PDR组玻璃体中ET-1浓度高于对照组玻璃体中ET-1浓度,差异具有统计学意义(Z=-2.48,P=0.013)。分别比较PDR组和对照组中血清与玻璃体中ET-1浓度发现,玻璃体中ET-1浓度高于血清ET-1浓度,差异具有统计学意义 (分别为Z=-5.999,P=0.000;Z=-5.236,P=0.000,表1)。
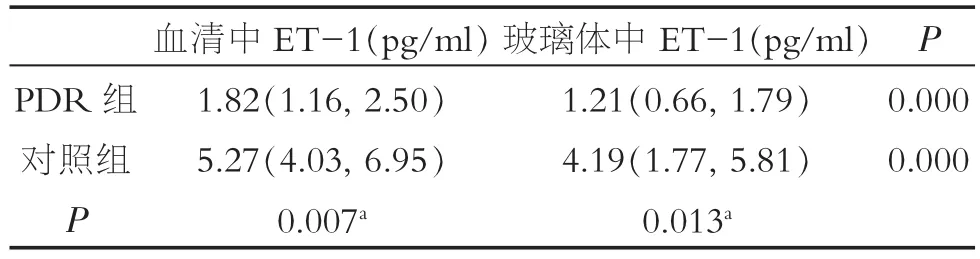
表2 PDR组与对照组血清和玻璃体中ET-1水平比较
2.3 PDR组与对照组ET-1浓度相关性分析
将PDR组和对照组患者血清ET-1浓度与玻璃体中ET-1浓度进行相关性分析,差异无统计学意义,(分别为 r=0.423,P=0.075;r=-0.190,P=0.601)。
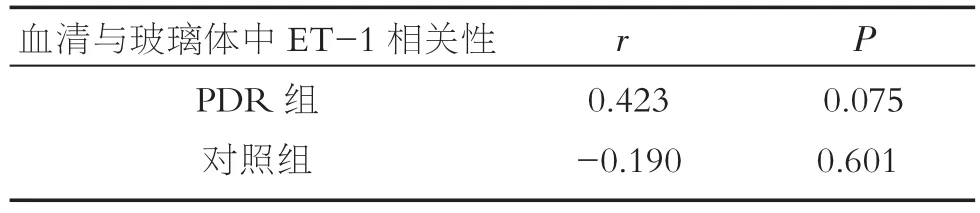
表3 PDR组与对照组ET-1浓度相关性分析
2.4 PDR组血清和玻璃体中ET-1浓度分别与临床资料的相关性分析
将PDR组患者血清和玻璃体中ET-1浓度分别与年龄、糖尿病病程、HbA1c、FBG、血脂等指标进行相关性分析发现,仅PDR组患者血清ET-1浓度与年龄关系呈正相关关系(r=0.551,P=0.000),其余均无相关性。
3 讨 论
ET-1能通过与其受体结合使血管收缩及血管平滑肌细胞增殖[4]。在血糖升高时,ET-1合成增加[5]。血-视网膜内屏障由相邻的视网膜血管内皮细胞紧密连接形成,是阻止ET-1弥散的主要屏障[6]。当血-视网膜内屏障受损后,血管通透性增加,ET-1将穿过此屏障,作用于血管平滑肌细胞,使血管收缩,引起视网膜血流减少,刺激内皮细胞增殖、迁移,促进新生血管形成[7-9]。研究发现,糖尿病大鼠视网膜内ET-1基因表达增加[10];玻璃体内注射ET-1可引起视网膜血管持续收缩,血流量减少[11]。
本次实验观察到,PDR组和对照组患者玻璃体中ET-1的浓度明显高于血清中。ET-1这种局部聚集现象可排除血中高浓度ET-1顺浓度梯度被动转运入眼内组织,但不能完全排除ET-1自血中主动转运入眼的机制。尽管不能完全排除主动转运机制,PDR组患者玻璃体中ET-1的浓度明显高于对照组,可能与视网膜、脉络膜血管床或视网膜色素上皮层产生ET-1并弥散进入玻璃体有关[12]。PDR组患者玻璃体中ET-1浓度高于血清,可能与血-视网膜内屏障破坏,血管通透性增加[13,14],血液中蛋白渗漏进入眼内组织[15],局部渗透压升高后血清中ET-1顺浓度梯度进入眼内组织有关。这与Xu等[16]发现DR患者血ET-1较正常对照组升高的结果一致。Oku等[17]、Patel等[18]也发现PDR患者玻璃体中ET-1升高。尽管多项实验证明PDR患者血或玻璃体中ET-1水平升高,但也有一些实验得出不同结果。Adamiec-Mroczek等[19]使用ELISA法检测19名PDR患者及15名无糖尿病的对照组的血浆中ET-1含量时发现,PDR组患者血中ET-1浓度与对照组间无明显差别;Ogata等[20]使用免疫反应方法检测PDR患者玻璃体中ET水平发现,PDR患者玻璃体中ET水平明显低于非糖尿病组。这与本实验结果不符,可能与实验对象的纳入排除标准不同、实验方法不同、标本的采集及保存的条件方法不同以及实验样本量不够大有关。PDR患者血清中ET-1水平明显高于正常,可通过检测糖尿病患者血中的 ET-1,快速筛查PDR。
尽管本次实验未发现两组血清与玻璃体ET-1的相关性,但可发现PDR组P=0.075在统计学的临界值,扩大样本量后可能出现统计学差异。通过分析ET-1水平与PDR组患者各项指标的相关性发现,仅血清ET-1水平与年龄呈正相关关系 (r= 0.551,P=0.000),而在玻璃体中并未发现类似相关性,可能与PDR患者眼内局部产生ET-1有关。同时提示在通过检测血中ET-1预测PDR发生的风险时应考虑年龄因素,且需进一步研究得出血清ET-1在正常人群不同年龄层的分布范围及不同年龄层的糖尿病无视网膜病变人群血清ET-1的分布范围。与本次实验结果相似,Oku等[17]、Donatelli等[21]、Kamoi等[22]、Mather等[23]研究未发现糖尿病微血管病变患者ET-1浓度与FBG、HbA1c、血压及病程的相关性。
本次实验由于对照组患者无糖尿病家族史或病史,无糖尿病临床症状,在正常饮食无降糖治疗的情况下,随机血糖及空腹血糖均在正常范围,故未测HbA1c。本实验根据FDA所提出的糖尿病诊断标准HbA1c≥6.5%进行比较,PDR组患者HbA1c明显升高(P=0.000),提示血糖控制不理想是糖尿病患者发生PDR的危险因素之一。这与Chetthakul等[24]研究结果一致。
持续高血糖可增加DR发生的风险,Massin等[25]认为FPG>6.0 mmol/L是DR发生的危险因素,控制糖尿病患者血糖,可减缓视力损害[26],能有效延缓DR的病程[27],这与本次实验结果一致,证实血糖升高是PDR发生的危险因素。
尽管大量研究发现PDR患者存在血脂紊乱,但本次实验未发现PDR患者血脂异常;尽管PDR组患者BMI升高,但仍在正常范围内。Wang等[28]研究北京地区DR的危险因素发现,将年龄、性别、BMI等进行匹配后,血脂异常与DR的发生无关,这与本次实验结果一致。这可能是与本次实验的研究对象均为需行手术的住院患者,全身情况需经药物控制至稳定或饮食生活习惯不一样有关,故PDR患者血脂不一定异常。
随着研究的深入,可进一步检测正常人群不同年龄阶段及NPDR患者血中ET-1浓度,了解其表达变化规律。可进一步建立动物模型探索玻璃体腔注射不同浓度的抗ET-1药物治疗PDR,为将来临床治疗PDR提供新思路。
1.Centevs for Disease Coutvol and pvenention.Blindness caused by diabetes-Massachusetts,1987-1994[J].Mmwr Morb Mortal Wkly Rep,1996,45(43):937-941.
2.Liu L,Wu X,Liu L,et al.Prevalence of dia betic retinopathy in mainland China:a meta-analysis[J].PLoS One,2012,7(9):e45264.
3.Garcia S F,Virag L,Jagtap P,et al.Diabetic endothelial dysfunction:the role of poly(ADP-ribose)polymerase activation[J].Nat Med,2001,7(1):108-113.
4.Alberts GF,Peifley KA,Johns A,et al.Constitutive endothelin-1 overexpression promotes smooth muscle cell proliferation via an external autocrine loop[J].J Biol Chem, 1994,269(13):10112-10118.
5.Maccumber MW,Jampel HD,Snyder SH.Ocular effects of the endothelins.Abundant peptides in the eye[J].Arch Ophthalmol,1991,109(5):705-709.
6.Wagner OF,Christ G,Wojta J,et al.Polar secretion of endothelin-1 by cultured endothelial cells[J].J Biol Chem, 1992,267(23):16066-16068.
7.Morbidelli L,Orlando C,Maggi CA,et al.Proliferation and migration ofendothelialcellsispromoted by endothelins via activation of ETB receptors[J].Am J Physiol, 1995,269(2 Pt 2):H686-H695.
8.Goligorsky MS,Budzikowski AS,Tsukahara H,et al. Co-operation between endothelin and nitric oxide in promoting endothelial cell migration and angiogenesis[J]. Clin Exp Pharmacol Physiol,1999,26(3):269-271.
9.Salani D,Taraboletti G,Rosano L,et al.Endothelin-1 induces an angiogenic phenotype in cultured endothelial cells and stimulates neovascularization in vivo[J].Am J Pathol,2000,157(5):1703-1711.
10.Takagi C,Bursell SE,Lin Y W,et al.Regulation of retinalhemodynamicsin diabetic ratsby increased expression and action of endothelin-1[M].Invest ophthalmel Vis sci,1996,37:2504-2518.
11.Bursell SE,Clermont AC,Oren B,et al.The in vivo effect of endothelins on retinal circulation in nondiabetic and diabetic rats[J].Invest ophthalmol Vis Sci,1995,36(3):596-607.
12.Narayan S,Prasanna G,Krishnamoorthy RR,et al. Endothelin-1 synthesis and secretion in human retinal pigment epithelial cells(ARPE-19):differential regulation by cholinergics and TNF-alpha[J].Invest ophthalmol Vis Sci,2003,44(11):4885-4894.
13.Cunha-Vaz JG.Studies on the pathophysiology of diabetic retinopathy.The blood-retinal barrier in diabetes[J]. Diabetes,1983,32 Suppl 2:20-27.
14.Kim J,Kim CS,Lee IS,et al.Extract of Litsea japonica ameliorates blood-retinal barrier breakdown in db/db mice[J].Endocrine,2014,46(3):462-429).
15.Roldan-Pallares M,Rollin R,Martinez-Montero JC,et al.Immunoreactive endothelin-1 in the vitreous humor and epiretinal membranes of patients with proliferative diabetic retinopathy[J].Retina,2007,27(2):222-235.
16.Xu W,Wang HY,Zhao XH,et al.[Values of ocular hemodynamics and serum endothelin-1 in the early diagnosis of diabetic retinopathy][J].Zhonghua Yi Xue Za Zhi,2013,93(1):37-40.
17.Oku H,Kida T,Sugiyama T,et al.Possible involvement of endothelin-1 and nitric oxide in the pathogenesis of proliferative diabetic retinopathy[J].Retina,2001,21(6): 647-651.
18.Patel JI,Saleh GM,Hykin PG,et al.Concentration of haemodynamicand inflammatoryrelated cytokinesin diabetic retinopathy[J].Eye(Lond),2008,22(2):223-228.
19.Adamiec-Mroczek J,Oficjalska-Mlynczak J,Misiuk-Hojlo M.Roles of endothelin-1 and selected proinflammatory cytokines in the pathogenesis of proliferative diabetic retinopathy:Analysis of vitreous samples[J].Cytokine, 2010,49(3):269-274.
20.Ogata M,Naruse M,Iwasaki N,et al.Immunoreactive endothelin levels in the vitreous fluid are decreased in diabetic patients with proliferative retinopathy[J].J Cardiovasc Pharmacol,1998,31 1:378-379.
21.Donatelli M,Colletti I,Bucalo ML,et al.Plasma endothelin levels in NIDDM patients with macroangi-opathy [J].Diabetes Res,1994,25(4):159-164.
22.Kamoi K,Ishibashi M,Yamaji T.Endothelin-1 and big endothelin-1 in NIDDM patients with and without microangiopathy[J].Diabetes Res Clin Pract,1994,24(3): 125-129.
23.Mather KJ,Mirzamohammadi B,Lteif A,et al.Endothelin contributes to basalvascular tone and endothelial dysfunction in human obesity and type 2 diabetes[J]. Diabetes,2002,51(12):3517-3523.
24.Chetthakul T,Deerochanawong C,Suwanwalaikorn S,et al.Thailand diabetes registry project:prevalence of diabetic retinopathy and associated factors in type 2 diabetes mellitus[J].J Med Assoc Thai,2006,89 Suppl 1:S27-S36.
25.Massin P,Lange C,Tichet J,et al.Hemoglobin A1c and fasting plasma glucose levels as predictors of retinopathy at 10 years:the French DESIR study[J].Arch Ophthalmol, 2011,129(2):188-195.
26.Zhu CH,Zhang SS,Kong Y,et al.Effects of intensive control of blood glucose and blood pressure on microvascular complications in patients with type II diabetes mellitus[J].Int J Ophthalmol,2013,6(2):141-145.
27.Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes:UKPDS
38.UK Prospective Diabetes Study Group[J].BMJ,1998, 317(7160):703-713.
28.Wang S,Xu L,Jonas J B,et al.Dyslipidemia and eye diseases in the adult Chinese population:the Beijing eye study[J].PLoS One,2012,7(3):e26871.
(2016-04-20收稿)
Study of endothelin-1 expression in vitreous and serum in proliferative diabetic retinopathy
Chen Juan1,2,Lu Hongbin1,Zhou Qi1,He Yue1,Ouyang Ke1,Shi Yanting1,Cao Xiaolan11Department of Ophthalmology,the Affiliated Hospital of Southwest Medical University,Luzhou 646000, Sichuan Province,China;2Department of Ophthalmology of the Fifth People’s Hospital of Chengdu,Chengdu 611130,Sichuan Province,China
Proliferative diabetic retinopathy,Endothelin-1,Serum,Vitreous,Blood glucose
R774.1
A
10.3969/j.issn.1000-2669.2016.03.007
陈 娟(1987-),女,医师,硕士,E-mail:411467775@qq.com
Abstruca Objective:This experiment is to investigate the potential role of ET-1 in the pathogenesis of proliferative diabetic retinopathy (PDR)by detecting the expression of ET-1 in vitreous and serum,and the correlation of the concentration of ET-1 in serum and in vitreous was analyzed.Methods:A total of 65 patients who were candidates for conventional pars plana vitrectomy were divided into PDR group and control group.Age, gender,height,weight,history of diabetes,fasting blood glucose,high density lipoprotein,low density lipoprotein, triglyceride,total cholesterol,duration of diabetes,and glycosylated hemoglobin of PDR patients were recorded. All the serum and vitreous samples were collected and spun down,and the supernatants were then frozen at-80℃. The concentrations of ET-1 in serum and vitreous were determined by enzyme-linked immunosorbent assay(ELISA).Results:Age and gender difference between the PDR group and control group were not statistically significant(P>0.05).The ET-1 concentration in the serum of the PDR group was higher than that in the control group(P<0.01).The ET-1 concentration in the vitreous of PDR group was higher than that in the control group(P<0.05).Although the concentration of ET-1 in vitreous was increased than that in the serum in the two groups,there was no correlation between vitreous and serum in the two groups (r PDR group=0.423,P PDR group=0.075 and control group r control group=-0.19,P control group=0.601).Fasting blood glucose andBMI in the PDR group were higher than those in the control group(P<0.05).The glycosylated hemoglobin in the PDR group was significantly increased(P<0.01)relative to the control group.Conclusion:The concentration of ET-1in the serum and vitreous of the PDR patient is significant higher than that in normal people.PDR may occur in diabetic patients with normal blood lipid and BMI.

