新孢子虫对小鼠致病力及在小鼠体内动态分布的研究
龙烟朦,高鸿博,马 磊,2,李木子,2,刘 群,2,刘 晶,2(.中国农业大学动物医学院,北京海淀0093;2.农业部动物流行病学与人畜共患病重点实验室农业部国家动物寄生原虫实验室,北京海淀0093)
新孢子虫对小鼠致病力及在小鼠体内动态分布的研究
龙烟朦1,高鸿博1,马磊1,2,李木子1,2,刘群1,2,刘晶1,2
(1.中国农业大学动物医学院,北京海淀100193;2.农业部动物流行病学与人畜共患病重点实验室农业部国家动物寄生原虫实验室,北京海淀100193)
摘要:小鼠是研究新孢子虫的动物模型。通过小鼠毒力试验,检测3株新孢子虫(Nc-1,Nc-LIV和Nc-BJ)对BALB/ c小鼠的致病力差异;同时研究了低剂量Nc-LIV株(1×106)感染后,新孢子虫在小鼠的心、肝、脾、肺、肾、脑和后肢肌肉中的分布情况及其在血清中抗体的动态变化规律。结果显示,Nc-LIV对BALB/c小鼠的毒力最强,Nc-BJ其次,Nc-1最弱。小鼠血清中新孢子虫抗体在感染后4 d出现至第32天达到峰值。感染后第8天在脑组织中可检测到新孢子虫特异性基因Nc-5,在第32天达到峰值后下降;其他组织中则分布很少。通过观察新孢子虫Nc-LIV在小鼠体内各器官组织动态分布的规律,为进一步建立小鼠感染新孢子虫的动物模型,研究新孢子虫病奠定了基础。
关键词:新孢子虫;毒力试验;组织分布;脑荷虫量
高鸿博(1994-),女,本科生,从事动物医学专业学习,E-mail:gaohongbo1994@163.com
注:高鸿博与龙烟朦对本文具有同等贡献
新孢子虫(Neospora caninum)隶属于原生动物门(Protozoa),顶复亚门(Apicomplexa),孢子虫纲(Sporozoea),真球虫目(Eumeriina),肉孢子虫科(Sarcocystidae),新孢子虫属(Neospora)。新孢子虫主要寄生在中枢神经系统、肌肉细胞、肝、脑及多种有核细胞内,引起孕畜的流产和死胎,以及新生儿的运动神经系统障碍[1]。尽管新孢子虫分布广泛、中间宿主众多,但在全世界范围分离到的虫株非常有限。自1988年Dubey等从先天性脑脊髓炎的犬脑组织中分离第一株新孢子虫并命名为Nc-1株后[2],研究人员先后从不同的宿主体内分离到新孢子虫虫株约80株[3]。其中Nc-LIV分离自英国先天感染的幼犬神经组织[4]。Nc-BJ株则于2011年分离自北京地区新孢子虫抗体阳性牛血液淋巴细胞[5]。我国奶牛新孢子虫感染情况普遍,有流产史的母牛与新孢子虫血清抗体阳性密切相关,说明新孢子虫感染是奶牛流产的重要原因[6-7]。2007年对流产奶牛进行诊断时发现流产胎牛的脑组织中存在新孢子虫,从病原学角度证实了新孢子虫是引起奶牛流产的原因[8]。
牛是新孢子虫的重要中间宿主,但对牛进行新孢子虫人工感染比较困难且代价昂贵。小鼠是研究新孢子虫的常见实验模型,其中某些近交系小鼠,如BALB/c小鼠对新孢子虫易感性很强[9]。邓冲等人成功建立了新孢子虫病BALB/c小鼠的感染模型,报道了新孢子虫Nc-1虫株的生物学特性、致病情况,并对其在小鼠各组织器官的分布情况进行了常规PCR检测[10]。本研究以BALB/c小鼠为实验动物,通过人工感染新孢子虫标准株Nc-1、Nc-LIV、北京分离株Nc-BJ研究不同来源的新孢子虫分离株对小鼠的致病性差异;检测Nc-LIV株在小鼠体内动态分布情况,为进一步研究大型动物的新孢子虫病提供参考资料。
1 材料与方法
1.1试验材料新孢子虫标准株Nc-1,Nc-LIV和北京株Nc-BJ,由中国农业大学动物医学院,农业部国家动物寄生原虫实验室传代并保存;6周龄近交系BALB/c雌性小鼠,购自北京华阜康生物科技股份有限公司;羊抗鼠IgG-HRP抗体,购自北京欣经科生物技术有限公司;全血组织细胞基因组DNA快速提取试剂盒,购自北京艾德莱生物技术公司;PCR相关试剂,购自北京全式金生物技术有限公司;实时荧光定量PCR检测试剂,购自宝生物工程(大连)有限公司。
1.2试验方法
1.2.1毒力试验30只BALB/c小鼠随机等分成3组。每组分别腹腔接种Nc-1,Nc-LIV或Nc-BJ株5×106个速殖子/只,连续观察90天并记录小鼠的临床症状、体重变化和死亡时间。毒力试验重复一次,综合两次试验的结果绘制存活曲线。
1.2.2Nc-LIV在小鼠体内动态分布
1.2.2.1试验设计将35只BALB/c小鼠分成两组,试验组28只,对照组7只。试验组腹腔接种Nc-LIV株1×106个速殖子/只,对照组腹腔注射300 μL PBS/只。接种后每天观察并记录小鼠的临床症状、体重变化和死亡时间。分别于接种后第1、2、4、8、16、32天和第64天,试验组随机选取3只小鼠,对照组选取1只小鼠,分离血清,断颈处死。无菌条件下剖检,采集心、肝、脾、肺、肾、脑和后肢肌肉组织。样本保存于-80℃待检。提取脑组织DNA,进行实时荧光定量PCR检测,计算小鼠感染新孢子虫的脑荷虫量和动态变化。
1.2.2.2血清新孢子虫抗体检测应用间接ELISA方法检测小鼠血清中抗体水平。收集新鲜释放的Nc-1速殖子,超声裂解制备新孢子虫全虫抗原。以全虫抗原100 ng/孔包被,待检小鼠血清1∶100稀释,二抗羊抗鼠IgG-HRP 1∶5 000稀释,测定OD450nm/630 nm值。
1.2.2.3组织新孢子虫检测应用全血组织细胞基因组DNA快速提取试剂盒提取小鼠心、肝、脾、肺、肾、脑和后肢肌肉组织DNA。以小鼠各组织DNA为模板,Np6(5′-CAGTCAACCTACGTCTTCT-3′)和Np21(5′-GTGCGTCCAATCCTGTAAC-3′)为特异性引物,扩增新孢子虫特异性基因Nc-5基因。1%琼脂糖凝胶电泳观察PCR扩增结果。
1.2.2.4脑组织荷虫量检测应用实时荧光定量PCR方法扩增脑组织中新孢子虫的Nc-5基因和小鼠的18S基因,经计算确定小鼠脑组织荷虫量。Nc-5特异性引物为Np6/Np21;小鼠18S特异性引物上游F:5′-ATTAGATACAGAACCAACCCAC-3′,下游R:5′-TGAATGATCCGTCGCAGAC-3′。根据Nc-5标准品和脑组织18S DNA标准品绘制标准曲线。每20 μL反应体系中包括:2 μL DNA模板,上下游引物各0.8 μL(10 μmol/L),SYBR premix Ex TaqⅡ染料10 μL和ddH2O 6.4 μL。反应结束后分别根据各浓度目的基因和内参基因的Ct值,运用7500 software分析扩增曲线和标准曲线。
1.3数据处理与分析试验数据采用SPSS 13.0软件和GraphPad Prism 5.0处理分析。
2 结果与分析
2.1毒力试验
2.1.1临床症状及体重变化3个感染组小鼠临床症状类似。感染前期主要表现为活动性下降,被毛蓬乱、拱背蜷缩、全身震颤等。60 d后大部分小鼠神经症状加重,出现活动障碍、后肢僵直、身体重心偏移和原地转圈等症状。感染前期各组体重变化无明显差异,后期对照组体重平稳上升,试验组体重波动大,且个体差异增大。接种后15 d试验组小鼠体重开始下降,第30天后实验组与对照组差异明显,至第71天Nc-LIV组小鼠全部死亡且体重下降最明显,Nc-BJ组次之,Nc-1组小鼠体重变化幅度最小(图1)。
2.1.2存活率接种后第4天Nc-LIV组小鼠开始死亡,在接种后71 d全部死亡;Nc-BJ组小鼠于第6天开始死亡;Nc-1组小鼠于第8天开始死亡。至接种后88 d,Nc-BJ组存活1只,Nc-1组存活6只(图2)。
2.2Nc-LIV在小鼠体内动态分布
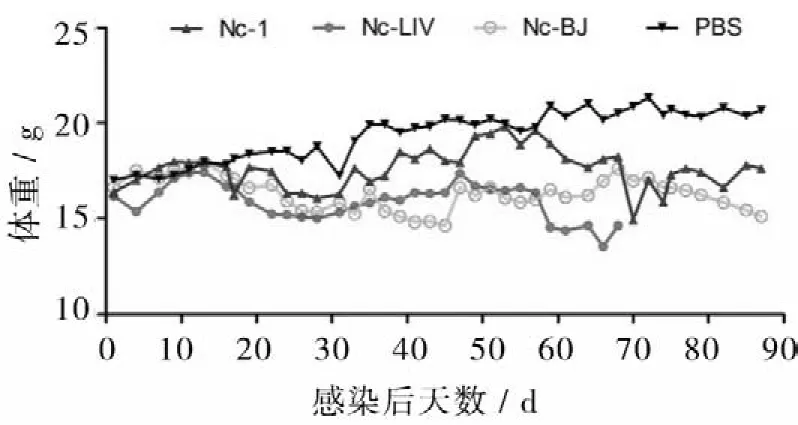
图1 小鼠感染新孢子虫后体重变化
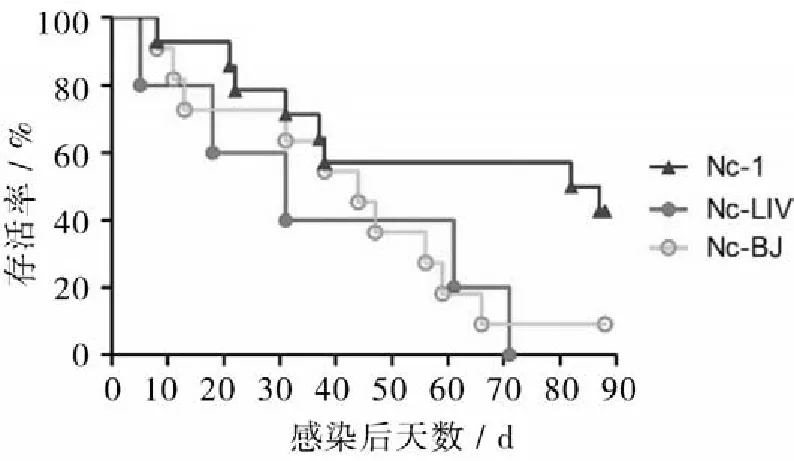
图2 小鼠存活曲线
2.2.1临床症状和病理变化小鼠接种Nc-LIV速殖子(1×106个)后第16天出现被毛凌乱,但精神状态良好。第26天至第53天表现精神萎靡、消瘦,出现拱背颤抖、后肢僵直等神经症状。接种后第8天有肺脏出血和肝脏肿大充血等病理变化;肾脏和心脏也出现充血现象。各采样点剖检均未发现有腹水,后肢肌肉组织表观正常,未见出血情况。
2.2.2血清抗体水平变化接种后第3天可检测到新孢子虫特异性抗体,随后抗体水平缓慢增加,第8-16天快速增加,于第32天达到峰值后缓慢下降(图3)。
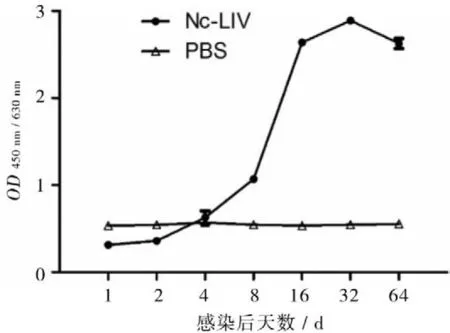
图3 小鼠血清新孢子虫抗体
2.2.3新孢子虫在小鼠组织中分布情况以各取样点的组织DNA为模板,PCR扩增新孢子虫Nc-5特异性基因。在接种后第2、4天的部分组织中检测到Nc-5基因。第8天肺脏中检测到Nc-5。第32天脑组织中检测到Nc-5基因片段,大小为328 bp。其他组织器官中均未检测到(图4)。

图4 小鼠脑组织Nc- 5扩增结果1~7:Nc-LIV组接种后第1、2、4、8、16、32、64天;8:PBS组接种后第32天;9:阴性对照;10:阳性对照;M:DNA Marker
2.2.4脑荷虫量检测使用绝对荧光定量PCR检测各采样点脑组织DNA中新孢子虫含量。接种后第4天起脑荷虫量逐步增加;第32天达峰值,每微克组织中可检测到约1 286个虫体;第32天至第64天,脑荷虫量下降。

图5 荧光定量PCR检测脑组织DNA中荷虫量
3 讨论
通常根据新孢子虫对小鼠致病力来判定其毒力强弱。本试验中小鼠腹腔接种3种新孢子虫虫株,连续观察90 d,其中Nc-LIV组小鼠最早出现临床症状和发生死亡,在接种后第71天死亡率100%;Nc-BJ组小鼠死亡率90%;Nc-1组小鼠死亡率仅40%。表明Nc-LIV对BALB/c小鼠的毒力最强,Nc-BJ次之,Nc-1最弱。本课题组在前期分离Nc-BJ株时曾对其毒力
进行过初步研究,发现小鼠感染Nc-BJ后第6天出现死亡,观察仅持续到感染后第32天,死亡率为43%[8]。本研究发现,小鼠感染Nc-BJ株后死亡趋势与之前的研究结果相似,并通过延长观察时间及与Nc-1和Nc-LIV株的对比试验进一步完善了新孢子虫对小鼠的致病性研究。在三株新孢子虫中Nc-LIV的致病性最强,Nc-BJ致病性居中,Nc-1的毒力最弱,可能与Nc-1在细胞上多次传代,导致毒力减弱有关[11]。
新孢子虫Nc-5基因是其特异性基因,被广泛应用于新孢子虫感染的检测[12-13]。在Nc-LIV株在小鼠体内的动态分布研究中,实时荧光定量PCR结果显示,接种后第8天,小鼠脑组织DNA中检测到新孢子虫Nc-5基因,说明此时Nc-LIV已突破血脑屏障而侵入脑内。脑组织中虫体含量32 d达到峰值,这与小鼠在接种后第26-53天期间表现出明显的神经症状相符,随后脑荷虫量下降。结果与同等剂量Nc-BJ株在小鼠脑组织中荷虫量变化趋势类似[8]。而常规PCR只在感染后第32天,检测出脑组织的Nc-5基因,其原因可能是由于新孢子虫分布在小鼠组织中的数量少,常规PCR法敏感性低所致。其他组织器官中,仅在第8天的肺组织DNA中检测到Nc-5基因,这与新孢子虫的嗜组织性[14],即对血管丰富的肺脏偏爱有关。
4 结论
通过对不同地区不同来源的3株新孢子虫分离株对小鼠的致病力研究发现,Nc-LIV株对BALB/c小鼠的毒力最强,Nc-BJ株次之,Nc-1株最弱。初步了解了Nc-LIV在小鼠体内组织器官中的动态分布规律,为新孢子虫病病原的进一步研究奠定了基础。
参考文献:
[1]汪明.兽医寄生虫学[M].3版.北京:中国农业出版社,2006.
[2] Dubey J P,Carpenter J L,Speer C A,et al.Newly recognized fatal protozoan disease of dogs [J] . Journal of the American Veterinary Medical Association,1988,192(9):1269-1285.
[3]刘群.新孢子虫病[M].北京:中国农业大学出版社,2013.
[4] Ghalmi F,China B,Kaidi R,et al . Detection of Neospora caninum in dog organs using real time PCR systems[J].Veterinary parasitology,2008,155(1):161-167.
[5] Hao P,Yang N,Cui X,et al.First isolation of Neospora caninum from blood of a naturally infected adult dairy cow in Beijing,China[J].Journal of Parasitology,2014,100(6):812-816.
[6] Liu J,Yu J S,Wang M,et al.Serodiagnosis of Neospora caninum infection in cattle using a recombinant tNcSRS2 protein- based ELISA[J].Veterinary parasitology,2007,143(3-4):358-363.
[7] Yao L,Yang N,Liu Q,et al . Detection of Neospora caninum in aborted bovine fetuses and dam blood samples by nested PCR and ELISA and seroprevalence in Beijing and Tianjin,China[J] . Parasitology,2009,136(11):1251-1256.
[8]邓冲,张维,刘群,等.乳牛流产胎儿中新孢子虫的鉴定[J].中国兽医科学,2007,37(1):16-19.
[9] Pipano E,Shkap V,Fish L,et al . Susceptibility of Psammomys obesus and Meriones tristrami to tachyzoites of Neospora caninum [J].Journal of Parasitology,2002,88(2):314-319.
[10]邓冲,张维,刘群,等.BALB/c小鼠新孢子虫病动物模型的建立及在其体内发育过程的研究[J].中国农业科学,2009,42(3):1123-1128.
[11] Bartley P M,Wright S,Sales J,et al . Long- term passage of tachyzoites in tissue culture can attenuate virulence of Neospora caninum in vivo [J].Parasitology,133(4):421-432.
[12] Cuddon P,Lin D S,Bowman D D,et al.Neospora caninum infection in English Springer Spaniel littermates .Diagnostic evaluation and organism isolation[J].Journal of Veterinary Internal Medicine,1992,6(6):325-332.
[13] Yamage M,Flechtner O,Gottstein B.Neospora caninum: specific oligonucleotide primers for the detection of brain "cyst" DNA of experimentally infected nude mice by the polymerase chain reaction(PCR)[J].Journal of Parasitology,1996,82(2):272-279.
[14]邓冲.流产胎牛体内新孢子虫的鉴定及其生活史的初步研究[D].北京:中国农业大学,2007.
Virulenceand Dynamic Distribution of Neospora caninum in Mice
LONG Yan-meng1,GAO Hong-bo1,MA Lei1,2,LI Mu-zi1,2,LIU Qun1,2,LIU Jing1,2
(1.College of Veterinary Medicine,China Agricultural University,Beijing 100193,China;2.China Key Laboratory of Animal
Epidemiology and Zoonosis,Ministry of Agriculture,and National Animal Protozoa Laboratory,Beijing 100193,China)
Abstract:Mice are animal models in Neospora caninum research.Virulence of three strains of N.caninum(Nc-1,Nc-LIV and Nc-BJ)was detected by virulence assay.Parasites distribution in tissues and dynamic variation of antibody were investigated when mice were infected with low doses of Nc-LIV(1×106).Nc-LIV was the strongest virulence strain for BALB/c mice,Nc-BJ was the moderate virulence strain and Nc-1 was the weakest one.Serum antibodies to Neospora appeared in 4 days after infection and reached the peak in 32 days.N.caninum specific genes Nc-5 could be detected in the brains after 8 days and at the peak in 32 days after infection.Spread of tachyzoites of Nc-LIV among the tissues were traced in BALB/c mice for further establishment of an animal model and laid the foundation of the N.caninum research.
Key words:Neospora caninum;virulence assay;tissues distribution;parasitic burden in the brain
Corresponding author:LIU Jing
通讯作者:刘晶,E-mail:liujingvet@cau.edu.cn
作者简介:龙烟朦(1993-),女,本科生,从事动物医学专业学习,E-mail:long_yanmeng@126.com
基金项目:国家自然科学基金(31302075);国家教育部博士点基金(20130008120010)
收稿日期:2015-08-26
中图分类号:S852.72+3
文献标志码:A
文章编号:0529- 6005(2016)01- 0003- 03

