人参细胞TTC-脱氢酶活力测定条件的优化
王晗,雷秀娟,宋娟,尹红新,姚丽娜,梁韶,侯志芳,王英平
(中国农业科学院特产研究所,长春?130112)
人参(PanaxginsengC.A.Mey)为多年生草本植物,是我国名贵中药材,具有抗肿瘤、抗衰老等功效。由于人参生长周期长且不能连作,严重阻碍了我国人参产业的可持续发展。为此,将组织培养应用于人参育种,为缩短育种年限及实现种质创新提供了技术手段。从此,细胞悬浮培养技术研究成为该领域的热点。
由于植物悬浮培养技术受生长周期、pH、初始接种细胞状态、培养基成分等因素的影响,悬浮培养过程中其细胞活力、细胞状态对细胞生长和次生代谢产物的合成有重要的作用。从20世纪70年代开始,研究者采用2,3,5-氯化三苯四氮唑(TTC)-脱氢酶还原法测定植物细胞活力[1,2]。TTC-脱氢酶还原法最早应用于植物种子活力的测定[3],后来逐步用于植物根系、茎叶、花粉等部位细胞的活力检测[4,5]和超低温保存后细胞相对存活率的测定[6~8],国内不少学者用于植物悬浮细胞活力的测定[9]。
目前,国内报道TTC-脱氢酶还原法以氧化还原性染料TTC作为指示剂,当细胞内有生物氧化(脱氢反应)时,TTC接受H被还原成红色的三苯基甲月赞(TF),使用有机溶剂萃取出TF,在485nm波长下测其吸光光度值,以吸光光度值来反映脱氢酶活性,进而反映细胞活力[10,11]。此方法虽然操作简单,但在实际应用中常受多种因素的影响,如溶液pH、萃取剂、反应温度等[12,13]。因此,本试验采用单因子试验设计和正交试验设计对人参细胞活力的测定参数进行优化,确定人参细胞TTC-脱氢酶活力测定所需条件,为人参优良细胞筛选提供理论依据,加快人参育种的工作进程。
1 材料与方法
1.1 材料
本试验供试材料由中国农业科学院特产研究所资源圃种植的3年生人参叶片为外植体,建立人参愈伤组织无性系。
1.2 试剂
2,3,5-氯化三苯基四氮唑(TTC,上海惠世生化试剂有限公司);0.9%生理盐水(四平巨能药业有限公司);磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·2H2O)、无水乙醇、甲醛(分析纯,北京化工厂);硫酸钠(Na2SO3)、连二亚硫酸钠(Na2S2O4,国药集团化学试剂有限公司)。
1.3 方法
1.3.1材料的制备将人参叶片诱导而成的愈伤组织继代培养15d左右,接种于MS液体培养基中,置于摇床上25℃培养10d。样品于800r/min离心10min,去液体培养基,然后用0.9%生理盐水冲洗,于800r/min离心10min,去上清,重复3次,称取0.1g人参细胞,待用。
1.3.2不同浓度TTC溶液的配制称取TTC粉末0.05g、0.1g、0.2g、0.4g、0.6g、0.8g、1.0g溶于100mL蒸馏水中,浓度分别为0.05%、0.1%、0.2%、0.4%、0.6%、0.8%、1.0%,避光保存。
1.3.3不同pH缓冲液的配制分别称取35.82g Na2HPO4·12H2O和15.6g NaH2PO4·2H2O溶于500mL蒸馏水中,配制浓度为0.2mol/L的NaH2PO4和Na2HPO4溶液;将2溶液按一定比例混合,得到不同pH的磷酸缓冲液。
1.3.4TTC标准曲线制备参考赵连梅方法[14],称取0.05g TTC,溶于50mL蒸馏水中,配制1mg/mL TTC标准溶液,存于棕色容量瓶中。分别吸取1mg/mL标准溶液0mL、1mL、2mL、3mL、4mL、5mL、6mL置于50mL棕色容量瓶中,蒸馏水定容,则TTC质量浓度分别为0mg/L、20mg/L、40mg/L、60mg/L、80mg/L、100mg/L、120mg/L,即为工作液。将此工作液分别吸取1.0mL置于15mL离心管中,再依次加入磷酸缓冲液(pH 7)2mL、0.36% Na2SO3溶液1mL、蒸馏水1mL,混匀后分别加入连二亚硫酸钠(Na2S2O4)5mg,充分混匀置于暗处,致使TTC全部还原为TF。加入0.4mL甲醛终止反应。再加5mL无水乙醇为萃取剂,60℃水浴20min~30min,离心取上清,于485nm波长处测吸光光度值,绘制标准曲线。
1.3.5TTC法测定细胞活力参照Towill和Mazur方法[15],取待用0.1g人参细胞置于试管中,加入TTC溶液和磷酸缓冲液5mL(按1∶1比例混合),静置于暗处,TTC接受细胞呼吸过程中产生的H被还原为红色物质TF。一段时间后去上清,加入5mL蒸馏水洗涤,重复2次~3次。加入5mL无水乙醇,置于60℃水浴20min~30min,室温下静置至细胞无色。取上清,采用分光光度计在485nm波长处测吸光光度值。根据测定的吸光光度值计算出TF的质量浓度,定义每分钟每克细胞反应1μg TF作为1个酶活力单位。
1.3.6单因子试验设计在优化TTC-脱氢酶还原法测定人参细胞活力参数过程中,分别对TTC浓度、pH、反应温度、反应时间进行单因子试验。
1.3.7正交试验设计根据单因素试验设计中对TTC浓度、pH、反应温度、反应时间进行初步筛选大致范围,每个因子设4个水平,用L16(45)正交表作16个试验(表1)。
表1正交试验因素与水平

Table 1Factors and levels of orthogonal test
1.3.8数据分析以吸光光度值(OD)、酶活力(U)为评价指标,采用SAS统计分析软件对试验数据进行极差和方差分析。
2 结果分析
2.1 TTC法检测脱氢酶活力的标准曲线
不同浓度的TTC溶液与过量的还原剂Na2S2O4反应生成TF,以TF为生成量作为横坐标、485nm处的吸光光度值为纵坐标作图,见图1。
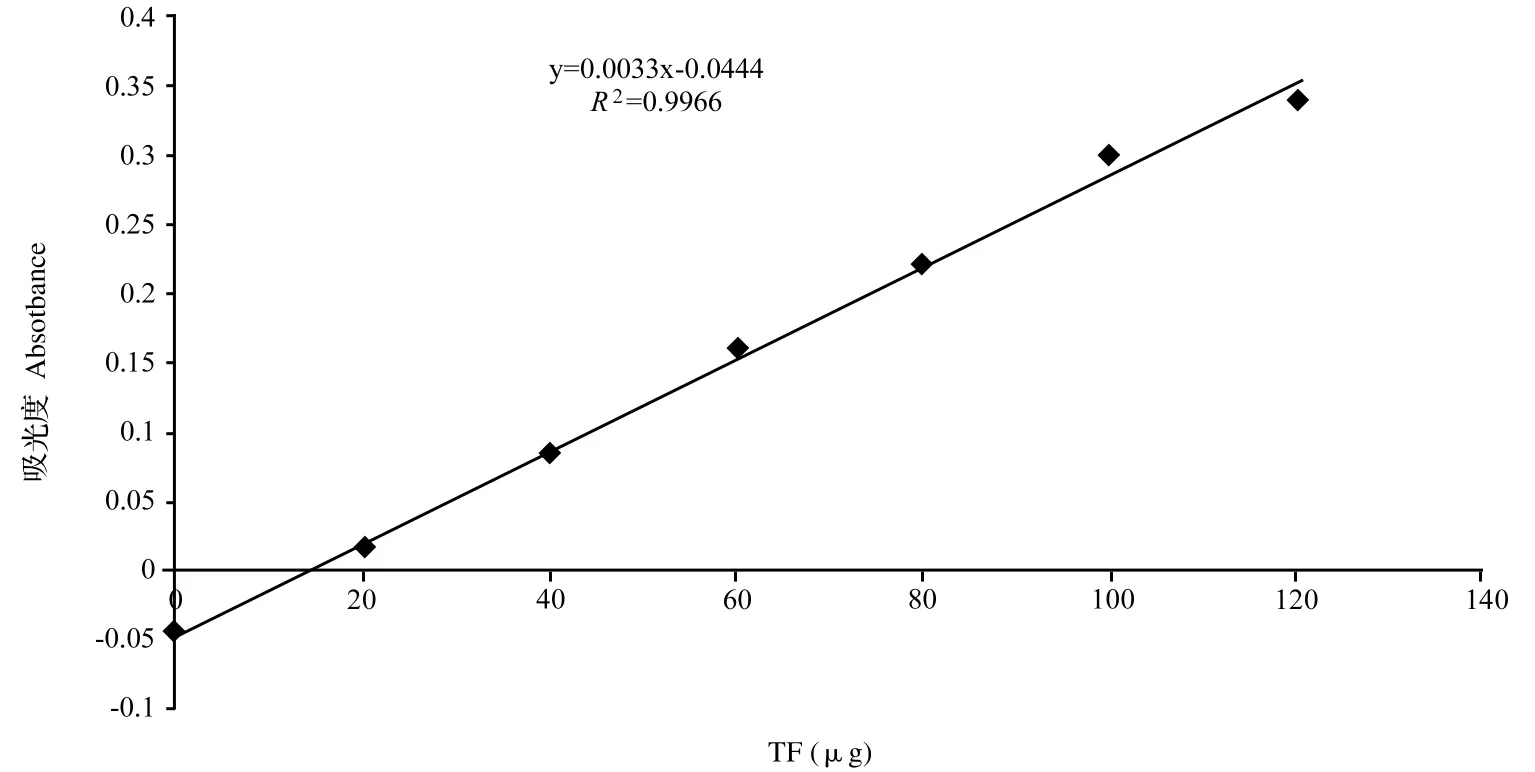
图1 TF标准曲线
由图1可得:m(TF)=(OD485+0.0444)/0.0033μg,测定细胞呼吸链脱氢酶活力=m(TF)/(t×m)。式中,t:反应时间(min);m:细胞重量(g)。
2.2 单因素试验设计
2.2.1TTC浓度对脱氢酶活力的影响TTC作为细胞呼吸过程中产生的H接受体,在样品反应体系中,为了测定不同TTC浓度对TF的生成量的影响。首先将反应体系pH设为7、反应温度为25℃、反应时间为24h。试验中研究了0.05%、0.1%、0.2%、0.4%、0.6%、0.8%、1.0% TTC对脱氢酶活力测定的影响。TTC浓度对脱氢酶活力测定的影响结果见图2。
由图2可知,当TTC浓度为0.05%时,吸光光度值仅为0.1~0.2之间;随着TTC浓度的增加,吸光光度值、酶活力值呈先上升后下降的趋势;当TTC浓度为0.6%时,吸光光度值、酶活力值均达到最大;此后脱氢酶活性开始有微小的下降。由此可以得出,试验中反应体系中的TTC浓度控制在0.4%~1.0%之间对获得稳定的TF生成量较有利。

图2 TTC浓度对TF吸光值和脱氢酶活性测定的影响
2.2.2pH对脱氢酶活力的影响磷酸缓冲液是TTC脱氢酶活性测定常用的缓冲液。首先将反应体系中TTC浓度设为0.6%、反应温度设为25℃、反应时间为24h。试验中研究了不同pH对脱氢酶活力测定的影响(图3)。由图3可知,随着pH的增大,其吸光光度值、活力值呈先上升后稍微下降的趋势。当pH为7.5时,吸光光度值、酶活力值均达到最大。因此,反应体系中适宜pH控制在7~8中性偏碱范围内。
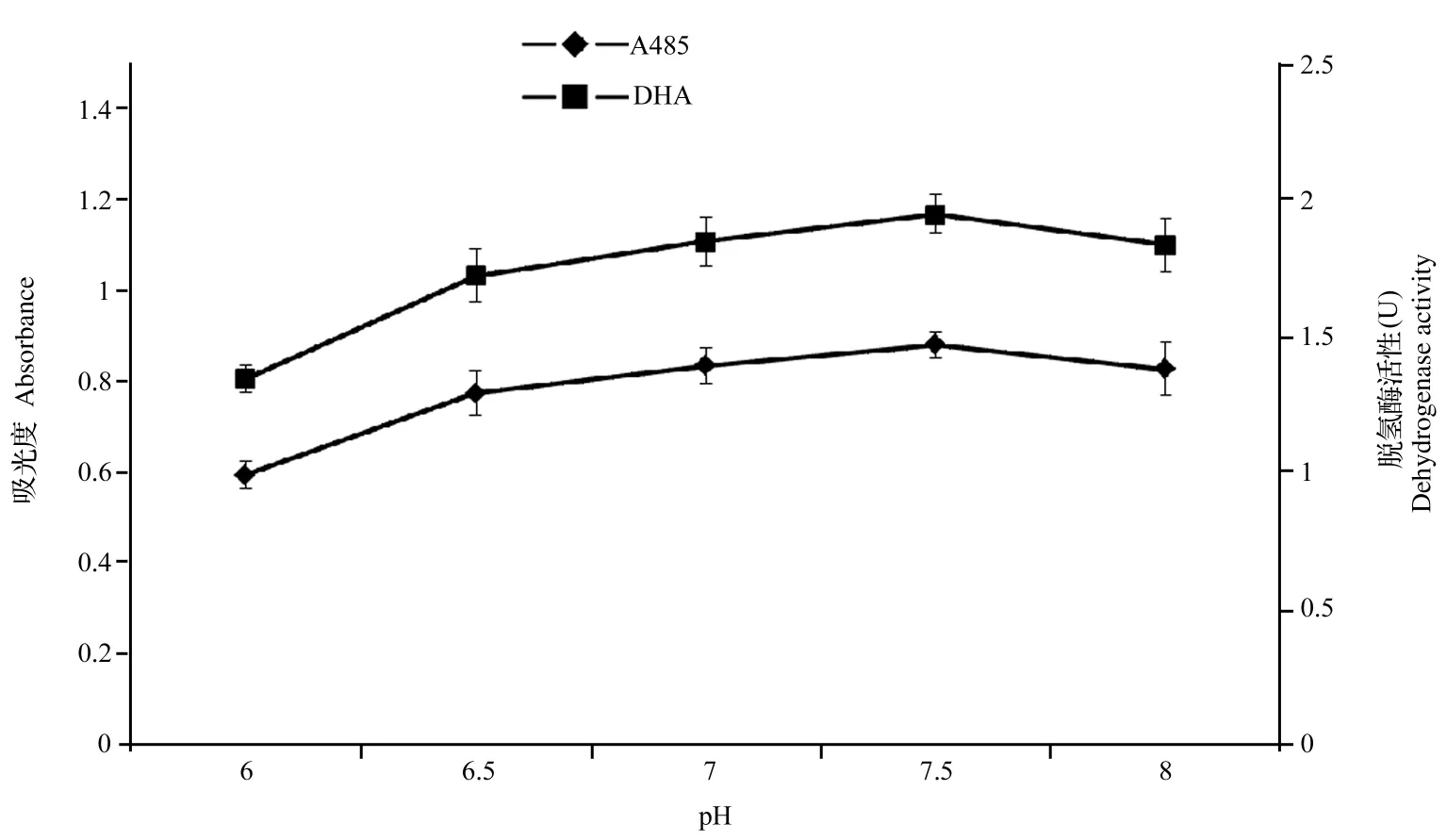
图3 pH值对TF吸光值和脱氢酶活性测定的影响
2.2.3反应温度对脱氢酶活力的影响在样品反应体系中,为了测定反应温度对脱氢酶活力的影响,首先将反应体系中TTC浓度设为0.6%、pH设为7、反应时间为24h。本试验研究了4℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃对脱氢酶活力测定的影响。反应温度对脱氢酶活力测定的影响结果见图4。

图4 反应温度对TF吸光值和脱氢酶活性测定的影响
由图4可知,在其它条件一致的情况下,反应温度对脱氢酶活力影响明显,随着反应温度的升高,脱氢酶活力先增加后降低,当反应温度为25℃时,吸光光度值最大;当温度大于30℃时,吸光光度值急剧下降。因此,对于人参细胞内的脱氢酶,适宜的酶促反应温度为25℃~30℃。
2.2.4反应时间对脱氢酶活力的影响在样品反应体系中,为了测定反应时间对脱氢酶活力的影响,首先将反应体系中TTC浓度设为0.6%、pH设为7、反应温度为25℃。本试验研究了3h、6h、9h、12h、15h、18h、21h、24h、27h对脱氢酶活力测定的影响。反应时间对脱氢酶活力测定的影响结果见图5。
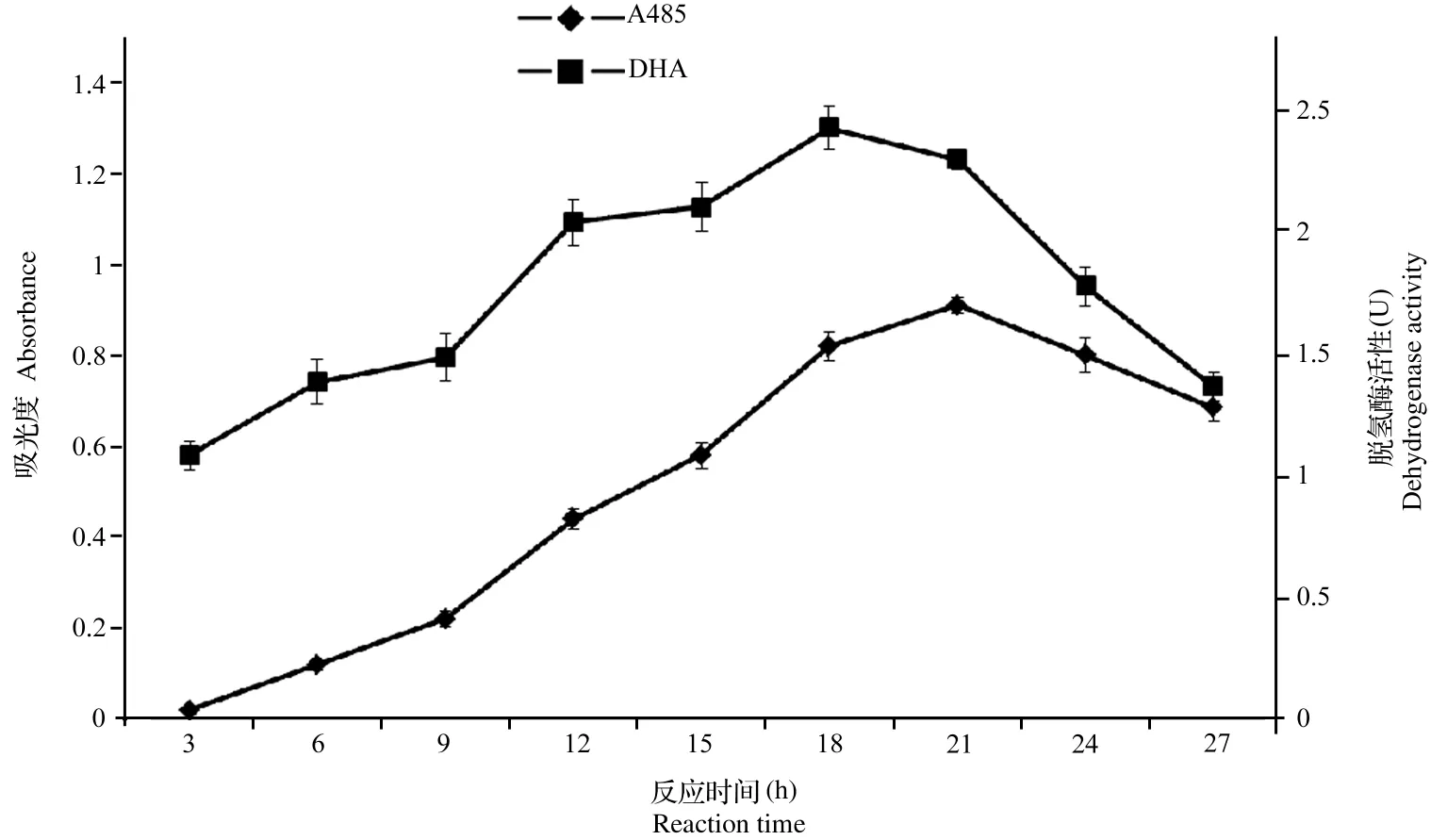
图5 反应时间对TF吸光值和脱氢酶活性测定的影响
结果表明,在一定时间内,TF的生成量随着反应时间的延长而增大,当反应时间为21h,TF生成量最多,吸光光度值最大;随着反应时间延长,吸光光度值反而降低,这与黄春花以蛹虫草为材料研究TTC-脱氢酶活性[16]时得到的变化规律一致;反应时间为18h时,脱氢酶活性达到最大,这是由于酶活力的大小不仅与TF生成量有关,也与细胞重量、反应时间有关。
2.3 正交试验设计
2.3.1极差分析本试验采用L16(45)正交试验设计,以酶活力值(U)为评价指标,对试验数据进行极差分析(表2)。
表2正交试验结果与极差分析

Table 2Results and range analysis of orthogonal test
通过极差分析得出,影响TTC-脱氢酶还原法的主次顺序为反应温度、反应时间、TTC溶液浓度、pH。
2.3.2方差分析对酶活力值进行进一步方差分析,结果如表3所示。
结果表明,在本试验设定的4个因素中,反应温度对人参细胞活力影响达到极显著水平(P<0.01),反应时间对人参细胞活力影响达到显著水平(P<0.1),TTC溶液浓度、pH对人参细胞活力影响不显著。综上,通过方差分析得出最佳水平组合是ABC3D3,因子A、B可选任意水平,结合正交试验,可以选定最佳水平组合为A1B3C3D3。
表3方差分析
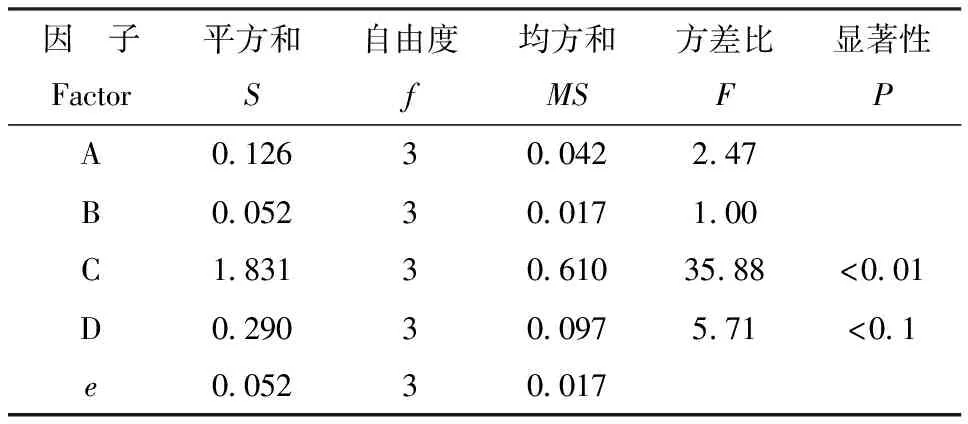
Table 3Analysis of variance
注:F0.90(3,3)=5.39;F0.99(3,3)=29.46。
3 结论与讨论
TTC-脱氢酶还原法测定的细胞活力大小反映脱氢酶催化化学反应的能力[17]。影响酶活力的因素有很多,包括温度、时间、pH、酶浓度等。本试验对反应温度、反应时间、pH、TTC浓度进行单因素试验和正交试验,对人参细胞活力测定条件进行优化,并对其进行了极差和方差分析。
TTC溶液存在适宜的质量浓度范围,过高或过低均会影响体系TF的生成[18]。Mersi等[19]研究发现,通过脱氢酶作用产生的H不一定全部传递给TTC受体,而且TTC本身的毒性也会抑制酶的活力,进而影响H的传递过程,其还原产物TF也可能导致细胞的死亡,这可能是高质量浓度TTC溶液导致TF值下降的原因。
酶促反应体系的酸度、缓冲容量对酶活力测定影响很大。本研究结果表示,当pH为7~8时,TF生成量维持在较高水平。由于磷酸盐缓冲液缓冲范围相对较窄,但是在一定范围内,人参细胞活力随着pH的增加而增加,当pH为7.5时,人参细胞脱氢酶活力达到最高,随后有轻微的下降。因此磷酸缓冲液缓冲范围适合人参细胞脱氢酶活力的测定。
TTC法测定人参细胞脱氢酶活力检测的反应温度维持在25℃~30℃。在其他条件一致的情况下,反应温度对脱氢酶活性测定结果影响明显,当温度低于4℃,有少量的TF生成,随后随着温度的升高,TF生成量明显增加,当温度为25℃时,吸光光度值和酶活力值均达到最大;当温度再上升时,脱氢酶反应受到影响,吸光光度值急剧下降。其原因可能在于随着温度的升高,一方面,酶促反应速度加快;另一方面,脱氢酶逐渐变性,导致酶活力降低,当达到酶的极限温度时,酶促反应将不能继续进行。
TTC-脱氢酶还原法测定活力时,样品反应体系内TF生成量随反应时间的延长而增加[20]。在一定时间内,随着时间的增加,吸光光度值和脱氢酶活力升高,当反应时间为18h时,吸光光度值不是最高值,但酶活力值却达到最高,接着反应时间继续延长,当反应时间为21h,吸光光度值达到最大值,但酶活力值处于下降的趋势。这是由于酶活力的大小不仅与TF生成量有关,也与细胞重量、反应时间有关。反应时间的再延长并没有使吸光光度值增加反而使其降低,这可能是由于在氧化还原作用下,破坏了TF的共轭体系[16]。
通过极差和方差分析得出,影响TTC-脱氢酶还原法的主次顺序为反应温度、反应时间、TTC溶液浓度、pH,反应温度对人参细胞活力影响达到极显著水平(P<0.01),反应时间对人参细胞活力影响达到显著水平(P<0.1)。这说明,这两个试验因素均是影响TTC-脱氢酶还原法测细胞活力的关键因素。
综上所述,TTC-脱氢酶还原法测定人参细胞活力的最佳组合为:ABC3D3,由于因子A、B可选任意水平,结合正交试验,可以选定最佳水平组合为A1B3C3D3(TTC溶液浓度0.4%、pH 7.5、反应温度25℃、反应时间18h)。本试验优化的人参细胞活力检测方法具有重复性好、操作方便等优点,为人参优良细胞筛选、超低温保存试验提供可靠的依据。
[1]刘华,梅兴国.TTC法测定红豆杉细胞活力[J].植物生理学通讯,2001,37(6):537-539.
[2]Iborra J L,Guardiola J,Montaner S,et al.2,3,5-Triphenyltetrazolium chloride as a viability assay for immobilized plant cells[J].Biotechnology techniques,1992,6(4):319-322.
[3]宋学之,陈青度,王东馥,等.林木种子脱氢酶活性的测定方法[J].植物生理学通讯,1981,31(5):38-40.
[4]Duncan D R,Widholm J M.Osmotic induced stimulation of the reduction of the viability dye 2,3,5-triphenyltetrazolium chloride by maize roots and callus cultures[J].Journal of plant physiology,2004,161(4):397-403.
[5]Steponkus P L,Lanphear F O.Refinement of the triphenyltetrazolium chloride method of determining cold injury[J].Plant Physiology,1967,42(10):1423-1426.
[6]简令成,孙德兰,孙龙华.甘蔗愈伤组织超低温保存中一些因素的研究[J].植物学报,1987,29(2):123-131.
[7]唐定台,杨志琦,山田康之.水稻原生质体产生细胞团的冰冻保存和冻后再生植株形成[J].植物学报,1988,30(4):357-361.
[8]李明军,洪森荣,徐鑫,等.怀山药种质资源的玻璃化法超低温保存[J].作物学报,2006,32(2):288-292.
[9]许建峰,刘传斌,方晓丹,等.高山红景天细胞悬浮培养中pH值对红景天甙胞外释放及细胞活性的影响[J].植物学报,1997,39(11):1022-1029.
[10]解军.脱氢酶活性测定水中活体藻含量的研究[D].济南:山东大学,2008.
[11]Klapwuk A,Drent J,Steenvoorden J.A modified procedure for the TTC-dehydrogenase test in activated-sludge[J].Water Research,1974,8(2):121-125.
[12]朱南文,闵航,陈美慈,等.TTC-脱氢酶测定方法的探讨[J].中国沼气,1996,14(2):3-5.
[13]杨天佑,田静,黄新,等.TTC-脱氢酶测定法表征低温真空环境对细菌呼吸活性的影响[J].食品与机械,2008,24(6):32-35.
[14]赵连梅,池勇志,张春青.TTC-脱氢酶活性测定中标准曲线的影响因素研究[J].实验室科学,2009,(4):72-74.
[15]Towill L E,Mazur P.Studies on the reduction of 2,3,5-triphenyltetrazolium chloride as a viability assay for plant tissue cultures[J].Canadian Journal of Botany,1975,53(11):1097-1102.
[16]黄春花,郑壮丽,梅彩英,等.蛹虫草TTC-脱氢酶测定方法的优化[J].环境昆虫学报,2011,33(3):321-328.
[17]梁文艳,王珂,阮清鸳,等.TTC-脱氢酶还原法测定铜绿微囊藻活性[J].环境科学学报,2008,28(9):1745-1750.
[18]贾蓉,易维洁,曲东.TTC法测定水稻土泥浆中脱氢酶活性的影响因素[J].西北农业学报,2012,21(4):154-158.
[19]Mersi W V,Schinner F.An improved and accurate method for determining the dehydrogenase activity of soils with iodonitrotetrazolium chloride[J].Biology & Fertility of Soils,1991,11(3):216-220.
[20]Nam B H,Jin H J,Kim S K,et al.Quantitative viability of seaweed tissues assessed with 2,3,5-triphenyltetrazolium chloride[J].Journal of Applied Phycology,1998,10(1):31-36.

