蚯蚓体内恩诺沙星残留的检测方法研究
丁丽玲,鲁晓旭,李银生,邱江平(上海交通大学农业与生物学院,上海200240)
蚯蚓体内恩诺沙星残留的检测方法研究
丁丽玲,鲁晓旭,李银生*,邱江平
(上海交通大学农业与生物学院,上海200240)
摘要:为进一步研究恩诺沙星对蚯蚓的生态毒理,建立了用荧光检测高效液相色谱法测定蚯蚓体内恩诺沙星残留量的检测方法。以0.1 mol·L-1磷酸液(pH12)+乙腈=1+3(V/V)作为提取液,脱脂,浓缩,再用流动相溶解。液相色谱条件:荧光检测器,激发波长280 nm,发射波长450nm。流动相:0.025 mol·L-1磷酸/三乙胺缓冲液(pH3.0)+乙腈=83+17(V/V)。恩诺沙星标准曲线范围5~500 ng·mL-1,对其进行3种浓度回收率测定,回收率在81%~88%之间,平均回收率为84.5%,变异系数10%以内,恩诺沙星的最低检出限为2 ng·g-1。对蚯蚓进行恩诺沙星滤纸染毒,浓度分别为0.16、1.6、16、32 μg·cm-2,每个浓度设置4个平行,对照为不加恩诺沙星的超纯水,48 h后检测各个浓度下蚯蚓体内恩诺沙星的平均含量分别为1.53、16.81、113.32、120.83 μg·g-1。可见,蚯蚓对外源恩诺沙星有较好的吸收,但当外源药物浓度达到一定程度后,对恩诺沙星的吸收量将不再无限制增加,且趋于稳定,验证了该测试方法是简单、快速、可行的。
关键词:恩诺沙星;蚯蚓;高效液相色谱法;回收率;滤纸染毒
丁丽玲,鲁晓旭,李银生,等.蚯蚓体内恩诺沙星残留的检测方法研究[J].农业环境科学学报, 2016, 35(2):403-408.
恩诺沙星(Enrofloxacin,EF)又名乙基环丙沙星,属于第三代氟喹诺酮类(Fluoroquinolones,FQs)合成抗菌药,是第一个动物专用的FQs药物。它具有抗菌谱广、杀菌力强、作用迅速、体内分布广、副作用小及与其他抗生素间无交叉耐药性等特点,广泛应用于畜牧、水产养殖业。有研究表明恩诺沙星进入动物体后,其原形及活性代谢产物会随排泄物排出体外。由于恩诺沙星是一种广谱抗生素,它进入到土壤环境后,可能对生态系统的结构和功能产生影响[1-3]。
药物残留对环境的影响是近年来国际上新兴的研究领域[4-5]。兽药残留已逐渐成为人们普遍关注的一个社会焦点。近年来,人们越来越关注药物通过人和动物的排泄物进入环境后,在环境中蓄积、迁移和转化,以及在食物链中逐渐浓缩,进而对各种生物和人类健康造成的潜在危害[6]。
蚯蚓作为土壤动物中最大的常见类群之一,是土壤可持续利用的关键生物种。蚯蚓对土壤系统有重要的生态作用,是生态系统的重要物质分解者,同时也是展开土壤污染生态风险评价的重要指示生物[7-8]。蚯蚓经常被作为载体对可能造成土壤环境污染的化学物质进行测试,并根据这些化学物质对蚯蚓的毒害程度来评价其对土壤生态系统可能的危害程度[7-10],故本文选取蚯蚓作为靶动物进行研究。
近年来,国内外对氟喹诺酮类药物的残留检测方法报道较多,有荧光分光光度法[11]、酶联法[12-13]、液相色谱法等,所测的靶动物不同,前处理和色谱测定条件也不相同[17-21]。但蚯蚓体内恩诺沙星的检测方法以及恩诺沙星对蚯蚓的影响尚未见报道。本文旨在建立一种简单、快速、可靠的检测恩诺沙星在蚯蚓体内残留量的方法,并运用所建立的检测方法进行了滤纸接触试验验证,结果表明该方法在蚯蚓体内恩诺沙星残留的实际检测中应用良好,为后续研究蚯蚓对恩诺沙星的吸收动力学以及毒理反应等奠定了基础。
1 材料与方法
1.1试验动物
赤子爱胜蚓(Eiseniafoetida),在适宜环境条件中预养一段时间,然后挑选体重为300~400 mg、环带明显且大小一致的健康成蚓进行试验。
1.2仪器和设备
高效液相色谱仪(附荧光检测器),美国Thermo,SURVERY PLUS;色谱柱Halo C18,4.6 mm×150 mm,2.7 μm;电子分析天平,梅特勒-托利多(METTLER TOLEDO),MX5;离心机,德国SIGMA,3K30;匀浆机,FLUKO,FA25;恒温水浴氮吹仪,上海启全仪器科技有限公司,PHC-12R;MX-S可调式漩涡混匀仪,美国SCILOGEX。
1.3试剂和溶液
恩诺沙星分析标准品(纯度100.0%)、恩诺沙星原粉(纯度≥98%),上海阿拉丁生化科技股份有限公司。乙腈为色谱纯;磷酸(≥85%)、正己烷、正丙醇、三乙胺、氢氧化钠、乙酸、无水乙醇等均为分析纯,国药集团化学试剂有限公司。试验用水为超纯水。
1.3.1 0.1 mol·L-1磷酸溶液(pH12)
吸取85%的磷酸6.8 mL,加超纯水稀释至1000 mL,滴加1 mol·L-1氢氧化钠溶液调pH至12。
1.3.2提取液
取0.1 mol·L-1磷酸溶液(pH12)100 mL,乙腈300 mL,充分混合,放置待溶液澄清后,过滤即得。
1.3.3流动相
0.025 mol·L-1磷酸/三乙胺缓冲液(pH3.0)+乙腈=83+17(V/V),超声脱气处理。0.025mol·L-1磷酸/三乙胺缓冲液(pH3.0):取85%磷酸1.7 mL,超纯水稀释至1000mL,用三乙胺调节pH至3.0,过0.22μm微孔滤膜。
1.4液相色谱条件
色谱柱见1.2所述;柱温25℃。荧光检测器检测波长:激发波长280 nm、发射波长450 nm。流动相流速300 μL·min-1。进样体积2 μL。
1.5标准曲线的绘制
1.5.1标准储备液
准确称取2.000 mg恩诺沙星标准品于10 mL棕色容量瓶中,以流动相溶解并定容,配制成200 μg· mL-1恩诺沙星标准储备液,于4℃避光保存。
1.5.2标准工作液
吸取990 μL流动相于1.5 mL棕色进样瓶中,加入10 μL标准储备液,漩涡混匀,制成2 μg·mL-1标准工作液。
1.5.3标准曲线各浓度工作液
用流动相将标准工作液分别稀释成10、20、50、100、250、500 ng·mL-1的系列工作液。
1.6蚯蚓体内恩诺沙星的提取
取蚯蚓三条,称重(约1.0 g),剪碎置于15 mL离心管中,按1:4(W:V)加入提取液4 mL,匀浆;匀浆液以4000 r·min-1离心10 min,收集上清液,残渣再用上述方法重复提取一次,合并两次上清液;加入4 mL正己烷,充分漩涡混匀,4000 r·min-1离心5 min;用注射器吸取下层清液于离心管中,加入2 mL正丙醇,于50℃水浴中以氮气吹干溶剂;用1 mL流动相溶解后转入1.5 mL离心管中4000 r·min-1离心5 min,取上清液过0.22 μm微孔膜,装入棕色进样瓶中,取2 μL进行HPLC分析。
1.7回收率及变异系数的测定
取蚯蚓三条,称重,剪碎,分别添加10、50、250μL的标准工作液(1.5.2),制得恩诺沙星浓度分别为20、100、500 ng·g-1的蚯蚓样品。每个浓度水平4个重复,按上述1.6的方法进行提取、脱脂、浓缩和进样分析。取恩诺沙星峰面积值(y)代入标准曲线回归直线方程中,得到回归后的恩诺沙星浓度(x)。计算相应浓度的平均回收率、相对标准偏差(RSD)及变异系数。
1.8滤纸接触法测定蚯蚓对恩诺沙星的吸收
(1)清肠:取直径15 cm的培养皿,在底部铺上2层滤纸,加适量水,以刚好浸没滤纸为宜。挑选具有环带、个体大小相似的健壮蚯蚓,用水清洗后用滤纸清除体表泥土杂物。放在滤纸上,用塑料薄膜封口,并用解剖针扎孔,然后放置于人工气候箱中清肠24 h。
(2)染毒:参照OECD标准化滤纸染毒法[14],在直径15 cm的培养皿底铺一层滤纸,以刚好铺满皿底为宜。将恩诺沙星用无水乙醇配成0.02、0.2、2、4 mg· mL-1系列浓度,对照组为不加恩诺沙星的无水乙醇。各取5.652 mL倒入培养皿中,刚好浸润滤纸,于暗室中挥发至干,然后逐一加入5.652 mL超纯水,使染毒组浓度分别为0.16、1.6、16、32 μg·cm-2。每个浓度设置4个重复。
(3)放入蚯蚓:将清肠后的蚯蚓冲洗干净并用滤纸吸干蚯蚓体表的水分,放入培养皿中。每个处理放入蚯蚓5条,用塑料薄膜封口,并用解剖针扎孔。
(4)培养:将培养皿放入人工气候箱中培养。箱中为标准实验条件:温度(20±1)℃,湿度75%±2%,光暗比为12 h/12 h[15]。
(5)检测:48 h后,每个重复各取3条大小、重量尽量相同的蚯蚓,清洗、吸干体表水分后,称重。然后按1.6的方法处理并进行HPLC分析。将恩诺沙星的峰面积(y)代入标准曲线回归方程中,计算出相应处理组蚯蚓体内恩诺沙星的含量(x)。
2 结果与讨论
2.1检测方法的确定以及色谱条件的优化
2.1.1样品前处理
在样品处理中,采用了匀浆、离心、脱脂、浓缩的提取过程[16,21]。从测定效果来看,达到了将恩诺沙星从样品中分离的目的,操作简单、方便。
2.1.2流动相的选择
在反相HPLC中,优化流动相的组成是控制保留时间和选择性最方便的方法。氟喹诺酮类药物具有可质子化的氮原子和可离解的羟基,在水溶液中通常以离子形式存在。选用适当离子对试剂有利于分离,该类药物的离子对流动相有四丁基溴化铵与磷酸、三乙胺与磷酸、乙酸铵与柠檬酸等[21]。已报道的氟喹诺酮类的各种HPLC分离方法的基本体系是C18/乙腈-甲醇-磷酸盐缓冲液。氟喹诺酮类药物是酸碱两性化合物,其解离状态和流动相中的溶解性在整个pH区域内随pH变动而增大或减小。根据Rogstad等[22]报道,恩诺沙星在酸性pH2.0~2.8范围内,显示荧光强度最大。综合考虑到恩诺沙星在酸性流动相中荧光强度较高和柱中填料对pH的耐受性,我们选择pH为3.0。本文采用了0.025 mol·L-1磷酸/三乙胺缓冲液(pH3.0)[18-21]。结果显示以0.025 mol·L-1磷酸/三乙胺缓冲液(pH3.0)+乙腈=83+17(V/V)作流动相体系分离效果较好,其基线平稳,色谱峰良好(图1中a曲线),且配制方便、快捷。
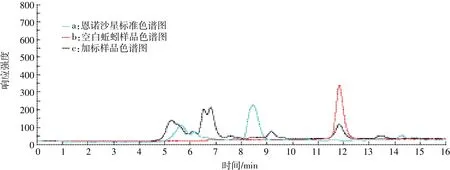
图1 恩诺沙星标准色谱图、空白蚯蚓样品和加标样品色谱图Figure 1 Chromatograms for enrofloxacin standard,blank and spiked samples
2.2蚯蚓样品中恩诺沙星的色谱行为
在1.4所设计的色谱条件下,HPLC基线平稳,恩诺沙星保留时间为11~12 min。蚯蚓样品中虽有杂峰出现,但无干扰峰,与药峰分离良好,见图1中b、c曲线(空白蚯蚓样品和加标样品的色谱图)。
2.3标准曲线
将绘制标准曲线用的工作液(1.5.3)依次从低浓度到高浓度,按照液相色谱条件(1.4)进行测定,每一浓度测定4次。按其所得峰面积的平均值和对应的标准溶液浓度作标准曲线图,见图2,并计算回归方程及相关系数。结果显示:恩诺沙星在10~500 ng·mL-1浓度范围内呈良好的线性关系,线性回归方程为:
y=0.105 1x+0.136 2,R2=0.999 7
在上述样品处理方法及色谱操作条件下,以信噪比S/N=3计,测得恩诺沙星的最低检出限为2 ng·g-1。

图2 恩诺沙星标准曲线图Figure 2 Standard curve for enrofloxacin
2.4回收率及变异系数
对恩诺沙星进行3种浓度回收率测定,结果见表1。平均回收率在81%~88%之间,总平均回收率为84.5%,总平均变异系数为3.46%。可见该检测方法的准确度与精密度良好。
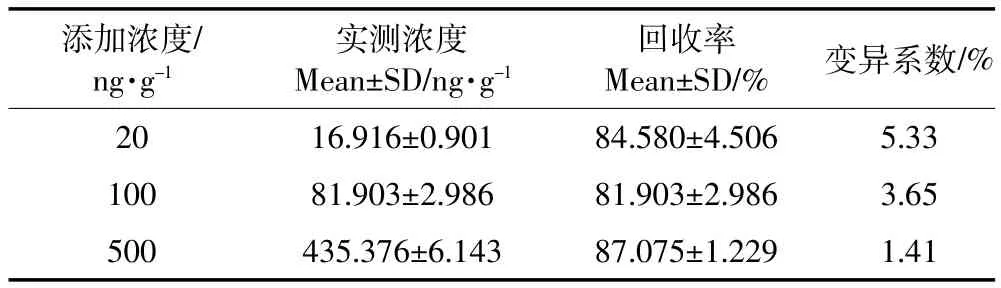
表1 恩诺沙星回收率测定结果(n=4)Table 1 Recovery percentages of enrofloxacin(n=4)
2.5滤纸接触法中恩诺沙星在蚯蚓体内的吸收情况
滤纸接触法是标准的蚯蚓生态毒理学测定方法之一,简便快捷,可用于快速判定毒物毒性的大小。实验过程中0.16 μg·cm-2与1.6 μg·cm-2浓度组以及对照组中蚯蚓的存活率约为100%,16 μg·cm-2浓度组蚯蚓的存活率为95%,32 μg·cm-2浓度组蚯蚓的存活率为85%。这说明滤纸接触法中恩诺沙星对蚯蚓的LC50远大于32 μg·cm-2,高于多种重金属或农药[23-25],说明恩诺沙星对蚯蚓是低毒的,符合一般规律。因为兽药可用于动物,毒性一般低于农药或重金属[15]。
滤纸染毒48 h后,蚯蚓体内的恩诺沙星吸收浓度见图3。由图3可知,当染毒浓度小于16 μg·cm-2时,蚯蚓体内恩诺沙星的吸收量随染毒浓度变化明显,染毒浓度越高,蚯蚓吸收越多。染毒浓度1.6 μg· cm-2的吸收量是0.16 μg·cm-2吸收量的11.0倍,16 μg·cm-2的吸收量是1.6 μg·cm-2吸收量的6.7倍。然而,随着浓度的继续升高,蚯蚓体内恩诺沙星的吸收量趋于稳定。32 μg·cm-2浓度组中蚯蚓对恩诺沙星的吸收量与16 μg·cm-2浓度组相比已没有显著差异(P<0.05)。滤纸接触法主要是通过体表接触吸收毒物,可见蚯蚓通过体表对外源恩诺沙星有着较好的吸收,且这种吸收具有一定的剂量-效应关系。当外源药物浓度达到一定程度后,其吸收量不再继续增加,而是趋于稳定。这为进行下一步慢性毒性试验和土壤染毒试验,进一步评价恩诺沙星的生态毒理提供了参考。

图3 滤纸染毒48 h后蚯蚓体内恩诺沙星的吸收量(平均值±标准差,n=4)Figure 3 Absorption of enrofloxacin by earthworms exposed to filter paper for 48 h(Mean±SD,n=4)
3 结论
本实验采用高效液相色谱法分析检测蚯蚓体内恩诺沙星的含量,对该方法的色谱条件进行了研究探索,最终确定采用Halo C18色谱柱,0.025 mol·L-1磷酸/三乙胺缓冲液(pH3.0)+乙腈=83+17(V/V)作为流动相,柱温为25℃,荧光检测器激发波长280 nm、发射波长450 nm,流动相流速300 μL·min-1,进样体积2 μL。在该实验条件下所测得的样品有良好的分离度,并通过最低检出限和加标回收率的检测,验证了该方法的稳定性和准确性。恩诺沙星的最低检出限为2 ng·mL-1。标准曲线线性范围为10~500 ng·mL-1,线性相关系数为0.999 7。在加标回收率检测中平均回收率为84.5%,平均变异系数为3.46%。
将建立的方法实际应用于滤纸接触法中蚯蚓对恩诺沙星的吸收测定。结果表明,蚯蚓对外源恩诺沙星有着较好的吸收,但当外源药物浓度到达一定程度后,吸收量不再无限制增加,而是趋于稳定。本文建立的测试方法为进一步进行恩诺沙星对蚯蚓的生态毒理研究奠定了基础,滤纸接触吸收试验的结果验证了该检测方法的可行性,也为相关试验提供了参考。
参考文献:
[1]王加龙,刘坚真,陈杖榴,等.恩诺沙星对土壤微生物数量及群落功能多样性的影响[J].应用与环境生物学报, 2005, 11(1):86-89. WANG Jia-long, LIU Jian-zhen, CHEN Zhang-liu, et al. Effects of enrofloxacin residue on number and community function diversity of soil microbes[J]. Chinese Journal of Applied and Environmental Biology, 2005, 11(1):86-89.
[2]王丽平,章明奎,郑顺安.土壤中恩诺沙星的吸附-解吸特性和生物学效应[J].土壤通报, 2008, 39(2):393-397. WANG Li-ping, ZHANG Ming-kui, ZHENG Shun-an. Adsorptiondesorption characteristics and biological effects of enrofloxacin in soil [J]. Chinese Journal of Soil Science, 2008, 39(2):393-397.
[3]马驿,陈杖榴.恩诺沙星残留对土壤细菌种群基因多样性的影响[J].应用生态学报, 2009, 20(4):949-954. MA Yi, CHEN Zhang-liu. Effects of enrofloxacin on DNA sequence diversity of soil cultural bacterial community[J]. Chinese Journal of Applied Ecology, 2009, 20(4):949-954.
[4] Velagaleti R, Burns P K, Gill M, et al. Impact of current good manufacturing practices and emission regulations and guidances on the discharge of pharmaceutical chemicals into the environment from manufacturing, use , and disposal[J]. Environ Health Perspect, 2002, 110(3):213-332.
[5] Fink-Gremmels J, van Miert A S. Veterinary drugs:Disposition, biotransformation and risk evaluation[J]. Analyst, 1994, 119(12):2521-2528.
[6]张绪美,董元华,王辉,等.中国畜禽养殖结构及其粪便N污染负荷特征分析[J].环境科学, 2007, 28(6):1311-1318. ZHANG Xu-mei, DONG Yuan-hua, WANG Hui, et al. Structure of livestock and variation of fecal nitrogen pollution load in China[J]. Environmental Science, 2007, 28(6):1311-1318.
[7] Eijsackers H. Earthworms in environmental research[M]//Edwards C A. Earthworms ecology. Boca Raton:CRC Press, 2004:321-342.
[8]高岩,骆永明.蚯蚓对土壤污染的指示作用及其强化修复的潜力[J].土壤学报, 2005, 42(1):140-147. GAO Yan, LUO Yong-ming. The effect of earthworms on soil pollution and the potential of enhanced remediation[J]. Acta Pedologica Sinica, 2005, 42(1):140-147.
[9]颜增光,何巧力,李发生.蚯蚓生态毒理试验在土壤污染风险评价中的应用[J].环境科学研究, 2007, 20(1):134-142. YAN Zeng-guang, HE Qiao-li, LI Fa-sheng. The use of earthworm ecotoxicologicaltest in risk assessment of soil contamination[J]. Research of Environmental Sciences, 2007, 20(1):134-142.
[10]邱江平.蚯蚓与环境保护[J].贵州科学, 2000, 18(1/2):116-133. QIU Jiang-ping. Earthworms and environmental protection[J]. Guizhou Science, 2000, 18(1/2):116-133.
[11]席会平,董学芝,胡卫平,等.表面活性剂增敏荧光光度法快速测定残留牛奶中的环丙沙星[J].中国抗生素杂志, 2006, 31(5):285-286. XI Hui-ping, DONG Xue-zhi, HU Wei-ping, et al. Surfactant sensitized fluorimetric determination of ciprofloxacin residue in milk[J]. Chinese Journal of Antibiotics, 2006, 31(5):285-286.
[12]姜利英,谢小品,崔光照,等.动物性食品中喹诺酮类药物残留检测方法的研究进展[J].郑州轻工业学院学报(自然科学版), 2008, 23 (4):1-5. JIANG Li -ying, XIE Xiao -pin, CUI Guang -zhao, et al. Research progress of detection method for quinolones residues in edible animalproducts[J]. Journal of Zhengzhou University of Light Industry(Natural Science), 2008, 23(4):1-5.
[13]魏东,杨正涛,李颖,等.氟喹诺酮类药物残留免疫学检测方法的研究[J].中国兽医学报, 2009, 29(12):1593-1598. WEI Dong, YANG Zheng-tao, LI Ying, et al. Immunoassay method of detecting the residues of fluoroquinolones[J]. Chinese Journal of Veterinary Science, 2009, 29(12):1593-1598.
[14] OECD. OECD Guideline for Testing of Chemicals, No. 207:Earthworm, acute toxicity tests [S]. Paris:OECD, 1984.
[15]李银生,曾振灵,邱江平,等.洛克沙胂对蚯蚓的急性毒性试验[J].上海交通大学学报, 2004, 22(2):115-119. LI Yin-sheng, ZENG Zhen-ling, QIU Jiang-ping, et al. Acute toxicity of veterinary pharmaceutical-roxarsone to earthworms[J]. Journal of Shanghai Jiaotong University, 2004, 22(2):115-119.
[16]中华人民共和国农业部. 1025号公告-14-2008动物性食品中氟喹诺酮类药物残留检测,高效液相色谱法[S]. Ministry of Agriculture of the People's Republic of China. 1025 -14-2008 Determination of fluoroquinolonesresidues in animal food, High performance liquid chromatography[S].
[17]肖静,赵健亚,刘晓俊,等.高效液相色谱法测定鸡肉中恩诺沙星和环丙沙星残留的不确定分析[J].食品工业科技, 2012, 33(18):75-78. XIAO Jing, ZHAO Jian-ya, LIU Xiao-jun, et al. Uncertainty evaluation for determining enrofloxacin and ciprofloxacin residues in chicken byhigh performance liquid chromatography[J]. Science and Technology of Food Industry, 2012, 33(18):75-78.
[18]刘丽贞,周婉苹,薛冰.高效液相色谱-荧光检测法同时测定鱼肉组织中的诺氟沙星,环丙沙星和恩诺沙星残留[J].中国卫生检验杂志, 2008, 18(7):1296-1307. LIU Li-zheng, ZHOU Wan-ping, XUE Bing. Simultaneous determination of norfloxacin, ciprofloxacin and enrofloxacin in fish tissue using high performance liquid chromatography with fluorescence detection[J]. Chinese Journal of Health Laboratory Technology, 2008, 18(7):1296-1307.
[19]仲锋.恩诺沙星,环丙沙星在鸡组织中残留量的检测方法研究[J].中国兽药杂志, 1999, 33(4):5-8. ZHONG Feng. Studies on detection method of enrofloxacin and ciprofloxacin residues in chicken tissues[J]. Chinese Journal of Veterinary Drug, 1999, 33(4):5-8.
[20]郑宗林,唐俊,喻文娟,等. RP-HPLC法测定中华绒螯蟹主要组织中的恩诺沙星及其代谢产物[J].上海水产大学学报, 2006, 15 (2):156-162. ZHENG Zong-lin, TANG Jun, YU Wen-juan, et al. Development of RP-HPLC for determination of enrofloxacin and its metabolite in tissues of Chinese mitten-handedcrab(Eriocheirsinensis)by RP-HPLC [J]. Journal of Shanghai Fisheries University, 2006, 15(2):156-162.
[21]高华鹏,李佐卿.高效液相色谱法检测冷冻烤鳗中恩诺沙星等药物残留[J].理化检验:化学分册, 2005, 41(5):331-333. GAO Hua -peng, LI Zuo -qing. HPLC method for the detection of residual medicine of enrofloxacin and relatives in frozen ell[J]. Physical Testing and Chemical Analysis Part B Chemical Analysis, 2005, 41 (5):331-333.
[22] Rogstad A, Hormazabal V, Yndestad M. Extraction and high performance liquid chromatographic determination of enrofloxacin in fish serum and tissues[J]. Journal of Liquid Chromatography, 1991, 14(3):521-531.
[23]吴声敢,王彦华,吴长兴,等. 6种重金属对赤子爱胜蚓的急性毒性效应与风险评价[J].生物安全学报, 2012, 21(3):221-228. WU Sheng-gan, WANG Yan-hua, WU Chang-xing, et al. Acute toxicological effects and risk assessment of six heavy metals on the earthworm, Eiseniafoetida[J]. Journal of Biosafety, 2012, 21(3):221-228.
[24]赵学平,王彦华,吴声敢,等. 10种常用农药对赤子爱胜蚓(Eiseniafoetida)的急性毒性效应[J].生态毒理学报, 2011, 6(4):435-440. ZHAO Xue-ping, WANG Yan-hua, WU Sheng-gan, et al. Acute toxic effect of ten commonly used pesticides on earthworm(Eiseniafoetida)[J]. Asian Journal of Ecotoxicology, 2011, 6(4):435-440.
[25]左海根,林玉锁,龚瑞忠.农药污染对蚯蚓毒性毒理研究进展[J].农村生态环境, 2004, 20(4):1-5. ZUO Hai-gen, LIN Yu-suo, GONG Rui-zhong. Toxicology of pesticide pollution to earthworms[J]. Rural Eco-environment, 2004, 20(4):1-5.
DING Li-ling, LU Xiao-xu, LI Yin-sheng, et al. A detection method for enrofloxacin residues in earthworms[J]. Journal of Agro-Environment Science, 2016, 35(2):403-408.
A detection method for enrofloxacin residues in earthworms
DING Li-ling, LU Xiao-xu, LI Yin-sheng*, QIU Jiang-ping
(Department of Agriculture and Biology, Shanghai Jiaotong University, Shanghai 200240, China)
Abstract:An assay method using high performance liquid chromatography(HPLC)with fluorescence detection was established to quantify enrofloxacin residues in earthworms. The extraction solution comprised 0.1 mol·L-1phosphoric acid(pH12)+ acetonitrile(1+3,V/V). The initial extracts were defatted, evaporated, and re-dissolved in mobile phase consisting of 0.025 mol·L-1phosphoric acid/triethylamine buffer (pH3.0)+ acetonitrile(83+17,V/V). The fluorescence detector excitation wavelength was 280 nm, and the emission wavelength 450 nm. The linear range of the standard curve was 5~500 ng·mL-1. The recoveries of 3 concentration groups were between 81% and 88% with an average of 84.5% and the coefficient of variation was less than 10%. The detection limit of enrofloxacin was 2 ng·g-1. Earthworms were exposed to filter papers soaked in enrofloxacin with concentrations of 0, 0.16, 1.6, 16 μg·g-1and 32 μg·cm-2, and 4 replicates in each case. After 48 hours of exposure, the average enrofloxacin concentration in earthworms was 0, 1.53, 16.81, 113.32 μg·g-1and 120.83 μg·g-1, respectively. These results show that the absorption of enrofloxacin by earthworms increased linearly up to 1.6 μg·cm-2exposure concentration, and then asymptotically to a maximum of approximately 120 μg enrofloxacin·g-1earthworm tissue.
Keywords:enrofloxacin; earthworm; HPLC; recovery rate; filter paper exposure
*通信作者:李银生E-mail:yinshengli@sjtu.edu.cn
作者简介:丁丽玲(1991—),女,浙江绍兴人,硕士研究生,研究方向为生态毒理。E-mail:987530144@qq.com
基金项目:国家自然科学基金项目(31172360)
收稿日期:2015-09-20
中图分类号:X503.22
文献标志码:A
文章编号:1672-2043(2016)02-0403-06
doi:10.11654/jaes.2016.02.027

