额尔敦-乌日勒对MCAO/R大鼠脑前额叶皮质BDNF及NGF表达的影响*
莲 花,麻春杰,呼日乐巴根,李 超,田海广,肖志彬
(1.内蒙古医科大学蒙医药学院 呼和浩特 010110;2.内蒙古医科大学中医学院 呼和浩特 010110;3.内蒙古医科大学图书馆 呼和浩特 010110)
额尔敦-乌日勒对MCAO/R大鼠脑前额叶皮质BDNF及NGF表达的影响*
莲 花1,麻春杰2**,呼日乐巴根1,李 超2,田海广2,肖志彬3
(1.内蒙古医科大学蒙医药学院 呼和浩特 010110;2.内蒙古医科大学中医学院 呼和浩特 010110;3.内蒙古医科大学图书馆 呼和浩特 010110)
目的:探讨额尔敦-乌日勒对大脑中动脉阻塞/再灌注损伤(Middle Cerebral Artery Occlusion /Reperfusion,MCAO/R)大鼠皮质脑源性神经营养因子(Brain-Derived Neurotrophic Factor,BDNF)及神经生长因子(Nerve Growth Factor,NGF)的影响。方法:取清洁级健康SD大鼠60只,随机分为假手术组、模型组、尼莫地平片组、额尔顿-乌日勒组,采用改良Zea-Longa法,制备MCAO/R模型。实验结束后,各组大鼠麻醉、取脑,采用HE染色、SP等免疫组化方法评价脑组织病理形态学的改变情况,并且采用双抗夹心ELISA 法和荧光定量RT-PCR法检测大鼠脑前额叶皮质BDNF mRNA、NGF mRNA相对表达量及其蛋白含量。结果:与模型组相比,额尔敦-乌日勒组大鼠脑前额叶皮质坏死细胞数显著减少(P<0.05),BDNF、NGF蛋白含量及mRNA表达明显增加(P<0.05)。结论:额尔敦-乌日勒可上调MCAO/R大鼠脑前额叶皮质BDNF、NGF表达,促进星形胶质细胞活化,从而保护神经元,进而起到脑保护作用,这可能是额尔敦-乌日勒治疗“白脉”病的传统功效机制之一。
额尔敦-乌日勒 MCAO/R模型大鼠 脑源性神经营养因子 神经生长因子
缺血性脑卒中(Ischemic Cerebral Stroke,ICS)是卒中最常见的疾病类型。近年来研究证实,发病率呈现上升趋势,致残率、致死率大约为80%,是一种突然起病的脑部血液循环障碍性疾病,给患者家庭及社会都带来巨大的精神与经济压力。目前以溶栓法治疗恢复缺血脑细胞、组织血液灌流,可挽救濒临死亡的脑细胞,但血流再灌注在某些情况下会进一步导致细胞、组织损伤和功能障碍,造成脑缺血再灌注损伤(Cerebral Ischemia Reperfusion Injury,CIRI)。CIRI是由于血流再灌注后引起的继发性损伤,是目前最受关注的问题之一。本课题组前期研究[1]发现:额尔敦-乌日勒能显著改善缺血性脑损伤大鼠的神经行为学功能,并减轻脑水肿,减小缺血再灌注脑梗塞范围,表明额尔敦-乌日勒对局灶性脑缺血再灌注损伤有较好的保护作用。本研究探讨额尔敦-乌日勒对MCAO/R大鼠脑前额叶皮质BDNF及NGF表达的影响,阐明额尔敦-乌日勒发挥神经保护作用的可能机制。
1 材料
1.1 动物
SPF级健康SD大鼠60只,雄性,约10周龄,体质量250-300 g,由中国人民解放军军事医学科学院实验动物中心提供许可证号:SCXK(军)2012-0004。普通饲料由内蒙古医科大学实验动物中心提供。
1.2 药物与试剂
额尔敦-乌日勒(内蒙古蒙药股份有限公司,批号:100336)蒸馏水溶解;银杏叶片(涿州动乐制药有限公司,批号:Z20028025)蒸馏水溶解;尼莫地平片(山西亚宝药业集团股份有限公司,批号:H1402282)蒸馏水溶解;水合氯醛(天津市福晨化学试剂厂,批号:MB1699);脑源性神经营养因子(BDNF)、神经生长因子(NGF)一抗、二抗试剂盒(北京博奥森生物技术有限公司,型号:SP0022);DAB显色剂、枸橼酸盐H6.0及PBS缓冲液pH7.2-7.6(武汉博士德有限公司,型号分别为:AR1022、AR0024及AR0030);ELISA试剂盒(武汉博士德生物工程有限公司);Trizol试剂盒(美国 invitrogen,货号:15596026,批号:47303);M-MLV反转录(日本Takara公司,货号:D2639A,批号:CK3401A);Oligd(T)(日本Takara公司,货号:D511,批号:CT2901F);dNTP(日本Takara公司,货号:D4030RA,批号:CB3301A);DNA Marker(日本Takara公司,货号:D525S,批号:B501A);SYBR mix(美国ABI,货号:4472908,批号:1209004);Agarose(美国Promega公司);DEPC(美国Sigma公司);100bp DNA Ladder(北京全式金生物技术有限公司);Real-time PCR扩增试剂盒(北京中原领先科技有限公司)。
1.3 实验仪器
栓线(北京沙东生物技术有限公司),CV-2000型高频电凝刀(北京康威电子技术有限公司);ASP200S型脱水机、EG1150H型包埋机(德国LEICA公司);B1SERIES型生物显微镜(德国Motic厂家);MR23i型台式高速低温离心机、FINESSE325型切片机(美国Thermo公司);ABI7500型实时荧光定量PCR仪(美国ABI公司);Biophotometer型紫外分光光度仪、5417C型台式高速常温离心机、Reference型微量加样器(德国eppendorf公司);HB-202型恒温金属浴(北京中西远大有限公司);SIM-F124型制冰机(日本SANYO电机公司);GelDoc2000型凝胶成像系统、稳压稳流电泳仪(美国伯乐Bio-rad公司);BINTA2020D型全自动凝胶成像系统(北京宾达英创科技有限公司)。
2 方法
2.1 动物分组与处理
取清洁级健康SD大鼠60只,适应性饲养1周后,随机分为假手术组(I组)、模型组(II组)、尼莫地平片组(III组)、额尔顿-乌日勒组(IV组),每组15只,采用改良Zea-Longa法,制备MCAO/R模型。假手术组与模型组分别灌胃蒸馏水,阳性对照组每日给予尼莫地平片0.62 mg·kg-1,治疗组每日给予额尔敦-乌日勒6.2 mg·kg-1,连续给药14 d。所有实验大鼠均单笼饲养,限食量,每大鼠每日30 g,自由饮水。实验结束后,每组随机选取5只大鼠用10%水合氯醛麻醉,快速取脑,称重,将与脑组织相连的硬脑膜剥离切断延髓,弃去奥球、小脑和低位脑干后,将视交叉平面前后2-5 mm处冠状切开大脑,留取中间部分置4 ℃ 4%多聚甲醛溶液中固定24 h,剃度酒精常规脱水,二甲苯透明,浸石蜡包埋,切片。HE染色切片3 μm厚,隔5取1贴于载玻片上,进行HE和SP染色,光镜下观察大鼠脑组织形态。每组剩余10只大鼠用10 %水合氯醛0.35 mL/100g麻醉,快速取脑,称重,剥离硬脑膜,切断延髓,弃去嗅球、小脑和低位脑干后,用冰生理盐水冲净脑组织表面的血液,在冰盘上快速剥离缺血侧脑皮质,称重,并将缺血侧半球脑皮质分为两部分,分别迅速精确称量,用液氮迅速冷冻,然后转移到-80 ℃冰箱中保存备用。
2.2 实验指标
2.2.1 各组大鼠脑组织病理学
取各组鼠脑切片行常规HE染色。石蜡切片(3 μm)→常规脱蜡至水→去氧化层→上行逐级脱水→中性树胶封片→光学显微镜观察。
2.2.2 各组大鼠脑组织BDNF、NGF免疫组化染色
操作步骤:石蜡切片(3 μm)→常规脱蜡至水→0.01 mol·L-1PBS浸泡5 min→抗原修复→3 % H2O215 min→滴加A室温15 min→倾去液体,吸去切片和组织周围液体,勿洗→稀释后的兔抗大鼠一抗(1:150)4 ℃ 1 h→0.01 mol·L-1PBS浸泡3×3 min→滴加B室温孵育15 min→0.01 mol·L-1PBS浸泡3× 3 min→滴加C室温孵育15 min→0.01 mol·L-1PBS浸泡3×3 min→DAB显色→自来水冲3 min,终止显色→苏木素复染3 min→水洗3 min→盐酸乙醇分化10 s →水洗3 min→1%伊红染液浸染2 s→上行逐级脱水→中性树胶封片→光学显微镜观察。
细胞计数及统计:在相同的光亮强度,分别于10倍目镜×4、20、40倍物镜下,用图像分析仪对免疫阳性细胞进行细胞计数。每只大鼠取6张脑片,每张大鼠脑缺血部位切片随机取6个视野,求其算术平均值,结果±S表示,并用分组t检验法进行检验各组细胞数量差异。
2.2.3 脑前额叶皮质BDNF及NGF的含量
取冻存的脑前额叶皮质,保持2-8℃的温度融化,加入一定量的PBS(pH7.4),手工法将组织充分匀浆化,3 000-4 000 r·min-1离心15 min左右,轻轻吸取上清液分装后,按BDNF及NGF试剂盒说明书,采用双抗夹心ELISA法检测各组大鼠皮质BDNF及NGF的含量,其余冷冻备用。
2.2.4 脑前额叶皮质BDNF mRNA及NGF mRNA的表达
取冻存的脑前额叶皮质,放入预冷的研钵中加入液氮进行快速研磨,采用RNA提取试剂盒常规提取出总RNA,于-80 ℃保存。用核酸紫外分光光度计测定经稀释的RNA提取物的OD值和浓度,判断RNA纯度,计算RNA浓度。采用25 μL反转录体系合成cDNA。反应条件:42 ℃反应60 min,70 ℃灭活 10 min。取反转录后产物cDNA作为模板进行PCR扩增。扩增以磷酸甘油醛脱氢酶(Glyceraldehydephosphate Dehydrogenase,GAPDH)基因mRNA作为内参照,引物序列由上海生工生物工程有限公司合成。BDNF的上游引物序列为5'-CTGGATGAGGACCAGAAGGT-3’,下游引物序列为5'-CAGAAAGAGCAGAGGAGGCT-3’,扩增产物长度为117 bp;NGF的上游引物序列为5'-CACTCTGAGGTGCATAGCGT-3’,下游引物序列为5'-GCTTCAGGGACAGAGTCTCC-3’,扩增产物长度为125 bp;GAPDH的上游引物序列为5'-GGCATGGACTGTGGTCATGA-3',下游引物序列为5'-GAGCCAAGACACCTCAAACTC-3',扩增产物长度为128 bp。Real-Time PCR反应体系为20 μL,含SYBR Premix Ex TaqTM (2×)10 μL,PCR Forward primer(10 pmoL·μL-1)0.5 μL,PCR Reverse primer(10 pmoL·μL-1)0.5 μL,cDNA模板2.0 μL,ddH2O 8.0 μL反应条件:94 ℃预变性2 min,然后45次循环,每次循环条件为94 ℃变性15 s,60 ℃退火,延伸60 s。每个样本重复3次。利用RT-PCR 仪数据分析软件(7500 System SDS Software)得出BDNF及NGF的CT值。
2.3 统计学方法
3 结果
3.1 大鼠脑组织形态学变化
假手术组脑前额叶皮质细胞层次清晰,排列紧密而有序,细胞结构、形态正常,神经细胞胞浆、核染色均匀,核仁清楚,核膜完整,间质内未见出血、坏死、水肿;模型组:左侧大脑缺血范围内可见皮质及纹状体有片状坏死,细胞排列松散,形态不规则,少量神经元残存,神经细胞与细胞周围间质分离,细胞深染固缩,胞浆尼氏体消失,胞核固缩,核仁消失。额尔敦-乌日勒组及阳性对照组大鼠脑组织病理改变减轻,有所减轻细胞水肿情况,但可见细胞变性、坏死,细胞排列较紊乱,胞核模糊或不可见。结果参见图1。
3.2 大鼠脑前额叶皮质BDNF、NGF免疫组化染色
实验结果显示,与假手术组相比,模型组大鼠皮质BDNF、NGF阳性细胞数较多,差异具有统计学意义(P<0.05);与模型组相比,尼莫地平片组大鼠皮质BDNF阳性细胞数明显增多,额尔敦-乌日勒组大鼠皮质BDNF、NGF阳性细胞数明显增多,差异具有统计学意义(P<0.05),其作用与尼莫地平片组相当。结果见表1、图2-图4。

图1 各组大鼠脑切片HE染色(×400倍)
表1 各组大鼠脑前额叶皮质BDNF、NGF阳性细胞数的比较(±s, n=10)

表1 各组大鼠脑前额叶皮质BDNF、NGF阳性细胞数的比较(±s, n=10)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05。
50.66±3.93 65.66±6.91组别剂量/mg·kg-1BDNF NGF I -II -58.50±5.85*71.50±4.08*III 0.62 66.33±5.64*#77.50±5.08*IV 6.20 75.16±4.35*#95.16±4.95*#

图2 各组大鼠脑前额叶皮质BDNF、NGF阳性细胞数的比较
3.3 大鼠脑前额叶皮质BDNF、NGF的含量情况
采用双抗夹心ELISA法检测大鼠脑前额叶皮质BDNF、NGF含量的影响。实验结果显示,与假手术组相比,模型组大鼠皮质BDNF、NGF蛋白含量较高,差异具有统计学意义(P<0.05);与模型组相比,尼莫地平片组与额尔敦-乌日勒组大鼠皮质BDNF、NGF蛋白含量明显增加,差异具有统计学意义(P<0.05)。结果见表2、图5。
3.4 大鼠脑前额叶皮质BDNF mRNA、NGF mRNA的表达情况
采用RT-PCR法检测大鼠脑前额叶皮质BDNF mRNA、NGF mRNA表达的影响,RT-PCR结果显示,与假手术组相比,其他组大鼠脑前额叶皮质BDNF mRNA、NGF mRNA表达普遍增高(P<0.05),额尔敦-乌日勒组的分别是假手术组的3.43、2.49倍,尼莫地平片组的是假手术组的1.44、1.42倍,模型组是假手术组的1.27、1.30倍,额尔敦-乌日勒组明显高于模型组(P<0.05)。结果见表3、图6。
4 讨论

图3 各组大鼠脑前额叶皮质BDNF免疫组化染色(×400倍)
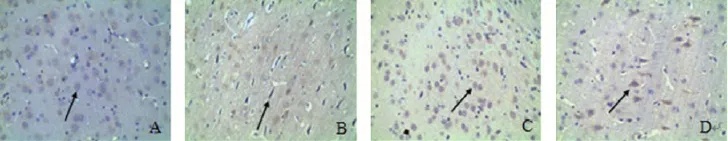
图4 各组大鼠脑前额叶皮质NGF免疫组化染色(×400倍)
据文献报道,局灶性缺血损伤后,BDNF、NGF表达都开始上调,在不同的过程参与调节神经再生。并明显促进缺血后神经元的存活和生长发育并能够防止他们受损死亡,改善神经元的病理状态,促进受损神经元再生及分化成熟,在中枢神经系统(Central Nervous System,CNS)损伤修复中具有重要作用。但由于神经营养因子(Neurotrophic Factor,NTFS)多为大分子肽,难以通过血脑屏障,因此外周给药难以达到作用部位。而脑内给药又会加重缺血损伤,且操作复杂。所以,充分诱导内源性NTFs 的表达,可能是治疗缺血神经元损伤的重要途径。BDNF和NGF由神经元和神经元支配的靶器官或星形胶质细胞产生,具有多种生物活性。脑缺血后,脑神经细胞的损伤程度与BDNF和NGF的表达含量密切相关[3,4]。由靶区(海马及皮质)产生的NGF 可经逆行运输到中枢神经系统基底前脑胆碱能神经元胞体,发挥其靶源性营养作用。缺血再灌注损伤的轻重与BDNF mRNA 表达的含量有相关性,损伤过重反而抑制其表达。Lee等[5]发现缺血1周后可见年轻大鼠海马CA 区和皮层内BDNF蛋白的免疫活性明显增加,但mRNA 变化不明显。这种蛋白含量和mRNA含量不一致的现象,出现在海马的CA1 区和齿状回之间。缺血再灌注过程可明显提高大鼠海马部位BDNF mRNA表达含量。小强度跑台运动可在缺血再灌注作用的基础上进一步提高海马部位BDNF mRNA含量[6]。李娜等[7]发现缺血组随着脑缺血再灌注时间的延长,在大脑梗死周边区皮质中BDNF阳性神经元表达呈规律性变化,于脑缺血再灌注3 h表达开始增加,至24 h达高峰,之后开始下降,但直至7 d,其表达仍高于假手术组。成体大鼠短暂局灶性脑缺血后,BDNF和GDNF的表达都开始增加。Liu Xing-Long等[8]发现ADSCs(脂肪间充质干细)通过提升NTFs的表达,促进损伤后神经修复,而抑制神经细胞的凋亡。Srinivas Madduri等[9]发现在前3天,胶原蛋白神经导管释放2%的NGF,在第14天显著增强早期神经再生的轴突和施旺细胞迁移产物;与靶向器官有关的许多协同作用的NTFs具有增强早期轴突再生作用。Yang Ke-hong等[10]发现三七皂苷-Rg1可以上调大鼠大脑皮层BDNF mRNA表达,促进脑内BDNF蛋白。三七皂苷-Rg1可以治疗脑缺血损伤。Hamed Fanaei等[11]发现在10天内,睾酮明显增强脑缺血大鼠抗氧化,提高BDNF水平和和细胞增殖,并恢复感觉运动。Phatcharida Kaengkan等[12]发现齐拉西酮、齐拉西酮+NPCs(神经祖细胞)能诱导BDNF mRNA、NGF mRNA表达。齐拉西酮和NPCs联合治疗局灶性脑缺血具有增强缺血性脑损伤的神经保护作用。Zhang等[13]发现川陈皮苷可能通过激活BDNF活性,而保护大脑缺血性损伤。Gyeyeop等[14]发现先前跑步机锻炼能加强运动能力和BDNF表达水平,并达到脑缺血损伤具有保护神经作用。前期适当强度的跑步机锻炼对中风后期康复至关重要。Shih等[15]发现低强度的运动能增强脑缺血大鼠海马BDNF表达水平,改善突触可塑性。其本实验结果表明,额尔敦-乌日勒可能通过上调BDNF、NGF蛋白含量及mRNA相对表达量,发挥其靶源性神经营养作用和保护作用,进而达到保护或修复受损神经元,抑制脑缺血损伤的作用。额尔敦-乌日勒可上调MCAO/R大鼠脑前额叶皮质BDNF、NG表达,促进星形胶质细胞活化,从而保护神经元,进而起到脑保护作用,这可能是额尔敦-乌日勒治疗“白脉”病的传统功效机制之一。
表2 各组大鼠脑前额叶皮质BDNF、NGF含量的影响(±s,n=10)
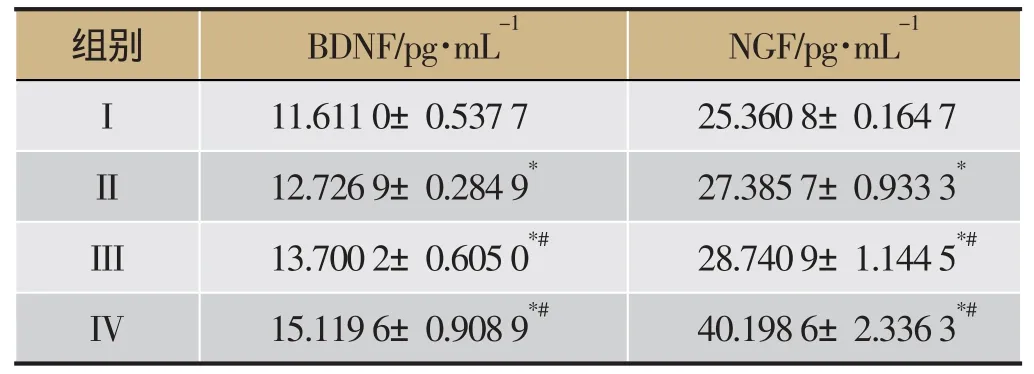
表2 各组大鼠脑前额叶皮质BDNF、NGF含量的影响(±s,n=10)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05。
组别BDNF/pg·mL-1NGF/pg·mL-1I 11.611 0±0.537 7 25.360 8±0.164 7 II 12.726 9±0.284 9*27.385 7±0.933 3*III 13.700 2±0.605 0*#28.740 9±1.144 5*#IV15.1196±0.9089*#40.1986±2.3363*#
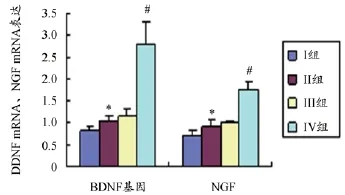
图5 各组大鼠脑前额叶皮质BDNF、NGF含量的影响
表3 各组大鼠脑前额叶皮质BDNF mRNA、NGF mRNA表达的影响(±s,n=10)

表3 各组大鼠脑前额叶皮质BDNF mRNA、NGF mRNA表达的影响(±s,n=10)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05。
组别BDNF NGF I 0.812 1±0.115 0 0.712 0±0.101 3 II 1.035 3±0.131 3*0.925 6±0.142 0*III 1.168 5±0.153 0*1.008 4±0.033 9*IV 2.784 8±0.537 2*#1.773 1±0.169 7*#

图6 各组大鼠脑前额叶皮质BDNF mRNA、NGF mRNA表达的影响
1 莲花,那生桑,麻春杰,等.额尔敦-乌日勒对大脑中动脉阻塞再灌注损伤大鼠的治疗作用研究.中国中医急症. 2014, 23(3): 394-396.
2 胡跃强,唐农,刘泰,等.大鼠局灶性脑缺血再灌注后BDNF mRNA 及其蛋白的表达变化.中风与神经疾病. 2011, 28(3): 220-222.
3 Hsu C Y, An G, Liu J S, et al. Expression of immediate early gene and growth factor mRNAs in a focal cerebral ischemia model in the rat. Stroke, 1993; 24(12): 178-181.
4 周少丞,韩晓明,王力冬,等.D-半乳糖致衰老模型大鼠脑组织Ach 活性、NGF 表达变化及山茱萸多糖的干预作用.中国老年学杂志, 2011, 31(24): 4841-4842.
5 Lee T H, Yang J T, Kato H, et al. Expression of brain-derived neurotrophic factor immunoreactivity and mRNA in the hippocampal CA1 and cortical areas after chronic ischemia in rats. J Neurosci Res, 2004, 76(5): 705-712.
6 Lee T H, Kato H, Chen S T, et al. Expression disparity of brainderived neurotrophic factor immunoreactivity and mRNA in ischemic hippocampal neurons. Neuroreport, 2002, 13(17): 2271-2275.
7 李娜,李世英,夏静,等.亚低温对局灶性脑缺血再灌注大鼠脑皮质神经元凋亡及存活素、脑源性神经营养因子表达的影响.中风与神经疾病, 2012, 29(3): 239-242.
8 Liu X L, Zhang W, Tang S J. Intracranial transplantation of human adipose-derived stem cells promotes the expression of neurotrophic factors and nerve repair in rats of cerebral ischemia-reperfusion injury. Int J Clin Exp Pathol, 2014, 7(1): 174-183.
9 Madduri S, di Summa P, Papaloïzos M, et al. Effect of controlled codelivery of synergistic neurotrophic factors on early nerve regeneration in rats. Biomaterials,2010,31(32):8402-8409.
10 杨克红, 葛树星, 许冰莹,等.三七皂苷Rg1 对大鼠脑缺血再灌注损伤中BDNF mRNA 含量的影响.中草药, 2007, 30(3): 313-316.
11 Fanaei H,Karimian S M,Sadeghipour H R, et al. Testosterone enhances functional recovery after stroke through promotion of antioxidant defenses, BDNF levels and neurogenesis in male rats. Brain Res, 2014, 1558: 74-83.
12 Kaengkan P, Baek S E, Kim J Y, et al. Administration of mesenchymal stem cells and ziprasidone enhanced amelioration of ischemic brain damage in rats. Mol Cells, 2013, 36(6): 534-541.
13 Zhang L, Zhao H, Zhang X, et al. Nobiletin protects against cerebral ischemia via activating the p-Akt, p-CREB, BDNF and Bcl-2 pathway and ameliorating BBB permeability in rat. Brain Res Bull, 2013, 96(7) :45-53.
14 Kim G, Kim E. The effects of antecedent exercise on motor function recovery and brain-derived neurotrophic factor expression after focal cerebral ischemia in rats. J Phys Ther Sci, 2013, 25(5): 553-556.
15 Shih P C, Yang Y R, Wang R Y. Effects of exercise intensity on spatial memory performance and hippocampal synaptic plasticity in transient brain ischemic rats. PloS One, 2013, 8(10): 78163.
Effects of Eerdun-Wurile on the Expressions of BDNF and NGF in the Prefrontal Cortex in Middle Cerebral Artery Occlusion / Reperfusion (MCAO / R) Injured Rats
Lian Hua1, Ma Chunjie2, Hu Relebagen1, Li Chao2, Tian Haiguang2, Xiao Zhibin3
(1. College of Mongolian Medicine, Inner Mongolia Medical University, Hohhot 010110, China;
2. College of Traditional Chinese Medicine, Inner Mongolia Medical University, Hohhot 010110, China;
3. Library of Inner Mongolia Medical University, Hohhot 010110, China)
The present study aimed to explore the effects of Eerdun-Wurile on brain-derived neurotrophic factor(BDNF) and nerve growth factor (NGF) expressions in the prefrontal cortex of MCAO / R injury rats. Sixty SD male rats of SPF grade were selected to establish the model of MCAO / R with Zea-Longa thread occlusion, and divided into five groups at random: the sham operation group, the model group, the nimodipine group and the Eerdun-Wurile group. After modeling, rats were anesthetized for preparing the brains. The pathomorphological changes of the brains were evaluated by immunohistochemical techniques, such as HE staining and SP. The protein and mRNA expressions of BDNF and NGF in the prefrontal cortex of rats were detected by ELISA and RT-PCR, respectively. As a result, compared with the model group, it was found that the number of necrotic cells in the prefrontal cortex were significantly reduced in the Eerdun-Wurile group (P < 0.05), while the mRNA and protein expressions of BDNF and NGF were significantly increased (P < 0.05). In conclusion, the BDNF and NGF expressions in the prefrontal cortex were up-regulated for stimulating the activation of astrocytes and protecting the neurons with the treatment of Eerdun-Wurile in MCAO / R injured rats, which may be the mechanism of the treatment of Eerdun-Wurile for “white vein” disease.
Eerdun-Wurile, middle cerebral artery occlusion / reperfusion model, brain-derived neurotrophic factor, nerve growth factor
(责任编辑:姜月滢,责任译审:朱黎婷)
10.11842/wst.2016.07.022
R2-031
A
2015-12-23
修回日期:2016-02-03
* 国家自然科学基金委面上项目(81560700):额尔敦-乌日勒预处理对心肌缺血再灌注损伤的作用及其复杂机制研究,负责人:麻春杰;内蒙古医科大学博士启动基金项目(2014YKDXBSJJ15):额尔敦-乌日勒中挥发性成分的定性研究,负责人:莲花;内蒙古医科大学青年创新基金项目(YKDX2014QNCX018):额尔敦-乌日勒血清药物化学的初步研究,负责人:莲花。
** 通讯作者:麻春杰,教授,博士,主要研究方向:中蒙医药防治心脑血管疾病的研究。

