中药络石藤及其习用品的DNA条形码鉴定*
宫 璐,黄志海,张 靖,白俊其,苏 贺,张晓柠,徐 文**
(1.广州中医药大学第二临床医学院 广州 510006;2.国家人类基因组北方研究中心/北京诺赛基因组研究中心有限公司/基因组学研究北京市重点实验室 北京 100176)
中药络石藤及其习用品的DNA条形码鉴定*
宫 璐1,黄志海1,张 靖1,白俊其1,苏 贺1,张晓柠2**,徐 文1**
(1.广州中医药大学第二临床医学院 广州 510006;2.国家人类基因组北方研究中心/北京诺赛基因组研究中心有限公司/基因组学研究北京市重点实验室 北京 100176)
目的:本研究应用ITS2序列鉴定区分络石藤及其习用品广东络石藤、地瓜藤、薜荔藤和扶芳藤。方法:提取以上5种中药基原植物基因组DNA,扩增不同样品的ITS2序列。采用隐马尔科夫模型HMMer进行序列注释,ClustalW法进行序列比对,K2P模型计算种内和种间遗传距离分析,邻接法和最大似然法构建进化树。结果:5个物种的ITS2序列长度各不相同,在220-243 bp之间。遗传距离分析显示,5个物种的最大种内遗传距离为0.038,最小种间遗传距离为0.113,最大种内遗传距离大于最小种间遗传距离。同时5个物种可以在进化树上区分开来。结论:ITS2序列可以用于中药络石藤及其习用品的分子鉴定,为准确区分该类药材提供新的技术手段。
络石藤 鉴定 ITS2 条形码
络石藤是一种常见中药,始载于《神农本草经》,被列为上品。2015年版《中国药典》中收载的络石藤为夹竹桃科植物络石Trachelospermum jasminoides(Lindl.) Lem. 的干燥带叶藤茎。络石藤是一味重要的抗风湿清热药,具有祛风通络、凉血消肿的功效,主治风湿热痹、筋脉拘挛、腰膝酸痛、喉痹、痈肿、跌打损伤等症,现代临床亦广泛用于类风湿性关节炎、关节炎等疾病见有风湿热证的治疗[1]。因地方用药习惯不同,广东络石藤(亦称穿根藤,Psychotria serpens)、地瓜藤Ficus tikoua、薜荔藤F. pumila、扶芳藤Euonymus fortunei都在不同地区用作络石藤[2,3]。这几种中药材在性状上很相似,一般较难鉴别。
不同于传统利用表型或化学成分对中药的鉴定,新兴的DNA条形码技术分析物种的DNA序列信息,基于同一基因组片段序列进行不同物种的鉴定[4]。该技术已在多种动植物、微生物的鉴定中取得成功[4-6]。本研究采取DNA条形码技术,通过序列扩增、测定得到络石藤及其习用品广东络石藤、地瓜藤、薜荔藤和扶芳藤的基因组第二内转录间隔区(ITS2)序列,以其作为DNA条形码对上述易混药材进行区分,旨在为中药的质量控制及临床安全用药提供有效的分子鉴定手段。
1 材料与方法
1.1 植物药材
络石、蔓九节和地果3种植物样本采自广东省乐昌市和广州市,从GenBank数据库***下载地果、薜荔、扶芳藤3种植物的ITS2序列,共得到ITS2序列络石14条、蔓九节18条、地果7条、薜荔7条、扶芳藤3条。详细样品信息见表1。
1.2 试剂和仪器
DP305植物组DNA提取试剂盒(北京天根生化科技有限公司,批号:P4104);Glodview(上海赛百盛基因技术有限公司,批号:20151209);2×Taq PCR Mix酶(北京艾德莱生物科技有限公司,批号:262451AX);β-巯基乙醇(美国sigma公司,批号:M6250);Tris-HCl(上海麦克林生化科技有限公司,批号:T818979); DL 2000 DNA Marker(日本TaKaRa公司,批号:P4219);琼脂(美国sigma公司,批号:V900500);Tris(美国sigma公司,批号:V900483);引物由上海美吉生物科技有限公司合成,其余试剂均为分析纯。
小型离心机(德国eppendorf公司,型号:5418); PCR扩增仪ProFlex PCR system(美国Life Technologies公司,型号:ProFlex);多功能垂直旋转混合器(英国Grant公司,型号:PTR-30/PTR-60);水平电泳槽(美国Bio-Rad公司,型号:Mini-Sub Cell GT);GelDoc凝胶成像系统(美国Bio-Rad公司,型号:GelDoc XR+);多功能样品均质器(法国Bertin Technologies公司,型号:Precellys 24);NanoDrop 2000c微量分光光度计(美国Thermo Scientific公司,型号:NanoDrop 2000c)。
1.3 ITS2序列分析
1.3.1 模板DNA的制备
称取干燥植物30 mg于灭菌的2 mL离心管中,加入直径6 mm的小钢珠一个,使用样品均质器Precellys 24将植物材料研碎成粉末。采用植物基因组DNA提取试剂盒进行植物DNA的提取,提取步骤按说明书所示。1%的琼脂糖凝胶电泳检测提取DNA的完整性,Nanodrop 2000c检测DNA的浓度和纯度。
1.3.2 PCR扩增及测序
以提取的植物基因组DNA为模板,采用通用引物ITS2F:ATGCGATACTTGGTGTGAAT,ITS3R:GACGCTTCTCCAGACTACAA,进行ITS2序列扩增。PCR扩增体系为:2×Taq PCR Mix 12.50 μL,正向引物(2.5 μM)1.00 μL,反向引物(2.5 μM)1.00 μL,ddH2O 8.5 μL,模板(基因组DNA<0.1 g)2.00 μL;PCR扩增条件为:94℃变性5 min;94℃变性30 s、56℃退火30 s、72℃延伸45 s,共35个循环;72℃、10 min。扩增产物大小约500 bp,经1%的琼脂糖凝胶电泳检测为明亮、单一条带后于上海美吉生物技术有限公司进行双向测序。
1.3.3 序列分析
运用CodonCode Aligner软件(美国Codon公司)对测得序列进行质量检测和拼接。拼接后序列基于隐马尔科夫模型HMMer进行ITS2序列注释,注释过程在ITS2网站完成** http∶//its2.bioapps.biozentrum.uni-wuerzburg.de/[7]。采用ClustalW法进行序列比对,序列特征分析使用BioEdit软件完成。MEGA6软件进行遗传距离分析和进化树构建。基于K2P(Kimura-2-Parameter)模型计算种内和种间遗传距离。采用邻接法(Neighbor-Joining,NJ)和最大似然法(Maximum-Likelihood, ML)构建进化树,自展法(Bootstrap)检验重复1 000次[8,9]。

表1 待分析样品信息
2 结果
2.1 ITS2序列特征
同一物种的多条序列经比对后发现:①络石ITS2序列长度为222 bp,未见有变异位点,A、T、C、G 4种碱基的含量分别为19.37%、19.37%、31.98%、29.28%;②蔓九节ITS2序列长度为235-236 bp,有变异位点8个,分别为21、73、80、220位点的T/C突变,51、210位点的A/G突变,125位点的A/T突变、223T,序列的GC含量为58.72%-60.17%;③地果ITS2序列长度为240-243 bp,有变异位点7个,分别为34位点的A/C突变、35A/T突变,67、164位点G碱基的插入/缺失,73、169位点的A/G突变,232位点的T碱基插入/缺失,序列的GC含量为67.08%-67.36%;④薜荔ITS2序列长度为238-239 bp,有变异位点6个,70、124位点的A/G突变、199位点的C/T突变、220位点的C/G突变、233位点的A/T突变、239位点G碱基的插入/缺失,序列的GC含量为70.13%-70.71%;⑤扶芳藤ITS2序列长度为220-221 bp,有变异位点6个,99位点的C/T突变,125位点的T/G突变,160、188位点的C/G突变,185位点G碱基的缺失,189位点的A/G突变,序列的GC含量为73.64%-75.11%。详见表2。
2.2 遗传距离分析
K2P模型对ITS2序列的分析显示,5种植物的种内遗传距离为0.000-0.038,平均种内遗传距离为0.012,其中薜荔的最大种内遗传距离最大,为0.038,扶芳藤的平均种内遗传距离最大,为0.027(表3);5种植物的种间遗传距离为0.113-0.648,同科同属植物薜荔和地果的最小种间遗传距离最小,薜荔和蔓九节的最大种间遗传距离最大(表3)。经统计,5种植物的平均种间遗传距离为0.429。络石、蔓九节、地果、薜荔、扶芳藤5种植物的种内遗传距离远远小于两两物种间的种间遗传距离(表4)。
2.3 进化树的构建
由络石、蔓九节、地果、薜荔、扶芳藤5种植物共49条序列构建的NJ和ML进化树显示,两种方法的建树结果相一致:全部序列明显分为4大支(支持度98%-100%),薜荔和地果为一支,络石、蔓九节、扶芳藤各聚为一支。虽然同属桑科榕属的薜荔和地果亲缘关系最近,同在一大支,尽管如此,二者的不同样品仍各聚在一起,表现出单系性。因此对于这5个物种,ITS2可以很好的将其区分开。详见图1、图2。
3 讨论
薜荔藤作为络石藤有很长的药用历史,早在唐代《新修本草》与明代《本草纲目》中就有记载,现在中国南方大部分省区仍习惯将薜荔藤作为药用络石藤[2]。地瓜藤曾在贵州部分地区用作络石藤,扶芳藤在长江以北的河南、山东、陕西等地作为络石藤入药[3]。广东地区则一直以广东络石藤代替络石藤使用[10]。为了明确区分不同的入药药材,郑善荣[2]对络石藤及其易混品其进行了鉴别和性状描述,张电光等[11]测定了紫外吸收光谱,谢洁行等[3]应用络石藤含牛蒡甙在紫外照射下显绿色荧光的特性对其进行鉴定。

表2 中药络石藤及其习用品的ITS2序列特征
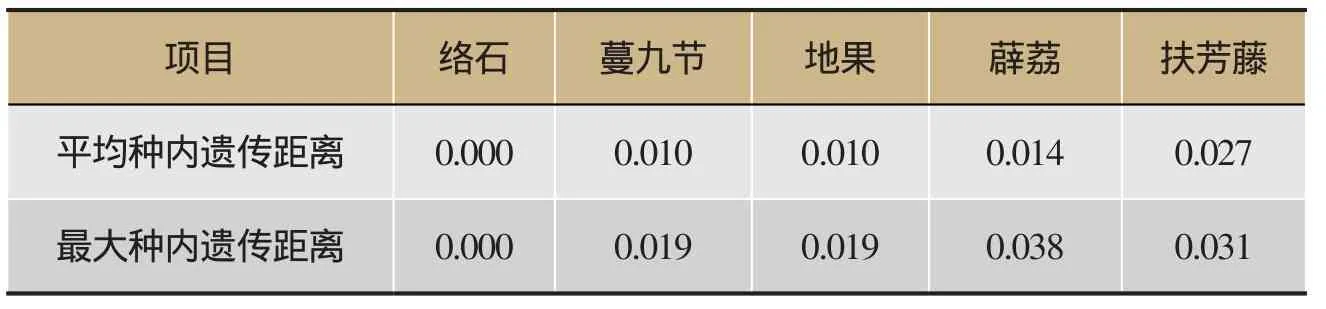
表3 基于ITS2序列变异的络石藤及其易混品的种内遗传距离
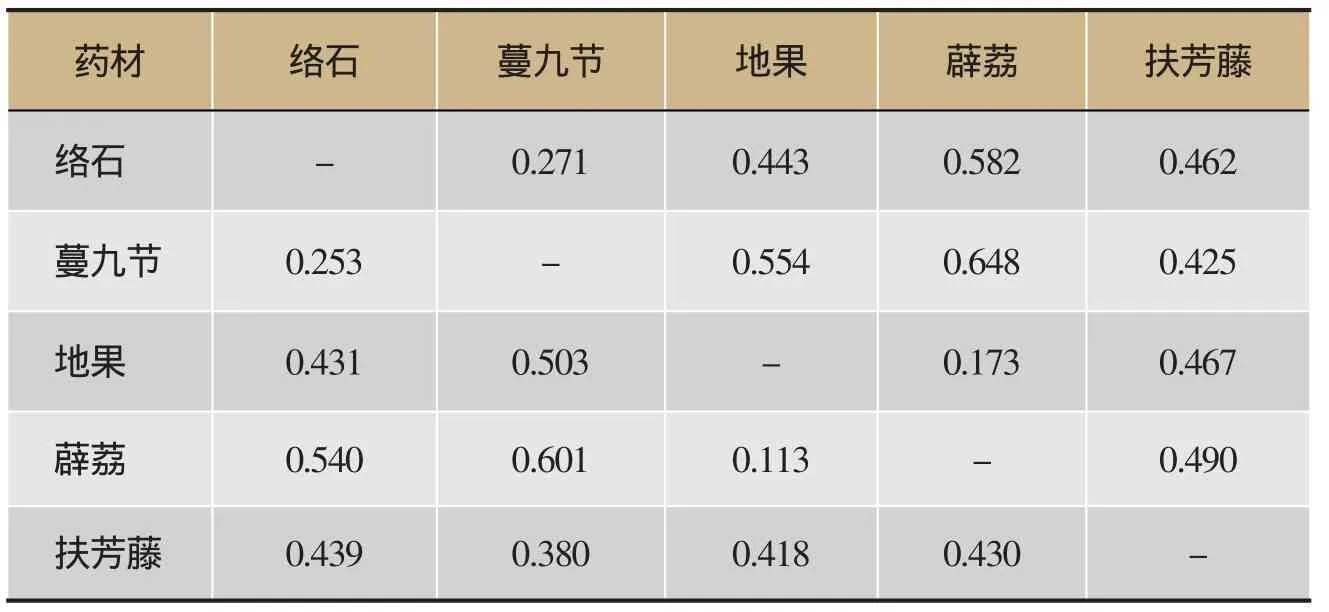
表4 基于ITS2序列变异的络石藤及其易混品的种间遗传距离
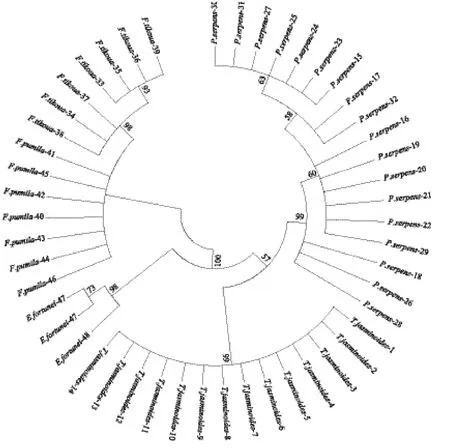
图1 基于ITS2序列构建的中药络石藤及其易混品的NJ进化树
ITS2序列是中药鉴定领域应用广泛,且被证实是在多种中药材鉴定中通用性、有效性较高的DNA序列片段[5,12]。本文首次应用ITS2条形码技术对中药络石藤及其习用品进行鉴定,结果显示,络石、蔓九节、地果、薜荔、扶芳藤5种中药基原植物的ITS2序列长度不同,遗传距离分析结果表明,种间遗传距离远大于种内遗传距离,NJ和ML进化树图也可将5个物种区分开。因此,ITS2序列可以对中药络石藤及其习用品广东络石藤、地瓜藤、薜荔和扶芳藤进行有效鉴定,为该类药材的区分鉴定提供了新的技术手段。本文薜荔和地果显示出较近的亲缘关系,可以尝试使用psbA-trnH等其他条形码[13],对二者进行进一步的区分。

图2 基于ITS2序列构建的中药络石藤及其易混品的ML进化树
相较于传统的表型鉴定方法,DNA条形码技术不依赖肉眼观察,更为客观和准确,尤其对于加工处理后的中药材,可以高效地完成其鉴定。与光谱等鉴定方法相比,DNA条形码检测的是DNA序列,不受植物在不同环境下表型变异的影响,其稳定性远高于化学成分的检测,使得鉴定结果更为稳定,通用性更高。为解决中药历史遗留的“同名异物、同物异名”问题,应在传统方法的基础上,结合现代DNA条形码技术对中药进行鉴定。为每一种中药材贴上自身独特的“DNA条形码”标签使得中药的选用将更为精准与便捷,从而提高临床疗效,造福患者。
参考文献
1 李金生,张茜,张涛,等.中药络石藤的研究进展.河北中医药学报, 2016, 31(2): 55-58.
2 郑善荣.络石藤及其混淆品种的鉴别.蛇志, 2007, 19(2): 166-167.
3 谢洁行,王子薇,刘艳骄.络石藤常见混淆品紫外荧光的鉴别方法.吉林中医药, 1997, 23(5): 38.
4 Hebert P D N, Ratnasingham S, Waard J R. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species. Proc R Soc London Ser B, 2003, 270: S96-S99.
5 Chen S, Yao H, Han J, et al. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species. Plos One, 2010, 5(1): e8613-e8613.
6 Summerbell R C, Lé vesque C A, Seifert K A, et al. Microcoding: The second step in DNA barcoding. Philos Trans R Soc B Biol Sci, 2005, 360(1462): 1897-1903.
7 Keller A, Schleicher T, Schultz J, et al. 5.8S-28S rRNA interaction and HMM-based ITS2 annotation. Gene, 2009, 430 (1-2): 50-57.
8 Tamura K, Nei M, Kumar S. Prospects for inferring very larger phylogenies by using the neighbor-joining method. Proc Natl AcadSci USA, 2004, 101 (30): 11030-11035.
9 Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihyood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol, 2011, 28(10): 2731-2739.
10 伍月红,刘柏英.广东习用中药材品种鉴定和质量分析.时珍国医国药, 2005, 16(9): 941-942.
11 张电光,罗集鹏.中药络石藤的紫外光谱法鉴别.中药材, 2000, 32(2): 78-79.
12 陈士林,庞晓慧,姚辉,等.中药DNA条形码鉴定体系及研究方向.世界科学技术-中医药现代化, 2011, 13(5): 747-754.
13 韩建萍,宋经元,姚辉,等.中药材DNA条形码鉴定的基因序列比较.中国中药杂志, 2012, 37(8): 1056-1061.
Identification of Traditional Chinese Medicine Trachelospermum Jasminoides and Its Customary Supplies Using DNA Barcoding
Gong Lu1, Huang Zhihai1, Zhang Jing1, Bai Junqi1, Su He1, Zhang Xiaoning2, Xu Wen1
(1. The 2ndClinical College, Guangzhou University of Chinese Medicine, Guangzhou 510006, China;
2. Chinese National Human Genome Center / SinoGenoMax Co., Ltd. / Beijing Key Laboratory of Genomics, Beijing 100176, China)
This study aimed to distinguish T. jasminoides from Psychotria serpens, Ficus tikoua, Ficus pumila and Euonymus fortune. In the study, DNAs from the original plants were extracted, and sequences of internal transcribed spacer 2 (ITS2) were amplified. Hidden Markov model (HMMer) was adopted to annotate the sequences which were aligned with ClustalW method. Interspecific and intraspecific genetic distances were calculated based on K2P model. Finally, Neighbor-joining (NJ) and Maximumlikelihood (ML) phylogenetic trees were built. As a result, it was found that the sequence length of ITS2 varied from 220 bp to 243 bp. The longest interspecific genetic distance was 0.038, while the shortest intraspecific genetic distance 0.113. The five species were distinguishable in the evolutionary tree. In conclusion, ITS2 barcoding, a new technique for the identification of the five Chinese materia medica was provided, promoting its application in the field of Chinese traditional medicine with strategic significance.
Trachelospermum jasminoides, identification, internal transcribed spacer 2, DNA barcoding
10.11842/wst.2016.08.028
R282
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-07-29
修回日期:2016-08-10
* 国家自然基金委青年科学基金项目(81402887)基于组合质谱技术与代谢组学方法的中药何首乌体内物质作用组群与肝毒性研究,负责人:徐文;广东省科技厅社会发展领域科技计划(2013B021800236)基于代谢组学的附子毒性研究,负责人:徐文;广东省中医院院内专项(2015KT1817):岭南中草药DNA 条形码分子鉴定和生态适宜性研究,负责人:黄志海。
** 通讯作者:张晓柠,助理研究员,研究方向:分子生物学;徐文,副研究员,主要研究方向:中草药质量控制。
*** http∶//www.ncbi.nlm.nih.gov/genbank/

