呼吸支持模式对早产儿视网膜病的影响
孙慧清 康文清 李明超 许邦礼 郭静 刘大鹏 熊虹(郑州市儿童医院新生儿重症监护室 河南郑州 450053)
呼吸支持模式对早产儿视网膜病的影响
孙慧清 康文清 李明超 许邦礼 郭静 刘大鹏 熊虹
(郑州市儿童医院新生儿重症监护室 河南郑州 450053)
【摘要】目的 探讨不同呼吸支持模式对早产儿视网膜病及血清VEGF和IGF-1水平变化的影响。方法 共578例出生胎龄小于34周,从第1次眼底筛查到最后1次眼底筛查生存的早产儿,所有纳入研究早产儿被分为无ROP、1期、2期、3期以上ROP或3期ROP+plus病变。血清IGF-1、VEGF在生后1周、2周、3周和4周被检测。结果 323例早产儿无ROP,126例早产儿发生1期ROP,80例发生2期ROP,39例发生3期以上ROP,10例患儿发生3期ROP+plus病变。对于1期ROP,机械通气组的发生率是41%,显著高于其他组(P<0.05);对于2期ROP,鼻导管吸氧组、CPAP组、机械通气组与对照组的发生率类似,但是鼻导管吸氧组+CPAP组+机械通气组ROP的发生率显著高于对照组(P<0.05)。生后1周、2周、3周和4周血清IGF-1、VEGF水平各组间类似。结论 呼吸支持不同模式对早产儿2期以上ROP无明显影响,对血清IGF-1和VEGF也无明显影响。
【关键词】呼吸支持;早产儿;视网膜病
早产儿视网膜病(ROP)是一多因素引起的严重视网膜血管增生性疾病,威胁到早产出生儿童的视力。医疗水平的提高使早产儿生存率增加,ROP发生的风险也相应增加[1]。胎龄(GA)≤28周和机械通气是严重ROP的独立危险因素[2]。机械通气引起的氧合波动被认为与ROP显著相关[2]。ROP的发病机理包括两个阶段,第一阶段高氧导致血管生长中断,第二阶段血管生长受损的视网膜发育代谢需求增加,相对低氧环境下刺激血管内皮生长因子(VEGF)过度表达,促进异常血管新生延伸到玻璃体[3]。
早产儿的生存率增加,ROP是引起失明的主要因素。出生后因素包括低出生体质量、低出生胎龄、男性、过度氧疗和延长的机械通气被认为与ROP的发生相关[4],而且,VEGF水平和胰岛素生长因子(IGF-1)在ROP的发生中起主要角色。然而,呼吸支持不同模式例如鼻导管吸氧、CPAP和机械通气对ROP的影响未见报道,不同的呼吸支持模式对血清VEGF 和IGF-1是否有影响尚不清楚,本研究旨在探讨不同的呼吸支持模式对ROP及血清VEGF和IGF-1水平的影响。
1 资料与方法
1.1 一般资料 本研究采用前瞻性队列研究,按照我国卫生部2004年制定的《早产儿治疗用氧和视网病变防治指南》,对2009年1月至2014年12月出生符合条件的早产儿进行视网膜病筛查。筛查对象为胎龄<34周或出生体质量(BW)<2000 g的早产儿;BW>2 000 g但病情危重曾经接受机械通气或CPAP辅助通气,吸氧时间较长的新生儿。首次筛查时间为生后4~6周或纠正胎龄32周[5]。排除遗传代谢病、先天畸形、不能坚持到ROP最后1次检查者[6],最后1次筛查时间为纠正胎龄42周。收集资料包括出生胎龄、出生体质量、性别、血气分析、机械通气时间、吸氧时间、ROP检查结果、低血糖、高胆红素血症、支气管肺发育不良、颅内出血、坏死性小肠结肠炎和败血症。
1.2 呼吸支持模式 根据病情或血气分析,早产儿被给予鼻导管吸氧、鼻塞持续正压通气(Infant Flow,CareFusion,San Diego,California),常频机械通气(Ser-vo-i,Maquet,Wayne,New Jersey),或高频振荡通气(SLE5000,SLE,South Croydon,United Kingdom)。机械通气策略目标是最佳的肺复张和避免肺不张,最佳的肺通气是肺容积在8~9.5肋间,对有气漏的婴儿肺通气在7~8肋间(肺气肿或未放置引流管气胸),氧合(SpO2of 92%~95%)被用来作为理想肺容积的直接指标[7]。
1.3 ROP筛查和分类 所有早产儿根据《早产儿治疗用氧和视网病变防治指南》进行ROP筛查,ROP筛查由高年资眼科医师进行筛查,眼底检查由间接眼底镜和Retcam 3(广域数字化照相仪)组成。根据ROP国际分类[8],ROP被分为1期(分界线)、2期(嵴形隆起)、3期(嵴形隆起伴纤维增殖)、4期(部分视网膜脱离)、5期(全部视网膜脱离)。
1.4 IGF-1、VEGF检测 对入选早产儿在生后2周、3周和4周无菌采取外周血1.0 ml,经离心后,-20℃保存待检。IGF-1、VEGF测定采用双抗体夹心ABC.ELISA法。
1.5 统计分析 采用SPSS 17.0统计学软件进行统计分析,定性资料采用χ2检验,定量资料采用两独立样本数据t检验及多样本数据方差分析。以α=0.05为检验水准。
2 结果
在本研究中,共有609例早产儿进行了ROP筛查,31例被排除,其中30例因资料不完整,1例因肛门闭锁行外科手术,最终578例早产儿被研究分析,323例早产儿无ROP,126例早产儿患1期ROP,80例患2 期ROP,39例患3期以上ROP,10例早产儿患3期ROP+plus疾病。
2.1 不同呼吸支持模式下ROP发生率 机械通气组41%的患儿发生1期ROP,与其他组相比,差异有统计学意义(P<0.05)(见表1)。对于2期ROP,鼻导管吸氧组、CPAP组和机械通气组与对照组类似,差异无统计学意义,但是,把需要吸氧的鼻导管吸氧组、CPAP组和机械通气组一起与对照组比较,鼻导管吸氧组、CPAP组和机械通气组3组合在一起2期ROP的发生率显著高于对照组(P<0.05)。

表1 不同呼吸支持模式患儿ROP的发生率[n(%)]
2.2 不同呼吸支持模式患儿血清VEGF、IGF-1的变化 鼻导管吸氧组、CPAP组、机械通气组与对照组生后1周、2周、3周、4周血清VEGF和IGF-1水平的变化比较,差异无统计学意义(P>0.05),提示血清VEGF和IGF-1水平与不同呼吸支持模式无显著相关性。见表2、3。
表2 不同呼吸支持模式治疗患儿VEGF水平(±s,pg/ml)

表2 不同呼吸支持模式治疗患儿VEGF水平(±s,pg/ml)
注:F1值与P1值是不同呼吸支持模式各组之间的比较;F2值与P2值是不同呼吸支持模式各组与对照组之间的比较。
周对照组(n=20)鼻导管吸氧组(n=23)CPAP组(n=25)CMV组(n=20)HFOV组(n=18) F1P1F2P21 483.1±167.7 392.0±172.3 382.2±157.5 378.1±169.4 385.0±164.5 0.03 0.99 1.46 0.22 2 415.2±131.6 331.3±155.8 311.0±173.5 327.2±161.7 335.3±158.3 0.10 0.96 1.41 0.24 3 389.0±183.8 290.2±137.6 279.0±150.3 261.1±148.9 270.4±145.1 0.16 0.93 2.32 0.06 4 341.3±162.7 249.5±133.0 220.0±124.6 223.1±119.7 217.3±130.5 0.30 0.83 0.21 0.93
表3 不同呼吸支持模式治疗患儿IGF-1水平(±s,pg/ml)
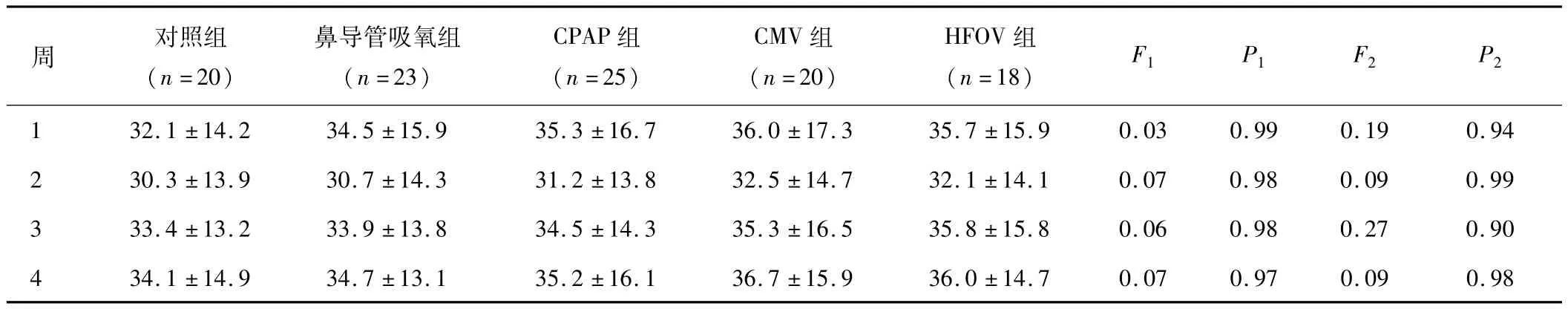
表3 不同呼吸支持模式治疗患儿IGF-1水平(±s,pg/ml)
注:F1值与P1值是不同呼吸支持模式各组之间的比较;F2值与P2值是不同呼吸支持模式各组与对照组之间的比较。
周对照组(n=20)鼻导管吸氧组(n=23)CPAP组(n=25)CMV组(n=20)HFOV组(n=18) F1P1F2P21 32.1±14.2 34.5±15.9 35.3±16.7 36.0±17.3 35.7±15.9 0.03 0.99 0.19 0.94 2 30.3±13.9 30.7±14.3 31.2±13.8 32.5±14.7 32.1±14.1 0.07 0.98 0.09 0.99 3 33.4±13.2 33.9±13.8 34.5±14.3 35.3±16.5 35.8±15.8 0.06 0.98 0.27 0.90 4 34.1±14.9 34.7±13.1 35.2±16.1 36.7±15.9 36.0±14.7 0.07 0.97 0.09 0.98
3 讨论
ROP是早产儿视网膜血管发育异常,潜在性地导致婴儿失明,ROP与早产、低出生体质量、高氧、感染等多种因素有关[6]。生后氧疗被认为是ROP的显著高危因素[9]。足月儿视网膜和视网膜血管发育完全,因此不发生ROP,然而,早产儿视网膜发育不完善,视网膜发育成熟程度主要依靠于出生时胎龄[9]。机械通气高压氧输送产生高氧环境,对萌发的视网膜血管直接有害[2]。本研究结果显示,ROP的发生率与呼吸支持模式鼻导管吸氧、CPAP和机械通气无明显相关性,然而,ROP的发生率与有无呼吸支持治疗显著相关。
ROP的发生经历两个阶段,起始阶段是血管受损,第二阶段是血管增生,高氧和低氧调节生长因子是ROP发生中的关键因素[10]。血管发生和血管生成是局部和全身生长因子之间或刺激内皮细胞有丝分裂、抑制分化、增生、迁移和成熟复杂相互作用的结果[11]。VEGF和IGF-1在发生ROP所起的作用不容忽视,VEGF被认为是起源肿瘤的渗透增强因子,但后来显示是内皮细胞分裂[12]。动物研究模型支持VEGF在眼睛神经血管发育中的重要作用[13],ROP与多种因素有关,发病机理由其他生化因子介导[14]。生长激素和IGF-1被认为通过控制VEGF活性在视网膜神经新血管形成起一定作用[15]。本研究发现血清VEGF和IGF-1变化在不同呼吸支持模式间差异无统计学意义。
综上,Ⅱ期或Ⅲ期ROP的发生率在不同呼吸支持模式下无显著差异,血清VEGF和IGF-1水平与不同呼吸支持模式无显著相关性。
参考文献
[1] Rao K A,Purkayastha J,Hazarika M,et al.Analysis of prenatal and postnatal risk factors of retinopathy of prematurity in a tertiary care hospital in South India[J].Indian J Ophthalmol,2013,61(11):640-644.
[2] Kucukevcilioglu M,Mutlu FM,Sarici SU,et al.Frequency,risk fac-tors and outcomesof retinopathy of prematurity in a tertiary care hospi-tal in Turkey[J].Turk JPediatr,2013,55(5):467-474.
[3] Jasani B,Nanavati R,Kabra N.Mechanisms and management of reti- nopathy of prematurity[J].N Engl J Med,2013,368(12):1161-1162.
[4] Yu X D,Branch DW,Karumanchi S A,et al.Preeclampsia and reti-nopathy of prematurity in preterm births[J].Pediatrics,2012,130(1):e101-e107.
[5] Sun H,KangW,Cheng X,etal.The use of theWINROP screening al-gorithm for the prediction of retinopathy of prematurity in a Chinese population[J].Neonatology,2013,104(2):127-132.
[6] Wu C,Vanderveen D K,Helstrom A,et al.Longitudinal postnatal weight measurements for the prediction of retinopathy of prematurity[J].Arch Ophthalmol,2010,128(4):443-447.
[7] Sun H,Cheng R,KangW,et al.High-frequency oscilatory ventila-tion versus synchronized intermitentmandatory ventilation plus pres-sure support in preterm infants with severe respiratory distress syn-drome[J].Respir Care,2014,59(2):159-169.
[8] Fierson W M.Screening examination of premature infants for retinopa-thy of prematurity[J].Pediatrics,2013,131(1):189-195.
[9] Hauspurg A K,Alred E N,Vanderveen D K,et al.Blood gases and retinopathy of prematurity:the ELGAN Study[J].Neonatology,2011,99(2):104-111.
[10]Lauer A K.Intravitreal anti-VEGF in Retinopathy of Prematurity:Several years on[J].Asia Pac JOphthalmol(Phila),2014,3(6):329-330.
[11]Malik M A,Shukla S,Azad SV,etal.Vascular endothelial growth fac-tor(VEGF-634G/C)polymorphism and retinopathy of prematurity:a meta-analysis[J].Saudi JOphthalmol,2014,28(4):299-303.
[12]Jiang Y,Wang H,Culp D,et al.Targeting Muler cel-derived VEGF164 to reduce intravitreal neovascularization in the ratmodel of retinopathy of prematurity[J].Invest Ophthalmol Vis Sci 2014,55(2):824-831.
[13]Vinekar A,Gilbert C,Dogra M,et al.The KIDROP model of combi-ning strategies for providing retinopathy of prematurity screening in underserved areas in India using wide-field imaging,tele-medi-cine,non-physician graders and smart phone reporting[J].Indian J Ophthalmol,2014,62(1):41-49.
[14]Stahl A,Helstrom A,Smith L E.Insulin-like growth factor-1 and anti-vascular endothelial growth factor in retinopathy of prematurity:has the time come[J].Neonatology,2014,106(3):254-260.
[15]Kistner A,Sigurdsson J,Niklasson A,et al.Neonatal IGF-1/IGFBP-1 axis and retinopathy of prematurity are associated with increased blood pressure in preterm children[J].Acta Paediatr,2014,103(2):149-156.
Effects of respiratory supportmode on retinopathy of premature infants
Sun Huiqing,Kang Wenqing,Li Mingchao,Xu Bangli,Guo Jing,Liu Dapeng,Xiong Hong
(Department of Neonatology,Zhengzhou Children's Hospital,Zhengzhou 450053,China)
【Abstract】Objective To explore the efects of diferentmodes of respiratory supporton the occurrence of retinopathy(ROP)and the levels of VEGF and IGF-1 in premature infants.M ethods A total of578 premature infantswith gestational age(GA)of 34 weeks or lesswho had survived from the time of the initialophthalmologic examination to the final ROPexamination were in-cluded in the study.Each infantwas categorized as no ROP,stage 1,stage 2,more than stage 3 ROP or stage 3 ROP+plus disease.The serum levels of VEGF and IGF-1 were detected at postnatal 1,2,3,4 weeks.Results There were 323 infants without ROP,126 infants with stage 1 ROP,80 infants with stage 2 ROP,39 infants with≥stage 3 ROP and 10 infants with stage 3 ROP+plus disease.For stage 1 ROP,the incidence was 41%in mechanical ventilation group which was significantly higher than other groups(P<0.05).For the stage 2 ROP,the incidence of ROP was similar in control group,nasal cannula group,CPAP group,and mechanical ventilation group.But the incidence of ROP in nasal cannula,CPAP and mechanical venti-lation groups together was significantly higher than the control group(P<0.05).The levels of VEGF and IGF-1 at the end of 1 week,2 weeks,3 weeks and 4 weeks were similar between nasal cannula group,CPAP group,and mechanical ventilation groups.Infants receiving respiratory support and controls also had similar VEGF and IGF-1 levels.Conclusion Diferent modes of respiratory support do not afect the occurrence ofmore than stage 2 ROP,and also for the levels of VEGF and IGF-1 in premature infants.
【Key words】respiratory support;premature infants;retinopathy
(收稿日期:2015-08-10)
【中图分类号】R 774.1
doi:10.3969/j.issn.1004-437X.2016.01.010

