盐类水解专题训练
陕西 马亚楼
盐类水解专题训练
陕西 马亚楼
一、选择题
1.常温下,将等体积、等物质的量浓度的NH4HC O3与N a C l溶液混合,析出部分N a HC O3晶体,过滤,所得溶液pH<7,下列关于滤液中的离子浓度关系不正确的是( )

2.下列叙述正确的是( )
A.浓氨水中滴加Fe C l3饱和溶液可制得Fe(OH)3胶体
B.CH3C O ON a溶液中滴加少量浓盐酸后c(CH3C O O-)增大
C.C a(HC O3)2溶液与过量N a OH溶液反应可制得C a(OH)2
D.2 5℃时C u(OH)2在水中的溶解度大于其在C u(NO3)2溶液中的溶解度
3.下列溶液中粒子的物质的量浓度关系正确的是( )
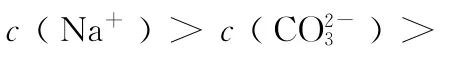
B.2 0 m L 0.1 m o l/L CH3C O ON a溶液与1 0 m L 0.1m o l/L HC l溶液混合后溶液呈酸性,所得溶液中:c(CH3C O O-)>c(C l-)>c(CH3C O OH)>c(H+)
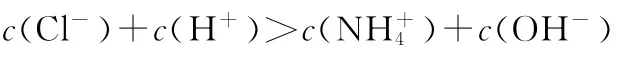
D.0.1m o l/L CH3C O OH溶液与0.1m o l/L N a OH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3C O OH)
4.已知某温度下CH3C O OH和NH3·H2O的电离常数相等,现向1 0m L浓度为0.1m o l/L的CH3C O OH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
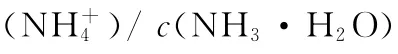
C.c(CH3C O OH)与c(CH3C O O-)之和始终保持不变
5.一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(H S-)=1× 1 0-5m o l·L-1
B.pH=a的氨水溶液,稀释1 0倍后,其pH=b,则a=b+1
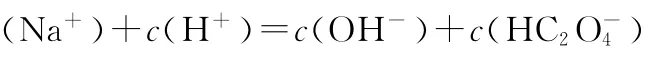
D.pH相同的①CH3C O ON a、②N a HC O3、③N a C l O三种溶液的c(N a+):①>②>③
6.下列关于0.1 0m o l·L-1N a HC O3溶液的说法正确的是( )
B.2 5℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
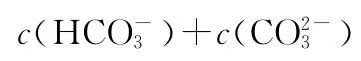
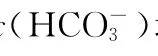
7.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )

二、非选择题
8.已知H2O2、KM n O4、N a C l O、K2C r2O7均具有强氧化性,将溶液中的C u2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含Fe C lx杂质的氯化铜晶体(C u C l2·2 H2O),为制取纯净的C u C l2·2 H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
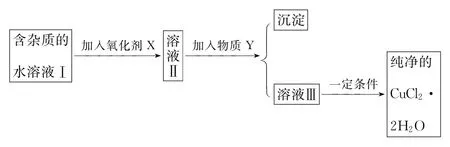
请回答下列问题:
(1)本实验最适合的氧化剂X是________(填序号)。
A.K2C r2O7B.N a C l O
C.H2O2D.KM n O4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________。原因是______________________________________________。
(4)除去Fe3+的离子方程式为_____________________。
(5)加氧化剂的目的为____________________________。
(6)最后能不能直接蒸发结晶得到C u C l2·2 H2O晶体?________。应如何操作?_________________________。
9.NH4A l(S O4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4H S O4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)可作净水剂,其理由是__________________________
(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1m o l/L NH4A l(S O4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1m o l/L NH4H S O4中c(NH4+)。
(3)下图是0.1m o l/L电解质溶液的pH随温度变化的图象。
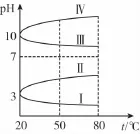
①其中符合0.1m o l/L NH4A l(S O4)2的pH随温度变化的曲线是________(填字母);
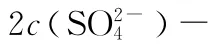
(4)室温时,向1 0 0m L 0.1m o l/L NH4H S O4溶液中滴加0.1m o l/L N a OH溶液,得到的溶液pH与N a OH溶液体积的关系曲线如下图所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________________________________。
1 0.常温下,如果取0.1m o l/L HA溶液与0.1m o l/L N a OH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
(1)混合后溶液的pH=8的原因:___________________ _________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)_________(填“<”“>”或“=”)0.1m o l/L N a OH溶液中由水电离出的c(OH-)。
(3)已知NH4A溶液为中性,又知将HA溶液加到N a2C O3溶液中有气体放出,试推断(NH4)2C O3溶液的pH ________(填“<”“>”或“=”)7;相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为________(填序号)。
a.NH4HC O3b.NH4A
c.(NH4)2S O4d.NH4C l
参考答案及解题提示

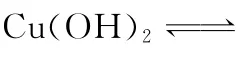

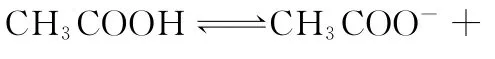

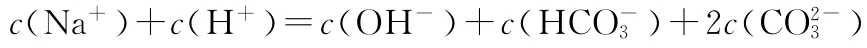
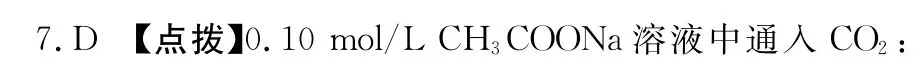

8.(1)C
(2)C u O或C u(OH)2或C u C O3
(3)不能 因加碱的同时也会使C u2+生成C u(OH)2沉淀
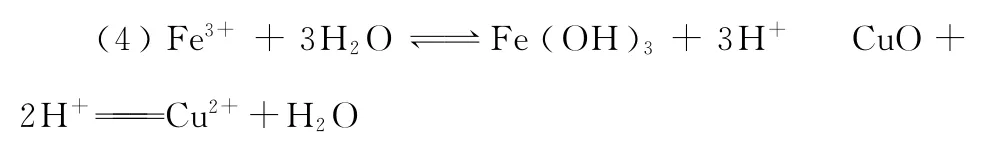
(5)将Fe2+氧化成Fe3+,便于生成沉淀而与C u2+分离
(6)不能 应在HC l气流中蒸发
【点拨】(1)加入氧化剂能把Fe2+氧化为Fe3+,同时又不能引入新的杂质,符合要求的只有H2O2。(2)当C u C l2溶液中混有Fe3+时,可利用Fe3+的水解:Fe3++3 H2O幑幐Fe(OH)3+3 H+,加入C u O、C u(OH)2或C u C O3与溶液中的H+作用,从而使水解平衡右移,把Fe3+转化为Fe(OH)3沉淀而除去。(3)若用加碱法使Fe3+沉淀,同时也必将使C u2+沉淀。(6)最后从C u C l2溶液中得到C u C l2·2 H2O也不能直接加热蒸发,为抑制C u C l2水解,应在HC l气流中加热蒸发。

(2)小于
(3)①Ⅰ ②1 0-3-1 0-11
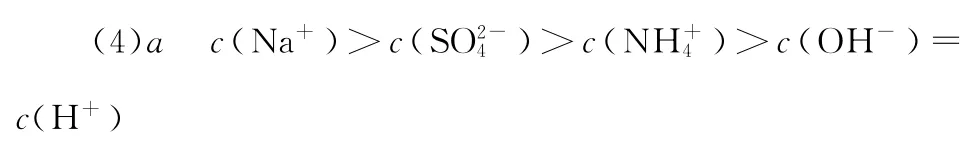
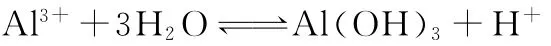
1 0.①A-+H2O 幑幐HA+OH-②>
③9.9×1 0-71 0-8
④>a>b>d>c
(作者单位:陕西省永寿县中学)

