牛奶体细胞数检测的研究进展
严建军,高 炎,高 飞
(1.宁波市计量测试研究院, 浙江 宁波 315048;2.浙江工业大学 计算机学院, 杭州 310023)
牛奶体细胞数检测的研究进展
严建军1,高炎2,高飞2
(1.宁波市计量测试研究院, 浙江 宁波315048;2.浙江工业大学 计算机学院, 杭州310023)
摘要:快速准确的牛奶体细胞数检测对于保证牛奶品质和监测奶牛健康具有重要意义;从牛奶体细胞数的基本概念、牛奶体细胞对牛奶的影响、国内外研究进程、牛奶体细胞数检测方法、相关检测仪器的发展等方面对牛奶体细胞数检测的研究进展进行了综述,分析了各种检测方法和检测仪器的优缺点,指出了作为热点方法之一的基于计算机视觉的牛奶体细胞数检测关键是体细胞图像分割与识别的准确性、识别速度以及相应自动化仪器的研制。
关键词:牛奶体细胞数;计算机视觉;图像处理;检测仪器
0引言
根据《2007-2008年中国乳制品市场调查与投资咨询研究报告》显示,未来的5~10年内行业收入将保持20%以上的增长速度,中国奶制品消费仍存在翻倍的增长空间,因此中国乳品行业在今后较长时期内都将处于不断增长阶段,而在食品安全事故频发的今天,要想实现可持续发展的长久战略,中国乳制品企业无疑要在乳制品安全和品质检测方面有所突破。
为发展乳业,近几年国家陆续修订了部分旧标准,引进了一些国外的概念与标准,其中值得重点关注的就是牛奶体细胞数(somatic cell count,SCC)的标准[1]。偏高的SCC意味着奶牛具有炎症或处于亚健康状态,快速准确的牛奶体细胞数检测对于保证牛奶品质和监测奶牛健康都具有重大意义。国外学者、公司围绕着牛奶体细胞数的检测作了大量的研究工作与市场化运作,取得了相当的成果,而我国对这方面的工作进展较缓慢,下面从牛奶体细胞数的基本概念、牛奶体细胞对牛奶的影响、国内外研究进程、牛奶体细胞数检测方法、相关检测仪器的发展等方面作研究综述。
1什么是牛奶体细胞数
SCC是指每毫升牛奶中的体细胞总数[2],该指标偏高意味着就表明奶牛可能处于亚健康状态或疾病状态[3]。SCC最早由美国提出,然后法国、德国、瑞典、荷兰和英国等在20世纪开始在此领域开展了大量的研究,并把SCC作为奶牛健康和原料奶质量的关键指标,纳入原料奶收购的计价体系,用于指导奶牛养殖。
2牛奶体细胞对牛奶的影响
正常情况下,牛奶中体细胞数在20~30万个/mL;当乳房外伤或发生疾病(如乳房炎等)时,体细胞数一般超过50万个/mL,此时可判断奶牛感染病菌可能性很大,乳房炎发病率较高。为进一步量化判断奶牛生病的情况,目前通常采用加利福尼亚检测法CMT的标准[6],如表1所示。

表1 CMT判断标准
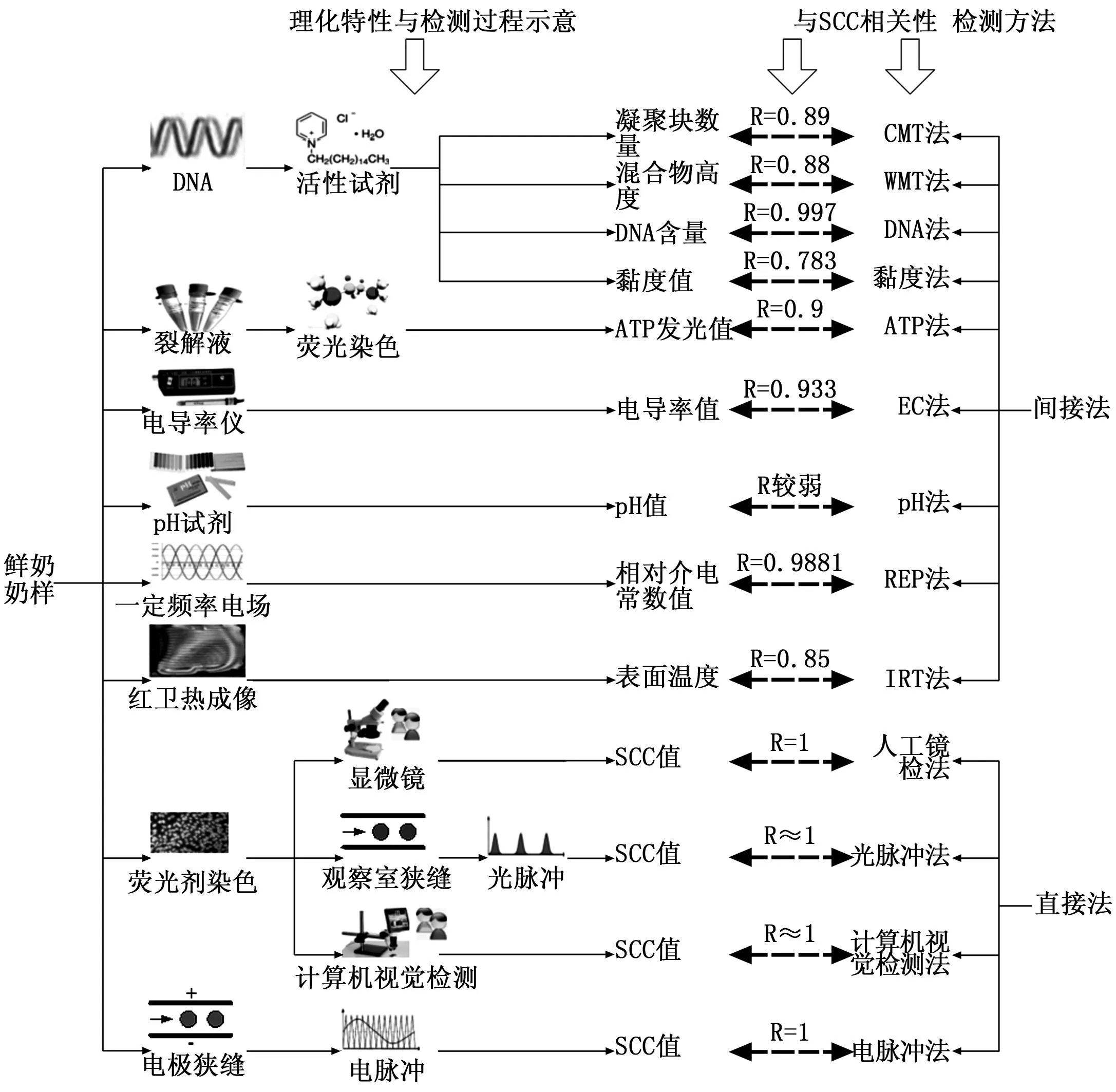
图1 牛奶体细胞数常用检测方法与理化特性关系示意
从上述分析看,牛奶体细胞数反映了牛奶产量、质量及奶牛的健康状况,是奶牛乳房健康状况的重要指标,也反映了一个地区或国家奶牛业发展的管理状况[4]。因此,乳制器生产厂家在检测原料奶时,不仅要从蛋白质和脂肪含量来判断原料奶的质量,还应以乳中的SCC含量来判断牛奶的质量,这不仅有利于保障消费者的健康,还有利于生产厂家保证产品质量,降低产品成本,获得更多的经济利益。
3牛奶体细胞数研究进程
上世纪70-80年代,发达国家逐渐
将SCC纳入监测范畴[7-8]。美国联邦法律规定,对冷却罐奶进行5次体细胞数检测,其中3次的体细胞数小于75万个/mL才能销售[9]。绝大多数专家、兽医师认为,体细胞数小于20万个/mL为正常,超过则为异常[10-11]。美国Pennsylvania State of University[12]和Cornell University[13]对牛奶体细胞数和感染牛的比例关系进行了研究。将牛奶体细胞数用于牛场管理与奶牛健康监测的主要体现在DHI(dairy herd improvement)体系中。DHI最早出现在1906年的欧洲[14],称为奶牛牛群改良计划,经过100多年的完善应用,逐步成为国际上通用的奶牛生产性能测定体系及牛场管理方案,它主要通过定期检测奶牛的乳脂率、产奶量、体细胞数、蛋白量等等指标形成测定报告,以此作为奶牛健康、牛场管理效率的依据,其中由于其他相关指标与体细胞数存在着一定的相关关系,因此,体细胞数成为了DHI体系中最重要的指标[15]。目前发达国家DHI测定率较高,如德国、丹麦、瑞典、荷兰、加拿大等测定率分别达到了100%、92%、85%、84.5%和65.8%,美国引入DHI较欧洲晚,自上世纪50年代开始规模性实施DHI,并于70到80年代将SCC引入DHI中[16],至2011年乳牛存栏920万头,产奶量为8 898.6万吨,奶牛减少1/2而其产奶量却增加了1.8倍[17]。
我国在实施DHI体系方面起步较晚,最早于1994年与加拿大合作,在上海、杭州、西安三地建立了DHI实验室,经过近20年的发展,截止2011年,我国已建成23个奶牛生产性能测定实验室,参测牛场1 054个,参测奶牛头数46.7万头,提供DHI报告累计100余万份,体细胞数由66.1万mL-1降低到42.1万mL-1,按当前参测奶牛头数计算,直接经济效益增加12亿元[17]。目前,上海、北京、天津和西安是中国范围内SCC测试规模较大的城市,然而,DHI的测定率仅为5%左右与欧美发达国家比较还有一定的差距,加拿大在庆祝DHI成立100周年之际,我国还有不少地方连SCC是什么也未知。事实上,体细胞的高低直接反映了一个牧场的总体管理水平,目前我国存在着牛场管理人员对DHI测定认识不足、SCC检测方法与仪器落后等不足。
4牛奶体细胞数主要检测方法
鉴于牛奶体细胞数的重要性,国内外学者针对牛奶体细胞的不同理化特性展开了深入的研究并提出了不同的体细胞数检测方法,具体分为直接检测法与间接检测法,如图1所示。下面详细综述每种方法的基本原理及其优缺点。
4.1间接检测法
4.1.1CMT法
1957年,O. W. Schalm[6]最早提出CMT(california mastitis test),称为加利福尼亚细胞数测定法,其方法原理是牛奶中的体细胞遇到氢氧化钠(NaOH)、烷基芳基磺酸(alkylaryl sulfonic acid)、烷基芒硫酸盐(Alkyl mans sulfate)或溴甲酚红紫(bromocresol purple)等表面活性试剂将收缩凝固并释放出去氧核糖核酸(DNA),同时产生凝聚,体细胞越多,凝聚状态越强,凝聚块越多,通过统计这些凝聚块可估算体细胞的数量。
CMT法快速、敏感,价格便宜,方法简单,所需设备少,结果较为准确,与直接镜检体细胞数、过氧化氢酶活性等也有较好的关联性(R=0.89)[19],环境温度影响小,外源物质(如毛发)不会影响结果,适用于个体奶牛或总奶样的检验;不足之处在于它只是体细胞的相对数量,人为因素影响较大,需专门培训人员固定做此项检查。有时CMT法会出现假阳性结果,如牛乳不新鲜或末乳等,最佳奶样为泌乳量中期的牛奶。另外,由于细菌产生的毒素会破坏体细胞,临床乳腺炎阳性的牛奶会表现为阴性。
4.1.2WMT法
WMT(wisconsin mastitis test)由D. I. Thompson于1964年提出[20],称为威斯康辛乳腺炎检测法,它是对总奶样进行检验。WMT的原理基础与CMT类似,所用表面活性试剂也一样,即利用活性试剂促使体细胞释放DNA并产生凝聚。WMT检测以毫米为单位进行记录,具体而言,首先建立WMT测试值与体细胞数的映射表,即T={(WMTi,SCCi) |i=1, 2, …, 33},如表2所示,然后,在操作时将定量的待测奶样与等量的活性试剂在带有刻度的试管中混合8~10 s后,将试管倾斜,让混合物排出,15 s后恢复垂直位置,等待1 min后读取留在试管中混合物的高度,令其为WMTk,通过查表,则对应的SCCk即为相应的体细胞数。牛奶中体细胞越多,形成的胶体就会越多,读取的数值WMTk也越高。

表2 WMT检测值与体细胞数映射表[23]
WMT法认为WMTk小于8 mm时为理想奶样,且WMTk小于19 mm时其测定精度较高,而超过19 mm的牛奶需要更为精确和严格的方法(如显微镜检法)来测定[21]。与CMT相比,WMT法较为简便,应用较为广泛,其结果不是估计而是测定,因此增加了实验的客观性,但需较复杂的设备,测定时间较长,其与直接镜检法的相关性与CMT大致相当(R=0.88)[22]。
4.1.3DNA法
DNA检测法的原理基础是体细胞中的DNA含量与体细胞数呈现一定的正相关性。Urbanová等[24]建立了DNA含量与体细胞数之间的相关性,其换算系数为λ=106个体细胞/8毫克DNA,具体检测时,仍然通过活性试剂促使体细胞被破坏并释放出DNA,然后采用分光光度计测定得到DNA的重量A,若其对应的体积为V毫升,则检测结果按SCC=A*λ/V进行计算。该方法显示出与标准显微镜检测较高的一致性,达0.997,具有比传统DNA原理方法如CMT、WMT等更高的精度。然而,其重现性以及DNA含量与体细胞数本身的相关性未见批露,同时由于DNA分离所固有的困难性,DNA含量的精确含量本身就带有很大的误差,目前仅在实验室验证了其可行性,难以在奶场或牛奶加工现场大规模应用。
4.1.4ATP法
ATP法(adenosine triphosphate, ATP)早期成功用于鲜肉、牛奶等领域的细菌检测中[25],后来被用于牛奶体细胞数的检测,其基本原理是利用体细胞内的ATP在荧光素酶的作用下,荧光素与ATP结合产生的荧光和ATP浓度成正比,由此可以通过测定荧光的强度来间接测定ATP的浓度,从而测定牛奶体细胞数[26-27]。文献[27]通过BLW0401微量光度计与显微镜检法进行对比试验,建立了荧光度与体细胞数的线性相关性,其相关性为0.905 6,初步验证了该方法的可行性,该方法不具重现性。
4.1.5EC法
电导率(electrical conductivity, EC)检测法的基本原理是奶牛乳房发生炎症时,所分泌乳汁的钠、氯、HCO3-离子的浓度增加,引起电导率的增加,而电导率与体细胞数之间存在着正相关性[28-30]。郭庆等[29]通过实验建立了电导率与体细胞数的拟合曲线关系:y=3.013x2-7.081x+9.306,y表示电导率,x表示体细胞数,其中体细胞计数与电导率测定仪器分别采用CMT奶牛乳房炎诊断试剂和CONscan 型数显电导率仪。方海田等[30]利用Bently-Somacount-150 型体细胞计数仪和DDS-11A型数显电导率仪分别测定给定奶样的体细胞计数与电导率,然后利用曲线拟合得到电导率与体细胞数之间的关系:y=0.5838Ln(x)+4.0807,其中y表示电导率,x表示体细胞数,Ln表示自然对数,其相关性达0.933 4。该方法操作虽然简单且有一定准确性,然而由于奶牛种属、年龄、胎次、温度、季节以及其他代谢疾病的影响,其电导率与体细胞数之间的正相关量化模型并不统一且不稳定,由此导致体细胞数存在较大差异[31],电导率目前主要用于定性检测奶牛乳腺炎。
4.1.6pH法
正常牛奶的pH值通常在6.5~6.8之间,然而随着体细胞数量的增加,其酸碱度值也可能超过7.0[32]。当奶牛发生乳腺炎时,毛细血管的渗透性增加,偏碱性的血液成分进入到牛奶中,从而导致牛奶的pH值增加[32]。测试时,通常采用溴百里酚蓝试剂,根据对应的1~4档颜色值,可区分出乳腺炎的程度或类型。Mijnen 等[33]认为pH法与SCC、电导率等方法之间相关性较弱,其检测价值有限。Marschke等[34]通过实验证明pH值对于从大范围中区分正常与非正常乳腺的敏感度均等。刘文进等[35]尝试建立体细胞数与pH值之间的定量关系,并在酒精阳性乳实验中给出了如表3所示的对应关系,该关系是否具有推广性有待进一步验证。郭庆等[36]则通过实验说明pH在6.5~6.8和6.8~7.0之间时,体细胞数的显著性差异较明显(P>0.05)。Tabidi 等[37]通过比较证明pH法在识别隐性乳腺炎方面其敏感度优于CMT方法。通过与CMT方法对比指出pH法是一种定性方法,该方法对于识别隐性乳房炎具有较好的敏感性,具有操作简单、可重复查看等优点,但与其他类型的乳房炎以及与牛体体细胞数之间的相关性较差。

表3 牛奶体细胞数与pH的对应关系[35]
4.1.7黏度法
与CMT、DNA法类似,黏度(Gel Formation)法的基本原理在于利用活性试剂促使体细胞释放出DNA之后,牛奶将变稠,体细胞越多,则释放的DNA越多,牛奶的黏度也越高,利用这种体细胞数与黏度之间的相关性,通过黏度值可测算其体细胞数[38]。唐平[39]通过实验初步建立了牛奶体细胞数与黏度、温度之间的线性关系如下:SCC=4.787 44×η+3.727 55×T-89.913 37,其中η表示黏度,可用黏度计进行测量,T表示温度,其自相关性系数达0.99以上(P<0.001),通过与直接镜检法的比较也无显著性差异。Atasever等[40]在实验中证明利用黏度方法测算体细胞数具有很高的重现性,然而与直接镜检法相比,则其相关性偏低(R=0.783,P<0.01)。黏度法具有简单方便的优点,但其对于精确测量体细胞数仍有较大的误差,且其取值受温度、种群等影响较大,适用于快速、粗略的体细胞数检测。
4.1.8REP法
介质在外加电场时会产生感应电荷而削弱电场,原外加电场(真空中)与介质中电场的比值即为相对介电常数(relative electric permittivity, REP),它与频率相关。利用REP法进行体细胞数检测的基本原理在于,具有完整细胞质的体细胞在低频电场下不容易极化,只具有较低的相对介电常数,但在某种特定频率的电场下会产生极化并具有较高的相对介电常数,而这种相对介电常数值会随着体细胞数的增加而增加,呈现一定的正相关关系[41-42]。Grillo等[43]通过2年的实验证明在温度为10 ℃~34 ℃、电压为100 mV以及电场频率为300 kHz的情况下,相对介电常数与SCC之间的正相关关系最佳(R=0.988 1),如式(1)所示,其中T表示温度,R表示在该环境下测得的相对介电常数。该方法与电导率法相比,具有较好的准确度与重现性,结果与直接镜检法具有良好的正相关性,尤其对于检测隐性乳腺炎时具有较低的假阳性和假阴性,但对于22 ℃~30 ℃时体细胞数在30万/mL左右时,其误差率将达到20%~30%。
(1)
4.1.9IRT法
红外热成像法(Infrared thermography,IRT)用于检测牛奶体细胞数的基本原理在于受感染的奶牛乳房表面温度与牛奶体细胞数存在着一定的正相关关系[44]。Polat等[45]通过实验建立了受感染奶牛乳房表面温度与体细胞数之间的计算模型:USST=32.12+0.49×ln(SCC),其中USST为表面温度,℃,SCC为体细胞数,单位为103mL-1,在其实验中,其相关性为R=0.85(P<0.000 1)。具体检测时,可使用红外热成像仪在大约1.5米的距离对奶牛乳房进行热成像,根据得到的温度值及其相关关系模型可估算出其SCC[46]。红外热成像法所检测表面温度与体细胞数的正相关性一般,以估算为主,尤其在SCC<40万mL-1时其相关性迅速下降,而其优点是操作简单方便,用于隐性乳腺炎的检测时准确度较高。
4.1.10其他检测法
崔传金等[47]基于神经网络建立了温度、电导率和电容等综合参数与体细胞数之间的预测模型,其正确检出率达到95%。吴海云等[48]以标准的碘酊染色显微镜体细胞计数结果为基准,采用支持向量回归的方法试图建立奶样电阻、电双层电容等电参数与体细胞数之间的预测模型,该模型对于1级、2级和3级乳腺炎的实验验证较准确,它为牛奶体细胞数在线检测提供了一种较新的思路,但对N级奶样的体细胞预测精度及检出正确度有待进一步研究与提高。
4.2直接检测法
间接检测方法主要是通过检测牛奶体细胞所具备的不同物理、化学特性值并通过它们与体细胞数量之间的相关关系式进行体细胞数估算,可以快速区分健康与患乳腺炎的奶牛,但对于详细区分乳腺炎奶牛的病症严重程度则作用有限。直接检测方法用于体细胞计数具有准确度高等优点。
4.2.1人工镜检法
人工镜检法是指直接采用显微镜观察载玻片上的牛奶样品并由人工对体细胞进行计数的方法[49],其基本步骤由如下几步构成[50]:(1)配置染色液,首先将54 mL乙醇和40 mL四氯乙烷混合摇匀并置于65 ℃的水溶液中加热3分钟,再加入0.6 g甲基兰,混匀降温至4 ℃,最后加入6 mL冰醋酸,常温保存;(2)用微量注射器将10 μL生鲜奶样注射到1 cm2的载玻片上,在恒温箱中放平、干燥,浸入染色液,最后形成均匀玻片;(3)利用300~500倍显微镜观察玻片上的染色细胞,根据一定的准则得到体细胞计数。将上述传统镜检法的染色液改成特制的荧光剂,则改进为荧光镜检法[51],由于荧光细胞与背景的对比更加明显,使体细胞计数实现更加容易。
人工镜检法依靠实验员通过显微镜观察载玻片中的奶样并得到其中的体细胞数量,具有较高的准确度,是标定其他体细胞计数方法、仪器的标准,但存在操作繁琐、劳动量太大等不足,适用于小样本的精确检测,同时由于奶样容易干燥等因素,重现性较差。
4.2.2电脉冲法
电脉冲法的基本原理是当新鲜奶样中的体细胞通过由2个电极构成的狭缝时,这2个电极之间的电阻值因为体细胞的存在而增加,电极之间的电压值随之加大并产生电脉冲,每通过一个体细胞也将产生一个电脉冲,利用相关仪器检测电脉冲的数量即可得到体细胞数[52]。电脉冲法检测时间短,结果与人工镜检法有着几乎一致的相关性[53],但该方法需要事先设定脉冲的临界值,且需较长时间的校正才能达到稳定测量。
4.2.3光脉冲法
光脉冲法的基本原理是首先用溴化乙锭(Ethidium bromide)等高灵敏度的荧光剂对鲜奶样品进行染色,然后在检测时让被染色的体细胞逐个通过一条流路缝隙,该缝隙被设计得足够小以使体细胞仅能一个一个通过,这些体细胞在通过流路时会被观察室的蓝光激发并发出红色光,它会被光电倍增器放大并作为光脉冲进行计数,从而实现牛奶体细胞数的检测[21,54]。光脉冲法具有速度快、重复性好等特点,适用于集中大样品检测,但其结果通常会比人工镜检法偏大[54]。
4.2.4计算机视觉镜检法
随着数字图像技术的发展,国内外开始寻求基于计算机视觉的体细胞数检测方案。G.L. Pettipher[55]早在1982年就提出了半自动的用于细胞计数的图像分析程序。Michael等[56]提出了几种自适应的细胞大小阈值选择算法。Gustavo J. Grillo等[57]提出了一种基于PC的低成本的视频显微镜系统,用于检测鲜牛奶中的体细胞数。J. S. Moon[51]利用数码显微镜采集到奶样图像,然后利用模式识别方法得到体细胞数。刘俊丽[58]认为图像处理在生物学和医学领域广泛应用,但是对牛奶的细胞图像的研究是目前图像处理中较新的课题之一。刘海霞[23]指出,牛乳中的细胞主要是体细胞,并提出一种基于图像连通判别的牛奶体细胞计数方法。薛河儒等[59]对牛乳体细胞彩色图像分割方法展开了研究,提出了基于数学形态学及融合技术的二维彩色图像分割方法,其不足之处在于牛奶涂片与成像方法、堆积细胞分离方法等缺乏有效处理。其中用到的细胞计数方法主要有连通计数法[60]、连通曲线计数法[61]。
5相关检测仪器的发展情况
目前, 在奶牛养殖场与牛奶加工厂中,牛奶体细胞计数主要依靠大型的体细胞计数仪完成,比较有代表性的产品包括采用电脉冲法的丹麦Foss公司的Fossomatic 5000系列体细胞分析仪[21]、荷兰Delta公司的Somascope计数仪[62]、美国Bentley公司的Somacount 150计数仪[51],等等;采用光脉冲法的有美国Bechman公司的库尔特计数仪(Coulter Somatic Cell Counter)[52]。这类仪器检测速度较快,准确率较高,但操作流程复杂,设备单价与使用成本均较高,同时,它们不是由形态学特点辨识各类白细胞,所以不能观察白细胞形态,也不能保留样本。另一方面,随着数字图像技术的发展,基于计算机视觉牛奶体细胞计数仪也陆续被开发出来,代表性产品如美国Bentley公司的Somacount 300计数仪[63]、瑞典的DeLaval计数仪(DeLaval Cell Counter)[64]、韩国C-reader体细胞计数仪CRP-200[51,65],这些仪器价格均较高。
集成间接检测法的整机计数仪目前较少,通常采用辅助仪器测量得到相应的理化特性值,然后通过相关性预测模型计算得到体细胞数,例如DNA法采用分光光度计测量DNA含量、ATP法利用微量光度计检测ATP光强、EC法利用电导率仪检测奶样的电导率、pH法利用溴百里酚蓝试剂检测pH值、黏度法采用黏度计检测奶样的黏度值、IRT法利用红外热成像仪检测奶牛乳房表面温度,等等。
我国对于显微细胞检测仪器的研制工作始于 20世纪60年代,主要集中在在血细胞方面[66],如1965年上海生产的第一代血球计数仪,上海XF503型、北京生化仪器厂的仿COULTERZF型、南京XF-1型、济南DXJ-1型等其他血球计数仪,这些都属于仅能计数红细胞和白细胞的仪器。牛奶体细胞数检测仪器的研制始于近几年,如牛博士快速检测仪[67],该仪器采用理化检测方法。
6小结
综上所述,牛奶体细胞数是体现奶源健康的重要指标,国内外研究者围绕着其意义、检测方法、检测仪器等展开了大量的研究。一方面,间接检测法与SCC之间的相关性较差,通常用于体细胞数的估算,而精确检测SCC有助于区分那些处于临界状态的奶牛健康情况,尤其有助于识别处于亚健康或隐性乳腺炎的奶牛,这对持续改善奶场管理具有重要意义;另一方面,基于电脉冲或光脉冲的牛奶体细胞计数仪虽然可实现体细胞数的精确计数,但这些仪器昂贵、操作成本高、结果无法复现;随着数字图像处理技术的发展,基于计算机视觉的牛奶体细胞检测的优点越来越明显,如操作简单、结果可重现、单次检测成本低、检测速度等,逐渐成为近十年来该领域的热点之一,国外虽有相应的仪器但价格昂贵,我国奶场主要依赖进口的电脉冲或光脉牛奶体细胞计数仪,因此,在这一新兴领域,我国急需加强研究以获得自主知识产权,而其关键是牛奶体细胞图像分割与识别的准确性、识别速度以及相应自动化检测仪器的研制。
参考文献:
[1]陈凤岐.牛奶体细胞数(SCC)的研究及其对我国乳业发展的影响[J].中国奶牛,2009(11):13-14.
[2]朱正鹏,单安山,薛艳林,等.牛乳体细胞数对牛奶品质的影响[J].中国畜牧杂志,2006,42(13):47-49.
[3]陈华林.体细胞数在奶牛乳房卫生保健工作中的作用[J].中国奶牛,2000(6):49-51.
[4]郝建国.日本学者对体细胞数与乳房炎关系的论述[J].中国奶牛,2002(1):52-54.
[5]敖晓琳,李诚.高体细胞牛乳的性质及对加工的影响[J].中国乳品工业,2003,31(5):38-41.
[6]Schalm O W, Noorlander B S. Experiments and observations leading to development of the california mastitis test[J]. Journal of the American Veterinary Medical Association, 1957, 130: 199-204.
[7]谢继志.液态乳制品科学与技术[M].北京:中国轻工业出版社,1999.
[8]张丹凤,王叶玲,陆东林.体细胞数(SCC)在奶牛生产中的应用[J].新疆畜牧业,2004(2):39-41.
[9]Jodie van Dieen. Symposium: 20 years Under the charter: The 20th Anniversary of the Charter: Developments in Criminal Law under Section 7 of the Charter[Z]. 21 Windsor Y.B. Access Just. 129, 2002.
[10]Green M J, Green L E, Schukken Y H,et al. Somatic cell count distributions during lactation predict clinical Mastitis[J].Journal of dairy science, 2004, 87(5): 1256-1264.
[11]Bradley J, Leach K A, et al. Survey of the incidence and aetiology of mastitis on dairy farms in England and Wales[J]. The Veterinary Record, 2007, 160: 253-258.
[12]Huston C L, Wittum T E,Love B C, et al.Prevalence of fecal shedding of Salmonella spp in dairy herds[J].Journal of the American Veterinary Medical Association, 2002, 220(5): 645-649.
[13]Ma Y, Ryan C, Barbano DM, et al. Effects of somatic cell count on quality and shelf-life of pasteurized fluid milk[J].Journal of Dairy Science, 2003, 83: 264-274.
[14]Sweetman W J.Dairy herd improvement by introducing high milk production into a herd of high testing cows[R].Alaska agricultural experiment station, University of Alaska, Bulletin 36, 1965: 1-16.
[15]杨晶, 孙珊珊, 王铁滨, 等. DHI 在牛场管理系统中的应用[J]. 电子测试, 2013(11): 57-58.
[16]Shook G E, Schutz M M. Selection on somatic cell score to improve resistance to mastitis in the United States [J]. Journal of dairy science, 1994, 77(2): 648-658.
[17]李英, 马亚宾. 奶牛 DHI 测定及其应用 (连载二) [J]. 北方牧业, 2013(9): 19.
[18]董德宽,陆静,刘德娟.关于牛奶中的体细胞[J].乳业科学与技术,2002(3):18-24.
[19]Poutrel B, Lerondelle C. Cell content of goat milk: California Mastitis Test, Coulter Counter, and Fossomatic for predicting half infection[J]. Journal of Dairy Science, 1983, 66(12): 2575-2579.
[20]Thompson D I, Postle D S.The Wisconsin mastitis test-an indirect estimation of leucocytes in milk[J].Journal of milk food technology, 1964, 27: 271-275.
[21]Gonzalo C, Martinez J R. Fossomatic cell-counting on ewe milk: comparison with direct microscopy and study of variation factors [J]. Journal of Dairy Science, 2003, 86(1): 138-145.
[22]Janzen J J. Comparison of microscopic counting techniques for estimation of leucocyte concentrations in milk [J]. Journal of Dairy Science, 1968, 51(11): 1857-1858.
[23]刘海霞.牛乳体细胞数的检测方法[J].中国乳品工业,2004, 32(6):31-34.
[24]Urbanová E, Sedinová V, Skarda J, et al. Use of the Synpor membrane filter for the separation and determination of the number of somatic cells in the milk of dairy cows using the indole DNA filtration method [J]. Veterinarni medicina, 1985, 30(7): 409-418.
[25]Sharpe A N, Woodrow M N, Jackson A K. Adenosine triphosphate (ATP) levels in foods contaminated by bacteria [J]. Journal of Applied Microbiology, 1970, 33(4): 758-767.
[26]Pyorale S.Indicators of inflammation in the diagnosis of mastitis [J]. Veterinary Research, 2003, 34(5): 565-578.
[27]管勇佳, 富鑫, 陈晓义, 等. ATP 生物发光技术快速检测牛乳体细胞数[J]. 中国乳品工业, 2010 (9): 49-50.
[28]Norberg E, Hogeveen H, Korsgaard I R, et al. Electrical conductivity of milk: ability to predict mastitis status [J]. Journal of dairy science, 2004, 87(4): 1099-1107.
[29]郭庆, 王鲁, 朱伟, 等. 牛乳电导率值与体细胞数相关性的研究[J]. 贵州畜牧兽医, 2009, 33(5): 1-3.
[30]方海田, 刘慧燕. 牛乳乳汁电导率变化与体细胞数相关关系的研究[J]. 现代食品科技, 2007, 23(4): 86-88.
[31]Fosgate G T, Petzer I M, Karzis J. Sensitivity and specificity of a hand-held milk electrical conductivity meter compared to the California mastitis test for mastitis in dairy cattle [J]. The Veterinary Journal, 2013, 196(1): 98-102.
[32]Pendse M D, Nair P G. The development and evaluation of a test for subclinical mastitis [J]. Indian Journal of Dairy Science, 1970, 23(1): 7-11.
[33]Mijnen E, Jaartsveld F H J, Albers G A A, et al. The value of cell count, lactose content, pH and conductivity of milk for mastitis detection in individual cows [J]. Netherlands Milk and Dairy Journal, 1983, 37.
[34]Marschke R J, Kitchen B J. Detection of bovine mastitis by bromothymol blue pH indicator test [J]. Journal of dairy science, 1985, 68(5): 1263-1269.
[35]刘文进, 陈创夫, 滕文军, 等. 患隐性乳房炎的奶牛乳汁 pH 值变化与体细胞关系的研究 [J]. 家畜生态学报, 2005, 26(3): 63-67.
[36]郭庆, 王鲁, 朱伟, 等. 牛乳电导率和 pH 值变化与体细胞数相关性的研究[J]. 中国奶牛, 2009 (9): 38-40.
[37]Tabidi M H, Musa H H, Mukhtar M A. Detection of pH indicator paper of bovine mastitis in comparison with California mastitis[J]. Lucrari Stiintifice-Universitatea de Stiinte Agricole a Banatului Timisoara, Medicina Veterinara, 2013, 46(3): 157-163.
[38]Nageswararao G, Derbyshire J B. Studies on the mechanism of gel formation in the California mastitis test reaction [J]. Journal of Dairy Research, 1969, 36(03): 359-368.
[39]唐平. 牛奶体细胞快速检测方法的研究[D]. 杭州: 浙江大学, 2006.
[40]Atasever S, Erdem H, Kul E. Using Viscosity Values for Determining Somatic Cell Count in Cow Milk [J]. Asian Journal of Animal & Veterinary Advances, 2012, 7(5): 1-5.
[41]Asami K, Hanai T, Koizumi N. Dielectric approach to suspensions of ellipsoidal particles covered with a shell in particular reference to biological cells [J]. Japanese Journal of Applied Physics, 1980, 19(2): 359-365.
[42]Marks G H, Davey C L, Kell D B. The dielectric permittivity at radiates frequencies and the Bruggeman I proved: beginner techniques for the on-line determination of biomass concentrations in plant cultures [J]. Journal Biotechnology, 1991, 20: 279-290.
[43]Grillo G J, Perez M A, Anton J C, et al. Direct-evaluation of the fresh-milk somatic cell concentration (scc) through electrical permittivity measurements [A]. Proceedings of the 19th IEEE conference on Instrumentation and Measurement Technology[C]. 2002, 1: 153-157.
[44]Colak A, et al. Short communication: early detection of mastitis using in frared thermography in dairy cows [J]. Journal of dairy science, 2008, 91: 4244-4248.
[45]Polat B, Colak A, Cengiz M, et al. Sensitivity and specificity of infrared thermography in detection of subclinical mastitis in dairy cows[J]. Journal of dairy science, 2010, 93(8): 3525-3532.
[46]Martins R F S, do Prado Paim T, de Abreu Cardoso C, et al. Mastitis detection in sheep by infrared thermography [J]. Research in Veterinary Science, 2013, 94(3): 722-724.
[47]崔传金, 古少鹏, 左月明. 基于电参数与神经网络的奶牛乳腺炎检测方法[J]. 农业机械学报, 2011, 42(1): 193-197.
[48]吴海云,左月明,崔传金,等.基于电参数和支持向量回归的牛奶体细胞数定量检测[J].农业机械学报,2012,43(8):164-169.
[49]Keisler D H, Andrews M L, Moffatt R J. Subclinical mastitis in ewes and its effect on lamb performance[J].Journal of animal science, 1992, 70(6): 1677-1681.
[50]丘通强, 林少宝, 吴焕贞.鲜牛乳中体细胞数检测方法探讨[J].现代食品科技, 2005, 21(2): 158-160.
[51]Moon J S,et al. Park. Application of a new portable microscopic somatic cell counter with disposable plastic chip for milk analysis[J].Journal of Dairy Science, 2007, 90(5): 2253-2259.
[52]Zhe J, et al. A micromachined high throughput Coulter counter for bioparticle detection and counting [J]. Journal of Micromechanics and Microengineering, 2007, 17(2): 304-313.
[53]Miller R H, Paape M J, Acton J C. Comparison of milk somatic cell counts by Coulter and Fossomatic counters[J]. Journal of dairy science, 1986, 69(7): 1942-1946.
[54]刘广胜,陈敏,陈鹏.FossMatic 5000检测牛乳体细胞[J].中国乳品工业,2005,33(4):60-61.
[55]Pettipher G L,Rodrigues U M. Semi-automated counting of bacteria and somatic cells in milk using epifluorescence microscopy and television image analysis[J].Journal of Applied Bacteriology, 1982, 53(3): 323-331.
[56]Sieracki M E, Reichenbach S E, Webb K L. Evaluation of automated threshold selection methods for accurately sizing microscopic fluorescent cells by image analysis[J].Applied and Environmental Microbiology, 1989, 55(11): 2762-2772.
[57]Grillo G J, Perez M A, Baro J A, et al. Video-microscopy as an Alternative Method for Evaluation of Somatic Cell Count[A].IEEE Conference on Instrument and Measurement Technology[C].Ottawa, Canada, 17-19 May, 2005.
[58]刘俊丽.牛乳体细胞图像处理及计数方法的研究[D].呼和浩特:内蒙古农业大学,2007.
[59]薛河儒.牛乳体细胞彩色图像分割方法的研究[D].呼和浩特:内蒙古农业大学,2007.
[60]戴静,穆平安,载曙光.图像法确定培养液中细胞个数的研究[J].仪器仪表学报,2002,23:186-188.
[61]周莹莉,曾立波,刘均堂,等.基于图像处理的菌落自动计数方法及其应用[J].数据采集与处理,2003,18(4):460-464.
[62]Kromkerv, Grabowski N T, Friedrich J. New infection rate of bovine mammary glands after application of an internal teat seal at dry-off[J]. Journal of Dairy Research, 2014, 81(01): 54-58.
[63]Blagitz M G, Souza F N, Batista C F, et al. Clinical findings related to intramammary infections in meat-producing ewes[J]. Tropical animal health and production, 2014, 46(1): 127-132.
[64]Kawai K, Hayashi T, Kiku Y, et al. Reliability in somatic cell count measurement of clinical mastitis milk using DeLaval cell counter [J]. Animal Science Journal, 2013, 84(12): 805-807.
[65]Bae S Y, Lee C H, Kim J S, et al.Portable microscopic cell counter for the determination of residual leucocytes in blood components[J].Vox sanguinis, 2007, 92(1): 64-68.
[66]张时民.血细胞分析仪50年的发展历史和展望[J].临床检验及实验室设备,2004,6(4): 27-30.
[67]贾原,薛振卫,温文弛.中药复方制剂在奶牛乳房炎综合防控中的应用效果研究[J].中国乳业,2011,118:32-35.
Review on Detection of Milk Somatic Cell Count
Yan Jianjun1, Gao Yan2,Gao Fei2
(1.Ningbo Research Institute of Measurement and Test, Ningbo315048, China;2.College of Computer Science and Technology, Zhejiang University of Technology, Hangzhou310023, China)
Abstract:Rapid detecting milk somatic cell count is important and meaningful for guaranteeing quality of milk and monitoring health of dairy cow. First, the detection of milk somatic cell count was reviewed from five aspects including concept of milk somatic cell count, influence of somatic cell count upon milk, research progress of milk somatic cell count, method of detecting milk somatic cell count and relevant detecting instrument. Second, advantages and disadvantages of current detecting methods were discussed and compared. Finally, detecting milk somatic cell count based on computer vision was pointed out as a research trend of which the key is to segment and identify the cells rapidly and concisely and develop the relevant detecting instrument.
Keywords:somatic cell count; computer vision; image processing; detecting instrument
文章编号:1671-4598(2016)02-0005-06
DOI:10.16526/j.cnki.11-4762/tp.2016.02.002
中图分类号:TP311
文献标识码:A
作者简介:严建军(1966-),男,浙江余姚人,本科,高工,主要从事电子测量技术方向的研究。
基金项目:国家自然科学基金资助项目(12412135);浙江省自然科学基金资助项目(LY13F020029, LQ14F020004);宁波市重点科技计划项目(2013C11032)。
收稿日期:2015-08-22;修回日期:2015-09-20。
高飞(1974-),男,四川邻水人,博士,教授,主要从事计算机视觉与图像处理方向的研究。

