金钗石斛总生物碱对Aβ25-35所致大鼠海马组织Aβ含量的影响
张明辉,李 菲,张 玮,吴 芹,石京山
(遵义医学院 药理学教研室暨基础药理省部共建教育部重点实验室,贵州 遵义 563099)
基础医学研究
金钗石斛总生物碱对Aβ25-35所致大鼠海马组织Aβ含量的影响
张明辉,李菲,张玮,吴芹,石京山
(遵义医学院 药理学教研室暨基础药理省部共建教育部重点实验室,贵州 遵义563099)
[摘要]目的 观察金钗石斛总生物碱(Dendrobium nobil Lindl. Alkaloids, DNLA)对β-淀粉样蛋白(Aβ25-35)诱导的大鼠痴呆模型海马组织Aβ含量的影响。方法 雄性Sprague-Dawley大鼠随机分为4组:假手术组、模型组、DNLA低剂量(40 mg/kg/d)及高剂量组(80 mg/kg/d)。预给药7 d后,双侧海马注射 Aβ25-35(1 μg/μL, 5 μL),假手术组注射同体积生理盐水,术后继续灌胃14 d,Morris水迷宫检查大鼠空间学习成绩, Western blot法检测海马组织Aβ1-42含量,β淀粉样前体蛋白(APP)和β淀粉样蛋白前体蛋白裂解酶1(BACE1)的蛋白表达。结果 双侧海马注射Aβ25-35后,模型组大鼠空间学习成绩明显比假手术组差,给予DNLA后可改善大鼠空间学习成绩;模型组大鼠海马Aβ1-42、APP和BACE1蛋白量均明显高于假手术组;与模型组比较,DNLA给药可明显减少海马组织Aβ1-42的含量,降低APP和BACE1蛋白在海马组织的表达(P<0.05)。结论 DNLA具有改善Aβ25-35所致大鼠痴呆模型的作用,可能与减少海马组织Aβ1-42产生有关。
[关键词]金钗石斛总生物碱;β-淀粉样蛋白;β淀粉样前体蛋白;β淀粉样蛋白前体蛋白裂解酶1;大鼠
阿尔茨海默病(Alzheimer’s disease, AD)是一种进行性中枢神经系统退行性疾病,主要病理学特征为细胞外β淀粉样蛋白(β-amyloid, Aβ)沉积、细胞内tau蛋白过度磷酸化等[1]。减少AD患者脑中Aβ含量一直是AD治疗学的研究重点和热点。
我国名贵中药材金钗石斛(DendrobiumnobilLindl.)具有“壮筋骨,补肾益力”等功效,其主要化学成分包括生物碱、多糖、酚类、挥发油等[2-3]。本课题组前期研究发现金钗石斛总生物碱(DendrobiumnobilLindl. Alkaloids, DNLA)具有降低AD模型大鼠海马神经元内tau蛋白异常磷酸化的作用[4],然而是否能够降低AD脑中Aβ的含量仍不清楚,故本研究拟采用Aβ25-35诱导AD大鼠模型,观察DNLA对该模型大鼠空间学习的作用及脑内Aβ产生的影响。
1材料与方法
1.1实验动物SPF级Sprague-Dawley (SD)大鼠,雄性,体重250~300 g购自第三军医大学大坪实验动物中心[合格证号:SCXK(渝)2012-0005]。
1.2主要试剂及仪器设备金钗石斛总生物碱采用醇提毛细管气象色谱法分析,根据对应的标准离子色谱峰检测生物碱的百分比,总生物碱纯度71.2%,其中主要为石斛碱(90.7%),石斛次碱次之。
Aβ25-35:美国Sigma公司;APP抗体:美国Abcam公司;Aβ1-42、BACE1、β-actin抗体:life sciences公司;BCA蛋白含量测定试剂盒:上海捷瑞生物工程有限公司;ECL发光剂:江苏碧云天生物技术研究所;大鼠脑立体定位仪:深圳瑞沃德生命科技有限公司;全自动凝胶图像分析仪:美国BIO-RAD公司。
1.3动物分组及处理SD大鼠40只随机分为4组,分别为假手术组、模型组、DNLA低剂量组和DNLA高剂量组。假手术组及模型组灌胃生理盐水10 mL/kg/d、DNLA低、高剂量治疗组分别灌胃DNLA(40、80 mg/kg/d),预给药1周后制模。采用7%水合氯醛(5 mL/kg)腹腔注射麻醉后固定于大鼠脑立体定位仪上,常规皮肤消毒切开头部皮肤,海马进针坐标为:前囟后3.5 mm,中线旁2.0 mm,硬脑膜下3.5 mm(根据大鼠脑立体定位图谱确定)。定位后用牙科钻钻开颅骨,微量注射器垂直进针,双侧海马缓慢注入5 μL Aβ25-35(1 μg/μL,无菌生理盐水配制,37 ℃孵育7 d使成聚集态),留针5 min,缓慢退出注射器后缝合皮肤切口,假手术组注入等体积无菌生理盐水,制模后继续给药2周。
1.4Morris水迷宫检测大鼠空间学习能力给药结束前4 d,行Morris水迷宫实验。该系统由水池、摄像头和电脑3部分组成,水池直径120 cm,水深为平台上2 cm。固定水下平台的位置,记录大鼠从不同入水点至找到平台所需时间(即逃避潜伏期),以比较各组大鼠空间学习的能力,每天4次,连续4 d。
1.5Western blot法检测蛋白含量行为学实验结束后,各组大鼠麻醉后断头于冰上迅速分离海马组织,提取组织总蛋白,BCA法测定蛋白浓度。总蛋白经PAGE凝胶电泳分离后转至PVDF膜上,孵育Aβ1-42、APP、BDNF抗体,ECL发光,凝胶成像系统拍照分析。
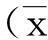
2结果
2.1DNLA对大鼠空间学习能力的影响各组大鼠的学习成绩随着训练天数逐渐变好,训练至第3~4天各组数据出现差异,模型组大鼠逃避潜伏期明显长于假手术组,而给予DNLA后可缩短逃避潜伏期(P<0.05,见图1)。
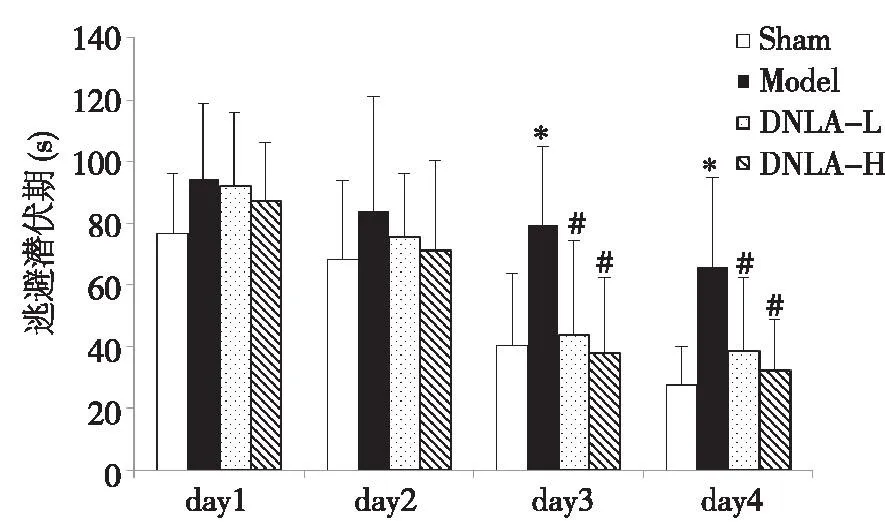
。图1 金钗石斛总生物碱对大鼠空间学习的影响
2.2DNLA对大鼠海马组织Aβ1-42含量的影响双侧海马注射聚集态Aβ25-352周后大鼠海马组织内Aβ1-42的含量显著增加(P<0.05)。给予DNLA 3周可明显降低模型大鼠海马组织内Aβ1-42的含量(P<0.05,见图2)。
2.3DNLA对大鼠海马组织APP和BACE1蛋白表达的影响为分析DNLA降低模型大鼠海马组织Aβ含量的机制,本研究观察了淀粉样前体蛋白(amyloid precursor protein, APP)及与Aβ产生密切相关的酶BACE1的蛋白表达水平。结果表明,模型大鼠海马组织内APP和BACE1蛋白表达水平均高于假手术组(P<0.05),而给予DNLA后均可降低其蛋白的表达水平(P<0.05),提示DNLA可通过减少Aβ的产生从而降低海马组织中Aβ1-42的含量(见图3)。
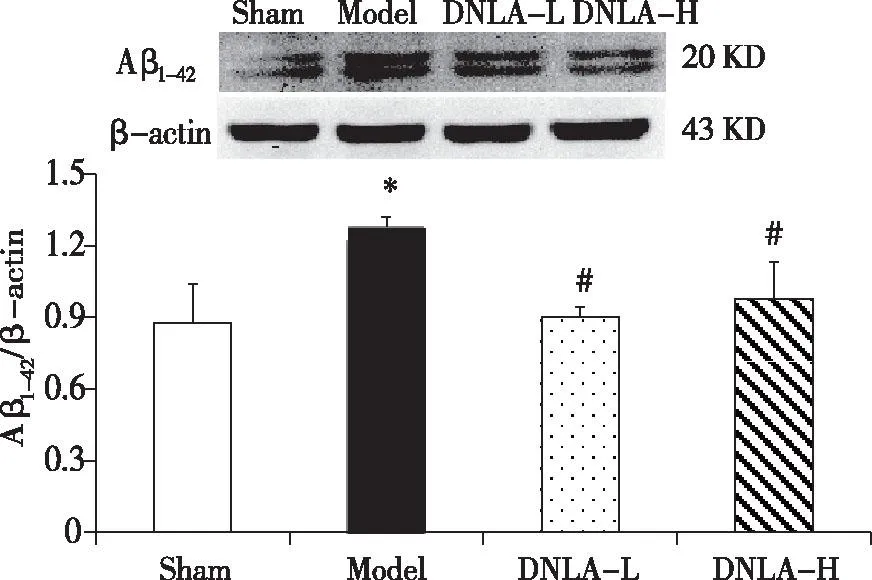
±s,n=9; *:P<0.05 vs Sham; #: P<0.05 vs Model。 图2 金钗石斛总生物碱对大鼠海马组织Aβ1-42含量的影响

±s, n=9; *:P<0.05 vs Sham; #: P<0.05 vs Model。图3 金钗石斛总生物碱对大鼠海马组织APP和BACE1蛋白表达的影响
3讨论
研究发现,Aβ25-35聚集可激活胶质细胞产生大量炎症因子,导致神经细胞损伤甚至死亡[5-6]。采用海马内注射聚集态Aβ25-35,诱发脑内炎症[7]及神经细胞损伤[8]模拟AD的动物模型已广泛用于AD的研究。在AD病理情况下,APP主要经β-分泌酶和γ-分泌酶剪切产生39-43个氨基酸的Aβ片段[9-10],其中Aβ1-42聚集性最强,最具神经细胞毒性。Aβ1-42聚集与AD 患者脑中神经元的变性密切相关,因此抑制Aβ1-42产生与聚集可防止AD的发生。本实验结果显示,大鼠双侧海马注射聚集态的Aβ25-35后2周,大鼠空间学习能力下降,同时海马组织中Aβ1-42和APP水平明显高于对照组,给予DNLA后,明显改善模型大鼠的空间学习成绩,并降低模型大鼠海马Aβ1-42和APP的蛋白水平。
β-分泌酶是Aβ产生的关键限速酶,体内主要的β分泌酶是β淀粉样前体蛋白裂解酶1(β-site APP cleaving enzyme, BACE1)。其活性的高低对Aβ的产生有重要作用[11-13]。研究发现,在过度表达BACE1的APP转基因动物模型中,Aβ的产生显著增多[14];而在敲除BACE1基因的动物模型中Aβ几乎完全消失[15]。通过抑制BACE1以降低脑内Aβ水平,被认为是防治AD的一个有效靶点。本实验结果显示模型组大鼠海马组织内的BACE1蛋白水平明显高于假手术组,各DNLA给药组大鼠海马内BACE1的蛋白表达量均显著低于模型组,提示DNLA具有抑制BACE1蛋白高表达的作用。
我们先前的研究发现DNLA能减轻AD的两大特征性病理变化:减轻AD样炎症模型大鼠海马tau蛋白磷酸化、抑制海马周围神经细胞凋亡[4];本次结果提示DNLA改善Aβ25-35诱导的大鼠空间学习能力,减少模型大鼠海马组织Aβ1-42的含量,揭示DNLA极有可能是防治AD的中药有效成分,为深入研究DNLA抗AD提供了基础。
[参考文献]
[1] Torreilles F, Touchon J. Pathogenic theories and intrathecal analysis of the sporadic form of Alzheimer’s disease[J]. Prog Neurobiol,2002, 66(3):191-203.
[2] 钱桂敏, 张华波. 金钗石斛化学成分及药理作用研究进展[J]. 中国中医药现代远程教育, 2011, 9(4): 194-196.
[3] 欧焕娇, 詹若挺, 成金乐, 等. 金钗石斛化学成分和药理作用的研究进展[J]. 现代中药研究与实践, 2010, 24(6): 84-86.
[4] Yang S, Gong Q, Wu Q, et al. Alkaloids enriched extract fromDendrobiumnobileLindl. attenuates tau protein hyperphosphorylation and apoptosis induced by lipopolysaccharide in rat brain[J]. Phytomedicine, 2014, 21(5): 712-716.
[5] Berk M, Dean O, Drexhage H, et al.Aspirin:A review of its neurobiological properties and therapeutic potential for mental illness[J]. BMC Med,2013,11(1):74-76.
[6] Hernandez-Ontiveros D G, Tajiri N, Acosta S, et al. Microglia activation as a biomarker for traumatic brain injury[J]. Front Neurol, 2013(4): 30.
[7] 金凤, 陈晨, 金海, 等. 淫羊藿苷通过抑制TNF-α, IL-6和caspase-3的表达改善Aβ25-35诱导的阿尔采末病大鼠空间学习记忆能力[J]. 中国新药与临床杂志, 2013, 32(10): 833-837.
[8] 聂晶, 罗勇, 石京山, 等. 淫羊藿苷对Aβ25-35所致神经细胞损伤的保护作用研究[J]. 遵义医学院学报, 2007, 30(3): 229-235.
[9] Finder V H, Glockshuber R. Amyloid-beta aggregation[J]. Neurodegener Dis, 2007, 4(1): 13-27.
[10]Jarrett J T, Lansbury P T J. Seeding “one-dimensional crystallization” of amyloid: a pathogenic mechanism in Alzheimer's disease and scrapie?[J]. Cell, 1993, 73(6): 1055-1058.
[11]Li R, Lindholm K, Yang L B, et al. Amyloid beta peptide load is correlated with increased beta-secretase activity in sporadic Alzheimer's disease patients[J]. Proc Natl Acad Sci USA, 2004, 101(10): 3623-3637.
[12]Fukumoto H, Rosene D L, Moss M B, et al. Beta-secretase activity inreeases with aging in human, monkey, and mouse brain[J]. Am J Pathol, 2004, 164(2): 719-725.
[13]Ahmed R R, Holler C J, Webb R L, et al. BACE1 and BACE2 enzymatic activities in Alzheimer’s disease[J]. J Neurochem, 2010, 112(4): 1045-1053.
[14]Bodendorf U, Danner S, Fischer F, et al. Expression of human beta-secretase in the mouse brain increases the steady-state level of beta-amyloid[J]. J Neurochem, 2002, 80(5): 799-806.
[15]Vassar R. BACE1: the beta-secretase enzyme in Alzheimer’s disease[J]. J Mol Neurosci, 2004, 23(1-2): 105-114.
[收稿2015-11-23;修回2015-12-29]
Effect ofDendrobiumnobilLindl. Alkaloids on the product of Aβ in hippocampus of rats induced by Aβ25-35
ZhangMinghui,LiFei,ZhangWei,WuQin,ShiJingshan
(Department of Pharmacology, Key Laboratory for Basic Pharmacology of Ministry of Education, Zunyi Medical University, Zunyi Guizhou 563099, China)
[Abstract]Objective To observe the effect of Dendrobium nobil Lindl. Alkaloids (DNLA) on the production of β-amyloid (Aβ1-42) in hippocampus of rats induced by Aβ25-35. Methods Forty Sprague-Dawley rats were randomed into four groups: sham, model, DNLA 40 mg/kg/d and 80 mg/kg/d groups. Rats were orally pre-treated with different doses of DNLA for 1 week, and then model rats were injected 5 μl Aβ25-35(1 μg/μl) into the lateral hippocampus, sham rats were injected equal volume of normal saline instead of Aβ. After operation rats were given DNLA or distill water for another 2 weeks. Morris water maze was used to test the spatial learning performance of rats; the content of Aβ1-42and the protein expression of β-amyloid precursor protein (APP) and β-site amyloid precursor protein-cleaving enzyme 1 (BACE1) in hippocampi were assayed by western blot. Results After injecting Aβ25-35into hippocampus, model rats decreased the spatial learning capability compared with sham rats, rats treated with DNLA significantly improved the performance. The content of Aβ1-42and the protein expression of APP and BACE1 in hippocampus of model rats were significantly increased. However, the content of Aβ1-42and the protein expression of APP and BACE1 were reduced in the hippocampi of DNLA-treated rats. Conclusion DNLA could ameliorate the spatial learning performance of Aβ25-35induced AD rat model, and this effect may be related to decreases in generation of Aβ1-42.
[Key words]Dendrobium nobil Lindl. Alkaloids; β-amyloid; β-amyloid precursor protein; β-site amyloid precursor protein-cleaving enzyme 1; rats
[中图法分类号]R285.5
[文献标志码]A
[文章编号]1000-2715(2016)01-0018-04
[通信作者]石京山,男,博士,教授,博士生导师,研究方向:神经药理学,E-mail:shijs@zmc.edu.cn。
[基金项目]国家自然科学基金资助项目(NO:30660208);贵州省科技基金资助项目(NO:黔科合JZ字[2014]2016);贵州省教育厅自科项目(NO:黔教科2010043);遵义医学院院招标课题基金项目(NO: F-612)。

