功能近红外光谱在大脑成像中的研究及应用
陈兴稣,王雪峰,,王元庆
功能近红外光谱在大脑成像中的研究及应用
陈兴稣1,王雪峰1,2,王元庆2
(1. 伊犁师范学院 电子与信息工程学院,新疆 伊宁 835000;2. 南京大学 电子科学与工程学院,江苏 南京 210046)
近红外光谱的650~1000nm是大脑成像的“光学窗口”,功能近红外光谱技术对大脑成像具有非侵入、无需注射造影剂、成本低和方便等优点,被应用于脑成像。概述了近红外光谱在大脑成像中的原理、方法及发展,总结分析了功能近红外光谱技术对大脑探测在提高系统分辨率方法的3个主要阶段,提出了存在的问题和发展前景。
功能近红外光谱;大脑成像;多通道探测;高密度探测
0 引言
近红外光谱(near infrared spectroscopy, NIRS)是介于可见光和中红外光之间的电磁辐射波,波长范围大概在650~1000nm。生物组织在近红外波段呈现低吸收、高散射的特性[1],近红外光谱技术对生物组织体具有一定的穿透能力,可以到达组织体几厘米的深度。生物组织中有与氧代谢密切相关的色团,如血液中的含氧血红蛋白(oxyhemoglobin, HbO2)和脱氧血红蛋白(de-oxyhemoglobin, HbR)等,这些物质对近红外波段光谱的吸收具有差异性,近红外光谱技术就是通过测定目标生物组织中的血氧浓度及局部血容量的变化,来完成对大脑等生物组织体的检测。
功能近红外光谱技术的应用非常广泛,不仅可以对大脑进行探测[2-5],还有像中医领域的探测[6]以及热像检测技术[7]和各种其他的检测应用[8-10]。
1 近红外光谱技术
功能近红外光谱(functional near-infrared spectroscopy, fNIRS)在大脑成像领域经历了20多年的发展,对大脑主要进行组织血氧结合和血液动力学的探测。1992年首次使用功能近红外光对大脑进行研究,其中有4个研究机构,Chance等[11-14]在1993发表了相应的研究成果。1998年,MEEK[15]等人首次开发了商业使用的单通道连续光系统,并对3~14周的婴儿进行了大脑观测实验。
功能近红外光谱技术有3种主要的方法[16-18]:连续波谱方式(CW,continuous wave)、时域波谱方式(TD, time domain)和频域波谱方式(FD, frequency domain)。
1.1 连续波近红外光谱技术(CW-NIRS)
连续波谱法是最早使用的方法,也是最简单的方法,是指采用连续的光源或者在一个调制频率较低(几kHz)的光源探测大脑,光进入大脑后,经过不断的吸收和散射,光强会减弱,探测器接收携带信息的光强信息。这种测量方式的优点是光源系统简单、测量方便、获取时间短。缺点是不能完全测量到组织体的光学参数(吸收系数和散射系数),因此不能定量的得到HbO2和HbR的值。但是依然可以分析它们的变化情况。
1.2 时域近红外光谱技术(TD-NIRS)
时域光谱技术是采用一个超快(皮秒级或飞秒级)的脉冲光源,出射光相对于入射光的脉冲会在时间上有一个很大的展宽,这个展宽就是时域光测量方式的时间扩展,通常采用同步超高速摄像机或时间相关单光子计数测量(TCSPC)系统记录透射光随时间变化的曲线,与漫射理论给出的前向解进行最佳匹配。这种测量方式的优点是信噪比高、灵敏度高、线性度好、时间分辨率高。缺点是系统要求较高、复杂,由于需要测量超短激光脉冲(皮秒或飞秒级)的时间响应,对于测量系统精度要求很高。
1.3 频域近红外光谱技术(FD-NIRS)
频域光谱技术是指采用幅度和相位调制的(正弦波,频率为几百MHz)光源,探测后的光会保持原有的调制频率不变,但其幅值和相位会改变。它的理论基础是通过测量调制后波形在入射处与出射处之间的相位移,得到光子密度波的传输延时。这种测量方式的优点是数据读取时间短,与连续光测量方式相当。缺点是由于系统的相位角的变化延迟很小,需要高精度的测量仪器来测量相位角的变化,搭建系统价格昂贵。而且由于光源是高频调制实现的,容易受到噪声影响且技术上难于实现。
2 功能近红外光谱发展阶段
功能近红外光谱对大脑的探测技术,从提高分辨率的方向看可以分成3个主要阶段,前期的单点探测、后来发展的多通道探测以及现在提出的高密度探测,这3个阶段的发展由图1[17]所示。早期的单点探测系统设备简单,获取数据量小,需要多次试验,分辨率也较低;多通道探测设备较复杂,一次试验就可以获取大量数据,需要进行简单分析,分辨率得到提高;高密度探测系统复杂,一次试验获取高密度的数据量,需要进行复杂的分析以及相应的重建算法,绘制大脑多个区域图像。
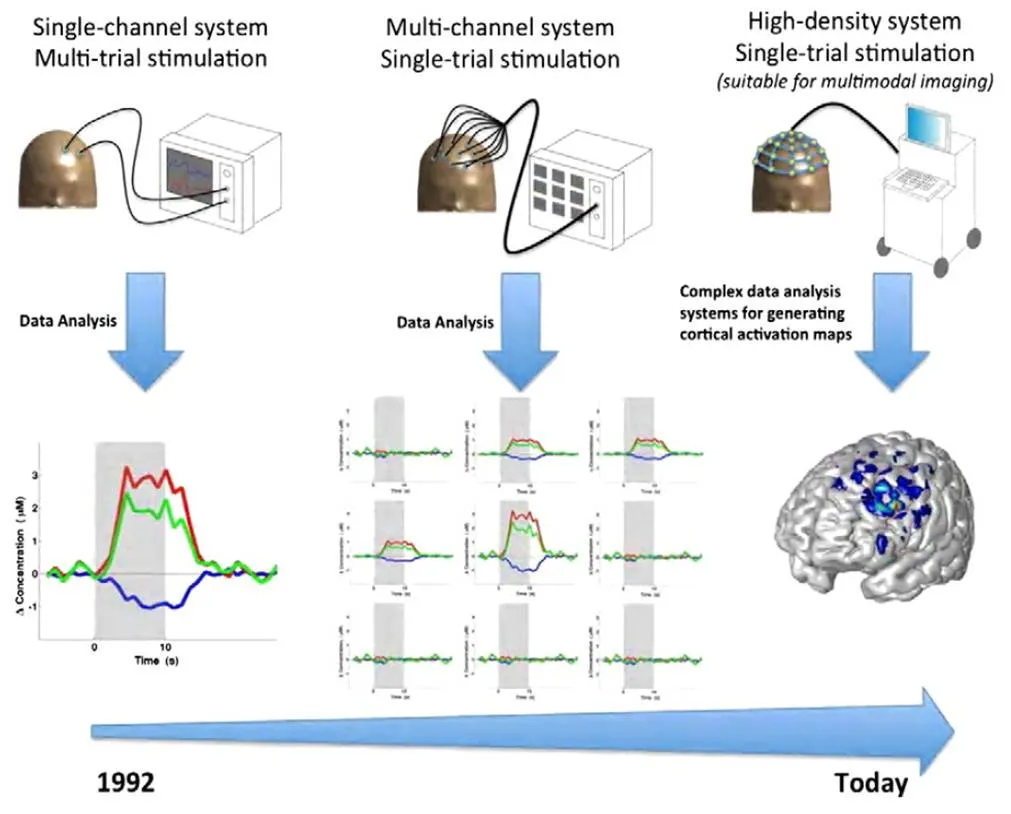
图1 功能近红外光谱技术在提高分辨率的3个主要阶段
2.1 单点探测阶段
早期的功能近红外光谱技术对大脑的探测,使用单点探测技术,即每次只探测大脑皮层区域的一个点,光源通过光纤照射一个点,探测器在光源点附近接收一个点的信息。这样获得的信息量很小,并且需要多次探测,最终只能获取简单的变化轮廓曲线。
1)成人大脑探测
第一个单通道近红外成人大脑研究设备,在1991年到1992年底进行了研究,并在1993年由4个研究机构发表研究结果:①日本北海道大学(Hokkaido University);②东京国家神经科学研究(Tokyo National Institute of Neuroscience);③德国慕尼黑大学(University of Munich);④宾夕法尼亚大学(University of Pennsylvania)。
日本北海道大学Hoshi和Tamura[11]的研究获取了14个志愿者的双边前额皮层的血氧含量的变化情况,使用单通道2个连续波系统OM-100A。Okada等人在1993年继续研究了对于具有左右手习惯不同的72个志愿者的血氧变化情况。
德国慕尼黑大学Villringer等[14]使用NIRO-500系统对12个测试者进行了认知激励,发现有10个受试者的前额区出现了HbO2含量的增加。
宾夕法尼亚大学的Britton Chance[12]教授在1992年提出了不同的功能近红外光谱技术,证明了认知激励下的双边前额皮层的变化在光吸收的低频调制,利用了简单的连续波单通道探测模型,观测到血氧含量的变化与大脑的活动有关。Britton Chance教授是著名的生物学家,并在后来的NIRS/fNIRS研究中起到重要的作用。
Hoshi和Tamura在1993年使用5个单通道设备对不同的大脑皮层区域进行了探测,同时探测到了HbO2和全血红蛋白(HbT)含量增加,通过不同的任务刺激,大脑HbO2的含量不同。1995年Maki[19]等人使用频域编码方式解决了不同通道之间的干扰。
2)婴儿大脑探测
第1个单点近红外光谱技术婴儿大脑研究是在1998年,英国伦敦大学学院Meek等[15]研制了第一台应用婴儿大脑监测的近红外系统。使用单通道NIRO-500设备对清醒婴儿头部的脑皮层的HbO2进行了探测。2001年Zaramella等人[20]在听觉皮层进行激励来探测基本的大脑皮层区域变化;接下来许多研究者使用更复杂的激励方法对婴儿脑皮层进行探测。
3)临床实验
第1个单点近红外光对大脑的临床研究在1994年[21],日本北海道大学使用NIRO-1000连续波系统,对38位患有慢性精神分裂症的患者进行了临床研究,目的在于发现患者大脑的血氧含量的扰动。实验结果表明正常人的大脑显示了稳定和正常的集成模式的HbO2和HbR变化,而在患有慢性精神分裂症的患者头部监测到与正常人不同的不稳定模式变化。验证了功能近红外光谱对精神病治疗的作用。
Hock等[22-23]研究了对于不同年龄阶段的阿尔兹海默症病人的血氧含量的变化情况。Fallgatter等[24]在1997年证明了受阿尔兹海默症影响的受试者的功能性半球不对称的减少。
2.2 多通道探测阶段
由于单点探测在空间分辨率和时间分辨率上都很低,众多研究学者开发了多通道的探测技术,涌现出大批成果。主要的方法是通过增加光源数和探测光纤数来获取多个点的探测数据。
Maki等[19,25]在1995年首次使用10通道探测,每次可以探测10个测量点,光源点和探测点都为4个,如图2[19]所示。Watanabe等[26]在1998年应用了24通道的近红外光谱技术来对大脑进行探测。
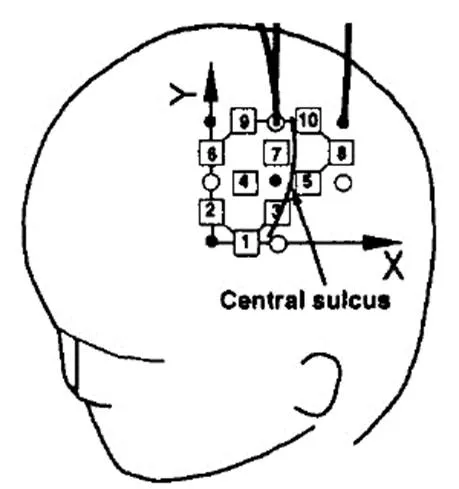
图2 Maki等人提出的10通道探测点分布
Miyai等[27]在2001年使用9个光源和12个探测器,达到30个探测通道,如图3[27]所示。2004年又开发了52通道和64通道系统,研究人的步态对大脑活动的影响,对病理性步态和复健有一定的意义。光源和探测点的距离都为3cm。

图3 Miyai等人提出的多通道系统
Homae等[28-29]在2006年和2007年分别在左右脑使用了10个源点和8个探测点(共20个源点和16个探测点),探测通道分别为24个(共48个测量点),对婴儿的大脑皮层进行探测。在2010年[30]使用两个3×10阵列(15个源点和15个探测光纤),每个阵列47个探测通道,共94个通道对15个婴儿(6个女孩和9个男孩),从出生、3个月、6个月3个时间点分别进行了血氧含量的监测。源点和探测点之间的距离为2cm,两个探测点之间的最小距离为1.4cm,如图4[30]所示。

图4 Homae等人提出的94通道的探测点分布
Maria等[31]在2000年提出了在线快速重建大脑图像的方法,使用16个源点和2个探测点,共32个探测通道,如图5[31]所示,采用时分复用的方式照亮光源,并使用反投影方法,获取了大脑血氧蛋白含量的变化情况。源点和探测点之间的距离均为3cm。
Schmidt等[32]在2000年提出了32个源点和32个探测点的时域方式光学成像,每次获取32通道的探测点,光源一次只照亮一个,32个源点需要按顺序照亮。每次一个光源照亮,22个探测点接收数据(考虑到离光源的距离太近,靠近光源的左右5个点不接收数据),共达到32×22=704个测量点,并重建了大脑区域的吸收系数和散射系数图像。
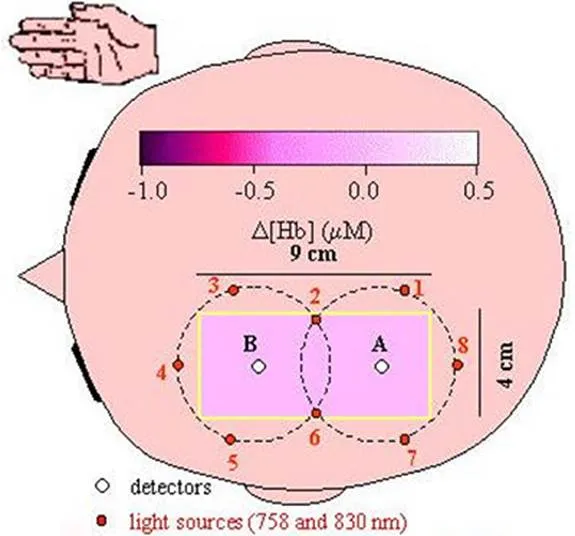
图5 Maria等人提出的32通道的探测点分布
Quaresima等[33]在2002年使用连续波方式,双波长,4个源点和5个探测点,得到12点的探测通道,光源点和探测点的距离为3.5cm,得到了大脑血红蛋白含量的变化情况。并在2005年[34]使用时域方式,2个源点和4个探测点,获取8通道的探测,验证了时域方式下进行大脑双侧前额皮层在语言激励下血红蛋白含量探测的可行性。
Maria和Boas在2003和2004年[35-36]使用8个源点和16个探测点,源点和探测点的距离为3cm,每个源点之间的距离为1.9cm,每个大脑半球14对探测通道,如图6[36]所示,获取了大脑双侧的血红蛋白含量的变化曲线和图像。
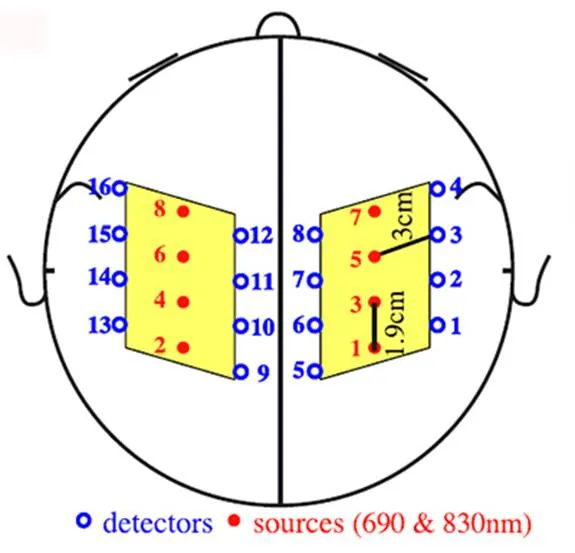
图6 Maria等人提出的28通道探测点分布
Ou 等[37]在2009 年联合脑磁图(MEG)和扩散光成像(DOI)研究了大脑神经与血管的耦合,光源和探测器的分布使用的是Maria 等人研制的CW4 设备。
在国内,华中科技大学骆清铭小组[38-41]研究的近红外光谱基于对于大脑光神经信号的检测,使用了4个源点和16个探测点,共达到22个探测通道。源点和探测点间距为3cm,如图7[40]所示。
通过各种多通道探测系统可以看出,在多通道探测中需要考虑串影和光源同时照射时探测端的信息解析,所以光源数一般较少,探测点也需要分布在一定的距离内,光源一般需要按顺序分别照亮,这增加了数据采集的时间;若光源数较多时,如Schmidt使用了32个源,就需要采用时分复用的方式使用硬件设备点亮每个光源,就会增加探测时间和系统的复杂度。文献中也有很多有关多通道探测阶段的总结[42-43]。
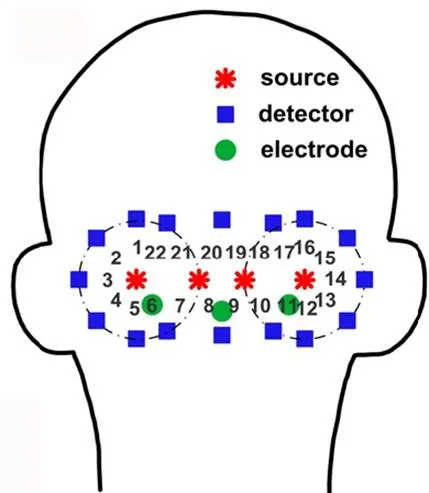
图7 骆清铭小组提出的22通道探测点分布
2.3 高密度探测阶段
在多通道探测阶段,由于源点和探测点的数量增加,进而增加了探测的难度,特别是多个光源点,由于串影和探测端信息解析的难度,造成了源点和探测点的数量不能增加过多,因此分辨率就不能提高,也只能获取血红蛋白含量的简单变化曲线和热点图,不能达到高分辨率。若需要提高分辨率,就需要系统能够同时进行多点探测,提高探测密度和光源数。
对于多通道探测,重点是如何有效利用探测点的数据及提高探测点接收数据的能力,测量数据点的选择一般是介于光源和探测点之间的点,或是通过插值得到的数据点。
Boas等致力于近红外光谱技术对大脑的探测,研究了从多通道探测[44-45]到高密度探测的方法,2004年Boas等人[46-47]在近红外光谱的扩散光大脑成像中,提出了重叠测量的方法,使用第1临近距离和第2临近距离来得到重叠测量的数据,使用16个源点和9个探测点,得到了84个探测点数据,源和探测点之间的距离最大4.3cm和最小2.5cm。并在2006年研制了CW5系统[48],使用时分复用频分编码的方式使多个光源可以同时照亮,将光源分成3组进行照亮,分别对应不同的探测点。
Zeff等所在的Culver研究小组2007年[49]提出了高密度DOT(High-density, HD-DOT)系统及相应的研究方法[50-51]。建立了高密度成像网格,使用24源点和28探测点,并使用第一、第二、第三和第四最相邻距离探测,源和探测点距离分别13mm、30mm、40mm和48mm。24个源与28个探测器交叉在高密度矩阵中,如图8[49]所示,总体尺寸达到13.2cm×6.6cm。在头部的光纤连接使用一个活动的塑料帽子,并设置在视觉脑皮层头部后面。在这个高密度中,理论上共有672个可能测量点。由于高灵敏度和动态范围,使用4个最临近光极点可以同时采样,实际测量可以同时获取348个测量点。

图8 Zeff小组提出的高密度大脑探测的网格分布
2014年Eggebrecht等[52]在Zeff等人的基础上继续提高了高密度DOT的分辨率,同样使用双波长(750nm和850nm),源点和探测点分别增加到96和92个,排布成交错矩形阵列,4个最邻近距离分别为1.3cm、3.0cm、3.9cm和4.7cm。光源点位置被分成6个编码区域,每16个源按时间间隔6.25ms排序;两个双波长使用频域编制成不同的频率。这样就对整个探测光纤进行了时间、频域和空间上的编码,达到了1200个探测点数据。
Koch等[53-55]在2009和2010年提出了高密度光学大脑地图绘制,使用30个双极光纤,可以同时作为光源和探测光纤,这样就可以获取900个探测点数据,对光源的照亮采用时分复用的方式,两个光纤之间的距离仅有0.75cm,如图9[55]所示。
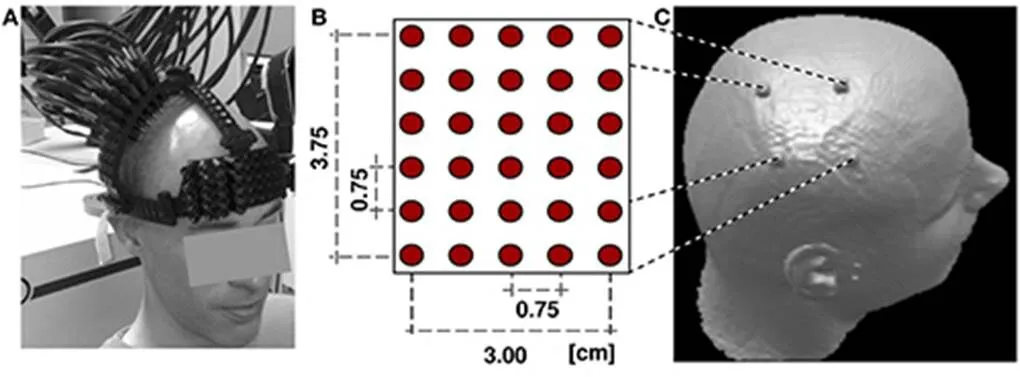
图9 Koch等人提出的高密度探测光纤分布
高密度近红外光谱测量方法,比起多通道测量方法,极大地提高了分辨率,探测精度也得到提高,使得功能近红外光谱对大脑功能的探测更近一步。
3 结语
功能近红外光谱技术对大脑的探测经历了20多年的发展,由于其特殊的“光学窗口”对大脑组织具有一定的穿透能力,并能够携带信息后溢出组织体,使得近红外光谱技术对大脑功能的含氧血红蛋白和脱氧血红蛋白的变化进行检测。检测方法主要分为连续波谱技术、时域波谱技术和频域波谱技术。早期主要使用的是连续波谱技术,由于其简单,探测方便;后期发展了时域波谱技术及频域波谱技术,时域和频域之间可以相互转化,但系统的设计并不相同。探测时需要选择光纤探头接触头部,通过探头对头部的不同区域的探测,获取不同的功能信息。早期使用的是单点探测方式,一个光源照射,一个探测光纤探头接收信息,这种方式很简单,但探测的信息量太少;接着提出了多通道探测方式,由多个光源和多个探测点组成,源点和探测点的探头数量从10个到20多个,源点和探测点的距离大概在3cm左右。现在提出的高密度探测方法,源点和探测点的探头数量增加到近100个,距离也减小到1cm左右,探测点数据量达到了1000多个,极大的提高了探测精度。
对于功能近红外光谱技术对大脑的探测重要的一点是提高分辨率,在提高空间分辨率的情况下,系统的复杂度也大幅度增加,所以系统的时间分辨率也相应需要提高。而且通过光纤探头进行探测,空间分辨率的提高无法再突破,所以需要有更好的方法,比如光源直接照射,不使用光纤探头进行探测,而使用CCD相机接收数据,达到高分辨率的数据量,但同时得到的数据量也有很多无用数据且数据量巨大,增加了后期图像重建技术的难度。
[1] Cheong W F, Prahl S A, Welch A J. A review of the optical properties of biological tissues[J]., 1990, 26(12): 2166-2185.
[2] 骆清铭, 邓晖, 龚辉, 等. 用于脑血流量检测的近红外光谱术[J]. 红外与毫米波学报, 1999, 18(2): 138-144.
LUO Qing-ming, DENG Hui, GONG Hui, et al. Near-infrared spectroscopy for the measurement of cerebral blood flow[J]., 1999, 18(2): 138-144.
[3] 周俊, 白净. 近红外光谱技术及其在脑功能成像中的应用[J]. 国际生物医学工程杂志, 2000(4): 193-197.
ZHOU Jun, BAI Jing. NIRS and it's application in functional cerebral image[J]., 2000(4): 193-197.
[4] 钱志余, 李韪韬. 功能近红外光谱技术(fNIRs)临床应用综述[J]. 生命科学仪器, 2013, 11(3): 45-52.
QIAN Zhi-yu, LI Wei-tao. Functional near-infrared spectroscopy clinical applications review[J]., 2013, 11(3): 45-52.
[5] 徐刚, 李小俚, 刘晓民. 简易脑功能近红外光谱系统设计[J]. 光谱学与光谱分析, 2015, 35(2): 552-556.
XU Gang, LI Xiao-li, LIU Xiao-min. A simple design of functional near-infrared spectroscopy system[J]., 2015, 35(2): 552-556.
[6] 李洪娟, 王乐鹏, 莫芳芳. 红外成像检测技术在中医领域研究综述[J]. 红外技术, 2015, 37(3): 185-189.
LI Hong-juan,WANG Le-peng,MO Fang-fang. The research review of the application of infrared thermography in the field of traditional Chinese medicine[J]., 2015, 37(3): 185-189.
[7] 王艳武, 关涛, 马守军, 等. 红外热像技术在船用电气控制箱状态监测中的应用研究[J]. 红外技术, 2015, 37(9): 783-787.
WANG Yan-wu, GUAN Tao, MA Shou-jun, et al. Study on the application of infrared thermography to conditions monitor of marine electric control cabinet[J]., 2015, 37(9): 783-787.
[8] 侯旺, 孙晓亮, 尚洋, 等. 红外弱小目标检测技术研究现状与发展趋势[J]. 红外技术, 2015, 37(1): 1-10.
HOU Wang, SUN Xiao-liang, SHANG Yang, et al. Present State and Perspectives of Small Infrared Targets Detection Technology[J]., 2015, 37(1): 1-10.
[9] 陈玲玲, 夏方山, 毛培胜, 等. 近红外光谱技术在种子硬实检测中的研究进展[J]. 红外技术, 2015, 37(1): 793-798.
CHEN Ling-ling,XIA Fang-shan,MAO Pei-sheng, et al. Application of near infrared spectroscopy (NIR) technique in hard seed testing research[J]., 2015, 37(1): 1-10.
[10] 胡光霞, 钱志余, 孙涛, 等. 基于功能近红外光谱技术(fNIRs)的帕金森病大鼠模型脑组织特性研究[J]. 光谱学与光谱分析, 2010, 30(9): 2360-2364.
HU Guang-xia, QIAN Zhi-yu , SUN Tao, et al. Study on brain tissue characteristics of rat model of Parkinson's disease based on functionality near-infrared spectroscopy (fNIRs) technology[J]., 2010, 30(9): 2360-2364.
[11] Hoshi Y, Tamura M. Dynamic multichannel near-infrared optical imaging of human brain activity[J]., 1993, 75(4): 1842-1846.
[12] Chance B, Zhuang Z, UnAh C, et al. Cognition-activated low-frequency modulation of light absorption in human brain[J]., 1993, 90(8): 3770-3774.
[13] Kato T, Kamei A, Takashima S, et al. Human visual cortical function during photic stimulation monitored by means of near infrared spectroscopy[J]., 1993, 13(3): 516-520.
[14] Villringer A, Planck J, Hock C, et al. Near infrared spectroscopy (NIRS): a new tool to study hemodynamic changes during activation of brain function in human adults[J]., 1993, 154(1): 101-104.
[15] Meek J H, Firbank M, Elwell C E, et al. Regional hemodynamic responses to visual stimulation in awake infants[J]., 1998, 43(6): 840-843.
[16] Lloyd-Fox S, Blasi A, Elwell C E. Illuminating the developing brain: the past, present and future of functional near infrared spectroscopy[J]., 2010, 34(3): 269-284.
[17] Ferrari M, Quaresima V. A brief review on the history of human functional near infrared spectroscopy (fNIRS) development and fields of application[J]., 2012, 63(2): 921-935.
[18] Scholkmann F, Kleiser S, Metz A J, et al. A review on continuous wave functional near infrared spectroscopy and imaging instrumentation and methodology[J]., 2014, 85(2): 6-27.
[19] Maki A, Yamashita Y, Ito Y, et al. Spatial and temporal analysis of human motor activity using noninvasive NIR topography[J]., 1995, 22(12): 1997-2005.
[20] Zaramella P, Freato F, Amigoni A, et al. Brain auditory activation measured by near-infrared spectroscopy (NIRS) in neonates[J].2001, 49(2): 213-219.
[21] Okada F, Tokumitsu Y, Hoshi Y, et al. Impaired interhemispheric integration in brain oxygenation and hemodynamics in schizophrenia[J]., 1994, 244(1): 17-25.
[22] Hock C, Müller-Spahn F, Schuh-Hofer S, et al. Age dependency of changes in cerebral hemoglobin oxygenation during brain activation: a near-infrared spectroscopy study[J]., 1995, 15(6): 1103-1108.
[23] Hock C, Villringer K, Müller S, et al. Near infrared spectroscopy in the diagnosis of Alzheimer's disease[J]., 1996, 777(1): 22-29.
[24] Fallgatter A J, Roesler M, Sitzmann L, et al. Loss of functional hemispheric asymmetry in Alzheimer's dementia assessed with near infrared spectroscopy[J]., 1997, 6(1): 67-72.
[25] Watanabe E, Yamashita Y, Maki A, et al. Non-invasive functional mapping with multi-channel near infrared spectroscopic topography in humans[J]., 1996, 205(1): 41-44.
[26] Watanabe E, Maki A, Kawaguchi F, et al. Non-invasive assessment of language dominance with near-infrared spectroscopic mapping[J]., 1998, 256(1): 49-52.
[27] Miyai I, Tanabe H C, Sase I, et al. Cortical mapping of gait in humans: a near-infrared spectroscopic topography study[J]., 2001, 14(5): 1186-1192.
[28] Homae F, Watanabe H, Nakano T, et al. The right hemisphere of sleeping infant perceives sentential prosody[J]., 2006, 54(4): 276-280.
[29] Homae F, Watanabe H, Nakano T, et al. Prosodic processing in the developing brain[J]., 2007, 59(1): 29-39.
[30] Homae F, Watanabe H, Otobe T, et al. Development of global cortical networks in early infancy[J]., 2010, 30(14): 4877-4882.
[31] Franceschini M A, Toronov V, Filiaci M, et al. On-line optical imaging of the human brain with 160-ms temporal resolution [J]., 2000, 6(3): 49-57.
[32] Schmidt F E W, Fry M E, Hillman E M C, et al. A 32-channel time-resolved instrument for medical optical tomography[J]., 2000, 71(1): 256-265.
[33] Quaresima V, Ferrari M, Marco C P, et al. Lateral frontal cortex oxygenation changes during translation and language switching revealed by non-invasive near infrared multi-point measurements[J]., 2002, 59(3): 235-243.
[34] Quaresima V, Ferrari M, Torricelli A, et al. Bilateral prefrontal cortex oxygenation responses to a verbal fluency task: a multichannel time-resolved near-infrared topography study[J]., 2005, 10(1): 011012-01101212.
[35] Franceschini M A, Fantini S, Thompson J H, et al. Hemodynamic evoked response of the sensorimotor cortex measured noninvasively with near infrared optical imaging[J]., 2003, 40(4): 548-560.
[36] Franceschini M A, Boas D A. Non-invasive measurement of neuronal activity with near infrared optical imaging[J]., 2004, 21(1): 372-386.
[37] Ou W, Nissilä I, Radhakrishnan H, et al. Study of neurovascular coupling in humans via simultaneous magnetoencephalography and diffuse optical imaging acquisition[J]., 2009, 46(3): 624-632.
[38] Hui G, Zeng S, Cheng Y, et al. Continuously tracing brain wide long distance axonal projections in mice at a one-micron voxel resolution[J]., 2013, 74(7): 87-98.
[39] Yanyan L, Xiaoquan Y, Dan Z, et al. Optical clearing agents improve photoacoustic imaging in the optical diffusive regime[J]., 2013, 38(20): 4236-4239.
[40] Sun B, Lei Z, Hui G, et al. Detection of optical neuronal signals in the visual cortex using continuous wave near infrared spectroscopy[J]., 2014, 87(2): 190-198.
[41] Yang X Q, Liu Y Y, Zhu D, et al. Dynamic monitoring of optical clearing of skin using photoacoustic microscopy and ultrasonography[J]., 2014, 22(1): 1094-1104.
[42] Gary S, Boas D A, Sutton J P. Non-invasive neuroimaging using near infrared light[J]., 2002, 52(1): 679-693.
[43] Hellmuth O, Arno V. Beyond the visible-imaging the human brain with light[J]., 2003, 23(1): 1-18.
[44] Boas D A, Brooks D H, Miller E L, et al. Imaging the body with diffuse optical tomography[J]., 2001, 18(6): 57-75.
[45] Boas D A, Gaudette T, Strangman G, et al. The accuracy of near infrared spectroscopy and imaging during focal changes in cerebral hemodynamics[J]., 2001, 13(1): 76-90.
[46] Boas D A, Anders M Dale, Franceschini M A. Diffuse optical imaging of brain activation: approaches to optimizing image sensitivity, resolution, and accuracy[J]., 2004, 23(S1): S275-S288.
[47] Boas D A, Chen K, Grebert D, et al. Improving the diffuse optical imaging spatial resolution of the cerebral hemodynamic response to brain activation in humans[J]., 2004, 29(13): 1506-1508.
[48] Joseph D K, Huppert T J, Maria Angela F, et al. Diffuse optical tomography system to image brain activation with improved spatial resolution and validation with functional magnetic resonance imaging [J]., 2006, 45(31): 8142-8151.
[49] Zeff B W, White B R, Hamid D, et al. Retinotopic mapping of adult human visual cortex with high-density diffuse optical tomography[J]., 2007, 104(29): 12169-12174.
[50] Hamid D, White B R, Zeff B W, et al. Depth sensitivity and image reconstruction analysis of dense imaging arrays for mapping brain function with diffuse optical tomography[J]., 2009, 48(9): D137-D143.
[51] Eggebrecht A T, White B R, Ferradal S L, et al. A quantitative spatial comparison of high-density diffuse optical tomography and fMRI cortical mapping[J]., 2012, 61(4): 1120-1128.
[52] Eggebrecht A T, Ferradal S L, Viehoever A R, et al. Mapping distributed brain function and networks with diffuse optical tomography[J]., 2014, 8(6): 448-454.
[53] Koch S P, Menert J, Schmitz C, et al. High-density optical mapping of the human somatosensory cortex to vibrotactile stimulation[J]., 2009, 47(Sl1): S163.
[54] Schmitz C H, Koch S P, Mehnert J, et al. High-density optical mapping of the human somatosensory cortex[C]//,, 2010: S163.
[55] Koch S P, Habermehl C, Mehnert J, et al. High-resolution optical functional mapping of the human somatosensory cortex[J]., 2010, 2(Sl1): 12-12.
Research and Application of Functional Near Infrared Spectroscopy in the Brain Imaging
CHEN Xingsu1,WANG Xuefeng1,2,WANG Yuanqing2
(1.,,83500,; 2.,,210046,)
Near infrared spectrum of 650-1000nm is the optical window of brain imaging. Functional near infrared spectroscopy (fNIRS) for brain imaging has advantages of non-invasive, no injection of contrast agent, low cost and convenience, so it has been applied to brain imaging. The paper overviews the principle, method and development of near infrared spectral imaging in the brain, analyzes and summarizes the three main stage methods of fNIRS. The three stages have improved the system resolution in the brain imaging. The existing problems and development prospects are also presented.
functional near infrared spectroscopy,brain imaging,multi-channel detection,high density detection
TN219
A
1001-8891(2016)06-0433-07
2015-11-18;
2016-01-20.
陈兴稣(1981-),男,讲师,主要研究方向为信号与信息处理。E-mail:chenxs1981@126.com。
国家自然科学基金项目(61363066)。

