硝化菌的筛选、鉴定及其固定化颗粒的氨氮去除效能*
汪怀建 周跃龙 汪新强 胡美丹
(1.江西农业大学国土资源与环境学院, 江西 南昌 330045;2.江西婺源饶河源国家湿地公园管理局, 江西 婺源 333200)
近年来,随着经济的快速发展,水环境面临的压力日趋增大,部分劣Ⅴ类地表水中的氨氮污染问题较为突出[1-2]。根据环境保护部发布的《2013年环境统计年报》,2013年,全国废水中氨氮的排放量为245.7万t,主要来源为城镇生活污水、农业源、工业废水等污染源。废水中氨氮进入环境水体后,极易引起水体的富营养化等水生态环境问题。
针对水体中氨氮污染物的去除,国内外学者主要对生物修复方法开展了大量相关研究,从环境水体中筛选出高效硝化菌的优势菌株,并考察环境因素对硝化菌的氨氮硝化过程的影响[3-5]。由于硝化菌在天然水体中的含量相对较低,近年来,固定化微生物方法成为硝化菌强化技术的研究热点[6-10]。通过微生物固定的方法,可以实现污染水体中局部区域硝化菌的大量富集,从而提升氨氮的去除效果。
为探讨环境中硝化菌的固定化方法及对地表水中氨氮的去除效果,从地表水中筛选分离得到一种硝化菌优势菌株,对其进行16S rDNA鉴定,考察不同固定化方法条件下固定化硝化菌颗粒对氨氮的处理效果,为固定化硝化菌颗粒在氨氮微污染地表水修复中的应用提供技术支撑。
1 材料与方法
1.1 优势菌株的筛选
1.1.1 硝化菌的富集培养
取南昌市某内河流中底泥,在无菌环境下,与无菌水均匀混合制成均匀菌悬液。在锥形瓶中加入富集培养基,主要成分为(NH4)2SO4、K2HPO4、MgSO4·7H2O、NaCl、FeSO4·7H2O、CaCO3、无氨水。然后向其中接种菌悬液,将已移取菌悬液的富集培养基(即富集培养液)置于恒温摇床上,于30 ℃、120 r/min下振荡培养,以6 d为1个周期。经过多周期转接,淘汰富集培养液中伴生的异养细菌。在每次转接富集培养液的同时,取富集培养液滴于白瓷板上,分别用格利斯试剂及二苯胺-硫酸试剂,检验是否存在亚硝酸盐氮和硝酸盐氮,通过指示剂与富集培养液混合后显示颜色的深浅来间接显示硝化菌的强弱。
1.1.2 硝化菌的分离与纯化
吸取1 mL富集培养液于含9 mL无菌水的试管中,80 ℃水浴加热20 min,充分摇匀,然后在上一个试管中取1 mL到另一个含9 mL无菌水的试管中,制成浓度梯度的菌悬液。取10、102、103、104、105倍梯度的少量稀释后的菌悬液分别置于平板培养基中的一角,硝化菌的分离采用平板划线法。平板培养基主要成分为K2HPO4、NaNO2、NaCl、MgSO4·7H2O、FeSO4·7H2O、CaCO3、琼脂。
1.1.3 硝化菌的筛选
将分离得到的菌株接入硝化菌筛选培养基,置于恒温摇床上,在30 ℃、220 r/min条件下振荡培养。同时以灭菌后没有接种任何菌株的筛选培养基为对照样。筛选培养基的主要成分为NaNO2、K2HPO4、MgSO4·7H2O、NaCl、FeSO4·7H2O、CaCO3、氨水。7 d后测定氨氮的浓度,计算氨氮的去除率。筛选出氨氮去除效果最好的菌株接种到固体斜面培养基,菌落长成后置于4 ℃冰箱内保存。
1.2 菌株16S rDNA鉴定
采用细菌DNA提取试剂盒,提取筛选得到的硝化菌DNA。然后进行DNA的聚合酶链式反应(PCR)扩增处理。PCR扩增体系(50 μL反应总体系):H2O 22 μL,菌体DNA 1 μL,引物P1 1 μL,引物P2 1 μL,2×PCR Mix 25 μL(含10×PCR Buffer、dNTP、Taq酶)。硝化菌扩增程序:94 ℃预变性2 min,94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,进行29个循环,最后在72 ℃下延伸10 min,4 ℃保存。
DNA的检测:在点样板上点加1 μL溴酚蓝,再加入3 μL DNA样品,并同时以20 ng标准DNA作对比,混合后点入凝胶点样孔中,在220 V电压、280 mA电流下电泳20 min;在紫外光透射仪下观察DNA图谱条带,并拍照。
PCR产物的电泳检查在点样时以2 μL DL2000 DNA作为参照, 3 μL的扩增后产物加1 μL溴酚蓝混合后,分别点入点样孔,在220 V电压、280 mA电流下电泳20 min;在紫外光透射仪下观察扩增产物光带的情况,并拍照。
1.3 不同的载体固定方法
1.3.1 海藻酸钠/粉末活性炭固定法
将筛选出的最佳菌体用质量分数为0.85%的生理盐水洗涤,再将菌液放入离心机中,以3 000 r/min的转速离心5 min,得到固定化所要用的菌泥。称取2 g海藻酸钠于48 mL蒸馏水中,水浴加热直至海藻酸钠完全溶解。然后将0.5 g活性炭边搅拌边加入上述海藻酸钠溶液中,搅拌均匀后冷却至室温。离心得到的固定化菌泥与上述配置的质量分数为4%的海藻酸钠溶液按2∶1(质量比)的比例混合,充分混匀,然后利用注射器吸取后逐滴滴入质量分数为4%的氯化钙溶液中,形成均匀的颗粒状,而后将固定化颗粒放入4 ℃的条件下进行固化交联24 h。固化后将固定化颗粒取出用蒸馏水洗涤两次,即得到最终的海藻酸钠/粉末活性炭固定化硝化菌颗粒。
1.3.2 聚乙烯醇(PVA)固定法
称取1 g海藻酸钠、10 g PVA于89 mL的蒸馏水中,水浴加热使其溶解。称取3 g二氧化硅、0.3 g碳酸钙缓缓搅拌加入上述溶液中,将离心得到的固定化菌泥与上述溶液按2∶1(质量比)的比例混合,充分混匀,然后利用注射器吸取,逐滴滴入含1%(质量分数)氯化钙的饱和硼酸溶液中,形成均匀的颗粒状,轻轻搅拌,制作完固定化颗粒后将其放入4 ℃的冰箱中固化交联24 h。固化后将固定化颗粒取出用蒸馏水洗涤两次,即完成最终的微生物固定化颗粒制作。
1.4 氨氮去除效果
取南昌市某内河流水1 L置于容积为2 L的烧杯中,分别放入等量的干质量为5 g 的PVA固定化硝化菌颗粒与海藻酸钠/粉末活性炭固定化硝化菌颗粒进行曝气,每隔一定时间取样1次,连续运行24 h后,沉淀2 h,撇除上清液,新补充内河流水至1 L,重复上述实验。取不加固定化硝化菌颗粒的内河流水进行曝气,作为空白对照。分析原水及处理后水样中氨氮浓度。水样中氨氮的测试采用纳氏试剂分光光度法。
2 结果与讨论
2.1 菌株的16S rDNA鉴定结果
提取硝化菌DNA,对其PCR扩增后的产物进行电泳处理,以 DNA Marker DL2000作为参照,其DNA扩增后产物在紫外光透射仪下的照片如图1所示。由图1可知,扩增后产物光带呈集中、明亮的状态,且扩增所得到的条带DNA长度约为1 500 bp。扩增结果表明,扩展后的DNA能够用于16S rDNA 序列分析,PCR扩增产物送往生工生物工程(上海)股份有限公司测序。

图1 硝化菌PCR琼脂糖凝胶电泳图谱Fig.1 Agarose gel electrophoresis of PCR of nitrobacteria
将提取的硝化菌株(命名XH)16S rDNA,提交到美国国立生物技术信息中心(NCBI)在线基因数据库进行相似性比对。结果表明,提取的硝化菌株XH最接近的属(种)为NR_074453.1,登录号为Bacillusanthracisstr. Ames strain Ames 16S ribosomal RNA, complete sequence,相似度99%。采用ClustalX软件对GenBank中的已知序列与测得的硝化菌序列进行比对后,采用BioEdit手动删除两端不齐序列,然后用MEGA软件构建系统发育树,结果如图2所示。

图2 硝化菌株XH基于16S rDNA全序列的系统发育树Fig.2 Phylogenetic tree of XH based on complete 16S rDNA sequences
由图2可知,硝化菌株与蜡样芽孢杆菌(Bacilluscereus)和炭疽杆菌(Bacillusanthracis)的亲缘关系最近。然而菌株的NCBI在线基因数据库比对结果表明,菌株与炭疽杆菌的相似度高达99%。这表明硝化菌株在分类学上属于芽孢杆菌属(Bacillussp.),但不能确定具体是哪一种芽孢杆菌。
2.2 固定化载体的选择
对于筛选得到的硝化菌株,分别采用海藻酸钠/粉末活性炭与PVA两种固定化载体,对优势菌株进行固定处理。两种固定化载体得到硝化菌强化颗粒对地表水中氨氮的去除效果见图3。地表水初始氨氮质量浓度为6.10 mg/L、pH为7.72、COD为41.8 mg/L。
由图3可见,在连续曝气反应24 h的条件下,两种固定化载体对氨氮的去除率均高于99.2%,这表明两种载体中固定的硝化菌均保持较高的生物活性,能够有效去除地表水中的低浓度氨氮。在反应时间为0~16 h时,PVA固定化硝化菌颗粒的氨氮去除率略高于海藻酸钠/粉末活性炭固定化硝化菌颗粒。这可能是由于前者部分硝化菌固定于二氧化硅和碳酸钙颗粒的孔道中,后者部分硝化菌固定于粉末活性炭的孔道中,相较氨氮在水中到达硝化菌表面的传质速度,前者高于后者。此外,PVA固定化硝化菌颗粒的机械强度高于海藻酸钠/粉末活性炭固定化硝化菌颗粒,因此,PVA固定化载体整体上优于海藻酸钠/粉末活性炭固定化载体。
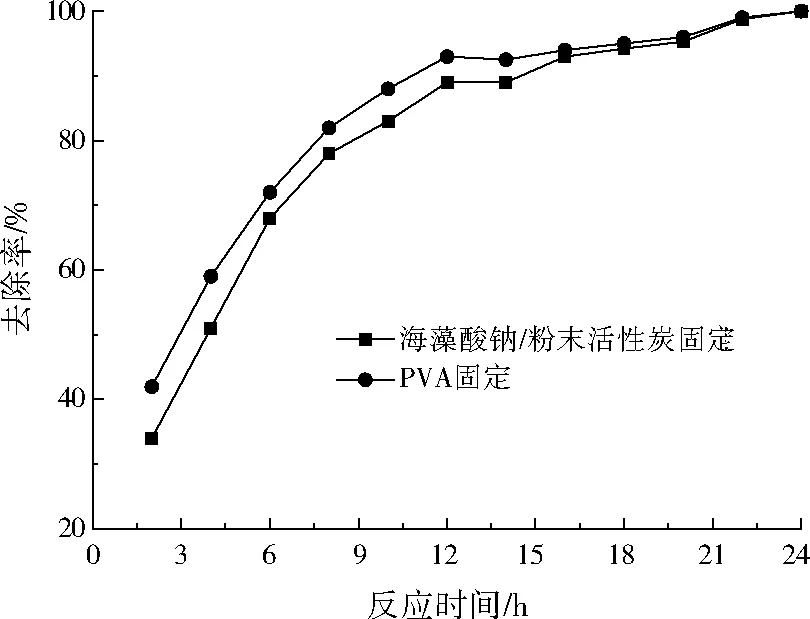
图3 不同固定化载体下硝化菌颗粒的氨氮去除效果Fig.3 The ammonia nitrogen removal efficiency of nitrobacteria particles immobilized on different carriers
2.3 固定化硝化菌颗粒的氨氮去除效果
以南昌市某内河流中氨氮微污染水为原水,考察PVA固定化硝化菌颗粒长时间动态处理氨氮的效果,其对氨氮的去除率如图4所示。原水初始氨氮质量浓度为1.85 mg/L、pH为7.67、COD为32.9 mg/L。由图4可见,连续运行12 d,PVA固定化硝化菌颗粒对水中的氨氮有较高且稳定的去除率,达到78.0%~87.2%,出水氨氮质量浓度低于0.4 mg/L,低于《地表水环境质量标准》(GB 3838—2002)Ⅱ类水体氨氮限值(0.5 mg/L)。与传统生化法脱氮处理相比,固定化硝化菌处理具有快速启动的特点,在反应时间为1 d时,其氨氮去除率达到了82.7%。固定化后硝化菌能够在反应区域实现较高浓度的富集,而不会随水流失,其在氨氮微污染地表水修复领域具有较好的推广应用前景。

图4 PVA固定化硝化菌颗粒对氨氮的去除效果Fig.4 The ammonia nitrogen removal efficiency of nitrobacteria particles immobilized on PVA
3 结 论
从氨氮微污染地表水中筛选得到一种硝化菌,通过分子生物学鉴定,该硝化菌在分类学上属于芽孢杆菌属。相对于海藻酸钠/粉末活性炭材料,PVA材料固定筛选得到的硝化菌性能更优。PVA固定化硝化菌颗粒能够有效去除微污染地表水中的氨氮,处理后氨氮浓度低于GB 3838—2002 Ⅱ类水体氨氮限值。
[1] 曹承进,秦延文,郑丙辉,等.三峡水库主要入库河流磷营养盐特征及其来源分析[J].环境科学,2008,29(2):310-315.
[2] 高建文,何圣兵,陈雪初,等.生物滤池/生态砾石床处理含氮微污染地表水[J].中国给水排水,2012,28(1):26-30.
[3] 何晓红,李大平,陶勇,等.硝化菌群强化修复氨氮污染河流水体研究[J].环境科学学报,2009,29(9):1944-1950.
[4] 吴建江,王兆阳,许培雅.一株高效异养硝化菌的分离、鉴定及其氨氮去除特性[J].中国环境科学,2013,33(7):1309-1315.
[5] 秦雯,李伟光,张多英,等.贫营养下低温异养硝化菌氨氮降解条件优化[J].给水排水,2013,39(7):138-141.
[6] 陈娅洁,姚涛,李至荣,等.包埋固定化硝化菌在不同DO下的硝化规律研究[J].环境科学与技术,2006,29(5):26-27, 30.
[7] 赏国锋,张涵,沈逸菲,等.生物炭固定化硝化菌去除水样中氨氮的研究[J].上海交通大学学报(农业科学版),2014,32(5):44-47.
[8] 曹国民,赵庆祥,龚剑丽,等.固定化微生物在好氧条件下同时硝化和反硝化[J].环境工程,2000,18(5):17-19.
[9] 蔡昌凤,梁磊.混合固定化硝化菌和好氧反硝化菌处理焦化废水[J].环境工程学报,2009,3(8):1391-1394.
[10] 曹月坤,林晓东,李长波,等.反硝化细菌固定化降解亚硝酸盐的研究[J].应用化工,2015,44(10):1784-1787.

