血芝液体深层发酵合成三萜类化合物的条件优化
杨丽梅, 苏 平, 涂俊铭
(食用野生植物保育与利用湖北省重点实验室,湖北黄石 435002)
血芝液体深层发酵合成三萜类化合物的条件优化
杨丽梅, 苏 平, 涂俊铭*
(食用野生植物保育与利用湖北省重点实验室,湖北黄石 435002)
摘要[目的]探究血芝液体深层发酵合成三萜类化合物的最佳发酵条件。[方法]先以单因素试验分析碳源、氮源、转速、pH、接种量对血芝液体深层发酵合成三萜类化合物的影响,选取其中3个主要影响因素,采取响应面分析法进一步优化血芝液体深层发酵合成三萜类化合物的最佳工艺条件。[结果]单因素试验结果显示,血芝发酵合成胞内三萜类化合物的最适条件为pH=6,转速为130 r/min,最适碳源为蔗糖,最适氮源为尿素。响应面法优化的发酵条件为3%接种量、30 g/L蔗糖、1.9 g/L尿素,血芝三萜类化合物含量达16.51 mg/g。[结论]该研究为血芝活性成分的研究提供实际参考依据。
关键词血芝;深层发酵;三萜类化合物;响应面法;优化
皱盖假芝(Amaurodermarude(Berk.)Torrend)是一种大型灵芝科假芝属真菌,在培养过程中可以产生血样分泌物,故又称为血芝[1]。血芝在台湾被视为名贵药材,在防癌方面有奇效[2]。血芝三萜类化合物为血芝的主要活性成分,具有特别明显的生理活性,已有研究表明,其在抗肿瘤、抗衰老、保肝、降血糖血脂、镇痛镇静等方面有明显的效果[3-4]。我国血芝资源有限、自然生长周期长等问题严重限制了血芝的开发利用。采取液体深层发酵技术收集血芝菌丝体是一种解决和获取血芝资源的有效途径[5]。目前,响应面法(RSM)已被广泛用于生物过程的优化[6-8],但在血芝液体深层发酵条件研究方面的报道较少[9-11]。该研究先进行单因素试验,筛选出对血芝三萜类化合物合成影响最大的液体深层发酵因素,再设计响应面分析试验,进一步优化合成血芝三萜类化合物的发酵条件。
1材料和方法
1.1材料与试剂血芝(皱盖假芝),华中农业大学菌种研究中心提供。无水乙醇、高氯酸、冰乙酸、香兰素、葡萄糖、蔗糖、D-果糖、麦芽糖、KH2PO4、MgSO4·7H2O、NH4Cl等为分析纯;可溶性淀粉、酵母粉、蛋白胨等为生化试剂;尿素、豆饼市售。
1.2仪器与设备PCE-3000烘箱,上海索普仪器有限公司;G154DWS全自动高压灭菌锅,美国Zealway;双面紫外超净工作台,苏州净化设备有限公司;Specord plus 200紫外可见分光光度计,德国耶拿;DK-8D数显恒温水浴锅,金坛市医疗仪器厂;AB204-N型电子天平,梅特勒-托利多仪器上海有限公司;UNINAPO 100 EHC真空浓缩干燥器,德国 UNIEQUIP;TDL-60B离心机,上海安亭科学仪器厂。
1.3试验方法
1.3.1总三萜含量测定。采用香草醛-高氯酸显色法[12-13]。
1.3.2熊果酸标准曲线绘制。准确吸取熊果酸标准品溶液0、0.1、0.2、0.3、0.4、0.5 mL,水浴蒸干,加5%香草醛-冰醋酸0.3 mL、高氯酸1.0 mL,于60 ℃水浴加热15 min,以熊果酸的含量(μg)为横坐标、吸光值为纵坐标绘制标准曲线(图1),建立回归方程Y= 0.002 1x- 0.001 5(R2=0.996 3),表明标准品在0~400 μg范围内吸光值与熊果酸含量呈良好线性关系。
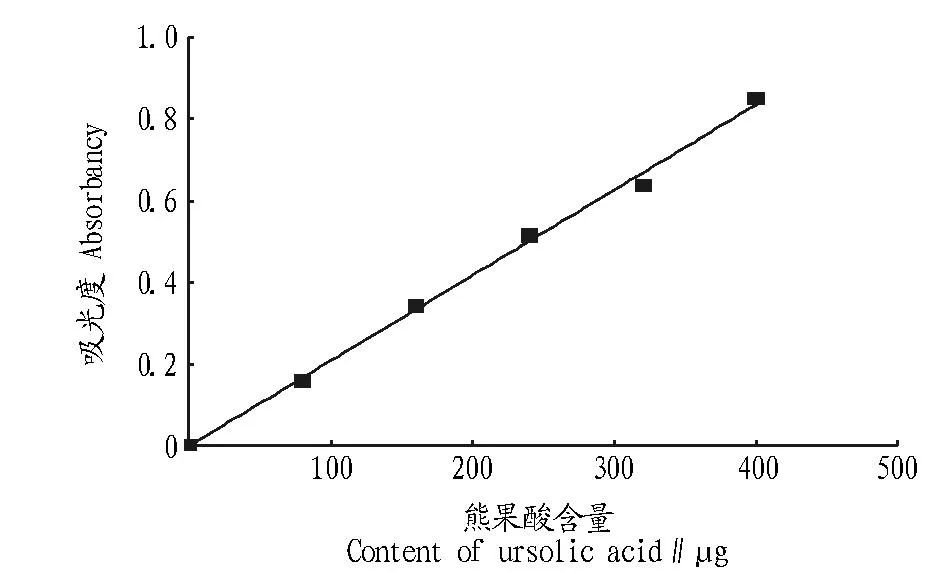
图1 三萜类化合物的标准曲线Fig.1 Standard curve of the triterpenoids
1.3.3血芝胞内三萜类化合物提取及测定。称取0.10 g烘至恒重的血芝菌丝体,加入8 mL无水乙醇,80 ℃水浴3 h,放置室温,4 000 r/min离心10 min,收集滤液再定容至8 mL,测定提取液中三萜类化合物含量。取0.2 mL待测样,沸水浴挥去溶剂,加入5%香草醛-冰醋酸溶液0.3 mL及1.0 mL高氯酸试剂, 60 ℃水浴加热15 min,冷却至室温,测定OD529 nm吸光值。
1.3.4血芝液体深层发酵合成三萜类化合物的单因素试验。
1.3.4.1碳源对合成血芝三萜类化合物的影响。200 g/L马铃薯煮汁、2 g/L蛋白胨、20 g/L不同碳源(葡萄糖、蔗糖、麦芽糖、果糖、可溶性淀粉)、3 g/L KH2PO4、1 g/L MgSO4·7H2O,接种量2%,在26 ℃,130 r/min培养4 d,测生物量和三萜类化合物含量。
1.3.4.2氮源对合成血芝三萜类化合物的影响。200 g/L马铃薯煮汁、20 g/L蔗糖、2 g/L不同氮源(蛋白胨、黄豆粉、酵母粉、氯化铵、尿素)、3 g/L KH2PO4、1 g/L MgSO4·7H2O,接种量2%,在26 ℃,130 r/min培养4 d,测生物量和三萜类化合物含量。
1.3.4.3转速和初始pH对合成血芝三萜类化合物的影响。200 g/L马铃薯煮汁、2 g/L尿素、20 g/L蔗糖、3 g/L KH2PO4、1 g/L MgSO4·7H2O,接种量2%,26 ℃,不同转速(120、130、140、150、160 r/min)培养4 d,测生物量和三萜类化合物含量。调节培养基初始pH(2、4、6、8、自然pH),在26 ℃,130 r/min培养4 d,测生物量和三萜类化合物含量。
1.3.4.4接种量对合成血芝三萜类化合物的影响。200 g/L马铃薯煮汁、2 g/L尿素、20 g/L蔗糖、3 g/L KH2PO4、1 g/L MgSO4·7H2O,调节pH为6,不同的接种量(1%、2%、3%、5%、10%),在26 ℃,130 r/min培养4 d,测生物量和三萜类化合物含量。
1.3.5响应面试验。综合单因素影响三萜类化合物含量的试验结果,选择接种量、碳源、氮源3个主要影响因素,以胞内三萜类化合物含量为响应值,根据Box-Benhnken的中心组合试验设计原理,采用响应面法在3因素3水平(表1)上对血芝液体深层发酵条件进行优化。

表1 响应面分析因素与水平
2结果与分析
2.1血芝液体深层发酵合成三萜类化合物的单因素试验结果
2.1.1碳源对合成血芝三萜类化合物的影响。从图2可知,蔗糖为碳源时,血芝的胞内三萜类化合物含量最高(13.78 mg/g),果糖和麦芽糖次之,而大分子物质淀粉的三萜含量最低(10.05 mg/g)。蔗糖也是比较常见的原料,价格比较便宜,所以该试验中选取蔗糖为合成血芝三萜类化合物的合适碳源。
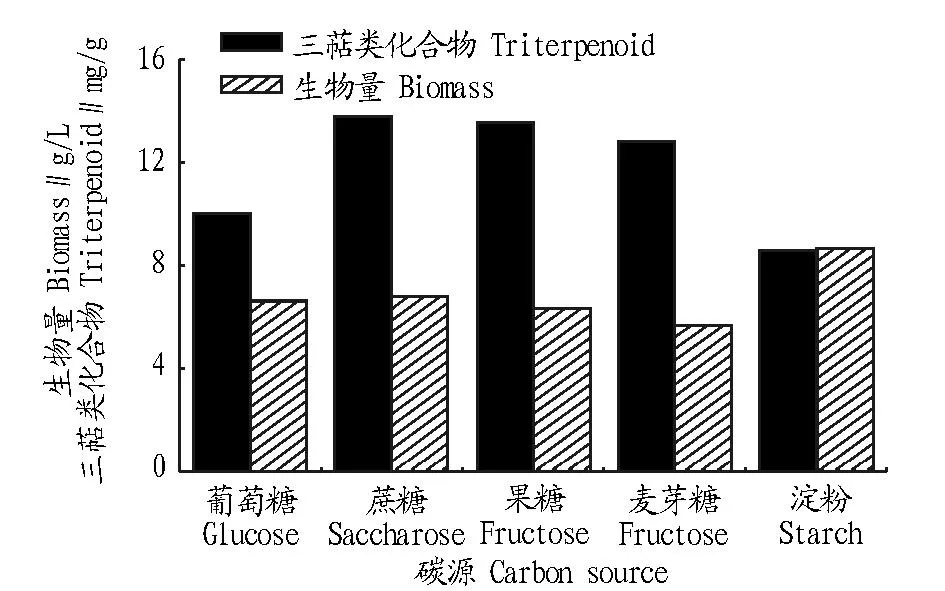
图2 不同碳源对血芝生物量和三萜类化合物的影响Fig.2 Effects of carbon sources on the biomass and triterpenoid of Amauroderma rude(Berk.)Torrend
2.1.2氮源对合成血芝三萜类化合物的影响。图3表明,在血芝液态发酵过程中,无机氮源相对于有机氮源更有利于血芝菌丝体的生长,这可能与菌丝体能直接吸收利用氨基酸、尿素、铵盐等小分子化合物有关,且尿素作为氮源时,血芝菌丝体胞内三萜类化合物含量最高,因此选择尿素作为合成血芝三萜类化合物的最适氮源。

图3 不同氮源对血芝生物量和三萜类化合物的影响Fig.3 Effect of nitrogen sources on the biomass and triterpenoid production of Amauroderma rude(Berk.)Torrend
2.1.3转速和初始pH对合成血芝三萜类化合物的影响。从图4a可看出,随着转速升高,生物量增大;转速太高,反而抑制血芝菌丝体的生长,影响菌球的形成。另一方面,三萜类化合物含量随着转速增加而降低,可能是因为血芝三萜类化合物为次级代谢产物,而转速过高抑制了菌丝体的生长,进而影响次级代谢产物的生成。血芝代谢三萜类化合物总量取决于生物量和胞内三萜类化合物含量2个因素,因此确定最适转速为130 r/min。
由图4b可知,初始pH过低或过高均不利于血芝生物量和三萜类化合物含量的增长,在初始pH为6时,生物量达最大(9.35 g/L);在pH为2时,三萜类化合物含量最大,可能因为血芝三萜类化合物为酸性物质,强酸性环境有利于三萜类物质的积累,具体机理有待进一步探究与确认。初步确定合成血芝三萜类化合物的最适初始pH为6。
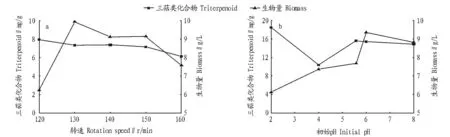
图4 转速(a)和初始pH(b)对生物量和三萜类化合物的影响Fig.4 Effects of rotation speed (a) and initial pH (b) on the triterpenoids
2.1.4接种量对合成血芝三萜类化合物的影响。由图5可见,血芝菌丝体的生物量和接种量呈正相关。但在接种量>3%时,血芝菌丝球小,不利于三萜类化合物的生成,胞内三萜类化合物含量逐渐降低,因此确定最适接种量为3%。

图5 接种量对生物量和三萜类化合物的影响Fig.5 Effects of inoculation amount on the biomass and triterpenoid production of Amauroderma rude(Berk.)Torrend
2.2响应面试验分析以x1=A-2、x2=(B-20)/10、x3=C-2为自变量,以三萜类化合物含量y为响应值,进行响应面试验。利用Design-expert 8.0.5软件对表2数据进行回归拟合分析,对各因素进行回归拟合后,得到血芝胞内三萜类化合物含量对接种量、碳源和氮源的二次多项回归方程为:Y=11.94+2.02x1+1.06x2-0.059x3+0.92x1x2-0.38x1x3+0.24x2x3+0.47x12-0.039x22-0.73x32。经分析,该二次多项模型具有高度显著性(P=0.005 7<0.01);失拟项P=0.000 7,表示有0.07%的概率使得模型偏差由噪音产生,因此模型失拟项不显著;模型的拟合度R2为0.912 7,说明模型拟合程度好。该结果表明可以用此模型对血芝液态发酵合成三萜类化合物的条件进行分析和预测。
由利用Design-expert 8.0.5软件做出的以三萜类化合物含量为响应值的响应面和等高线(图6~8)可知,血芝胞内三萜类化合物代谢的优化条件为接种量3%、蔗糖30 g/L、尿素1.9 g/L,在此条件下,三萜类化合物含量的预测值为16.40 mg/g。
为了验证响应面试验的可靠性,采用优化的血芝液体深层发酵条件(3%接种量、30 g/L蔗糖、1.9 g/L尿素),在26 ℃、130 r/min条件下培养4 d的血芝胞内三萜类化合物含量为16.51 mg/g,实际测量值与理论预测值(16.40 mg/g)接近,无显著性差异。该试验结果表明采用响应面分析法优化的血芝三萜类化合物发酵条件可行。

表2 响应面方案及试验结果

图6 接种量和碳源对三萜类化合物影响的响应曲面(a)和等高线(b)Fig.6 Response surface (a) and contour line (b) of the effects of inoculation amount and carbon source on the triterpenoid production of Amauroderma rude(Berk.)Torrend
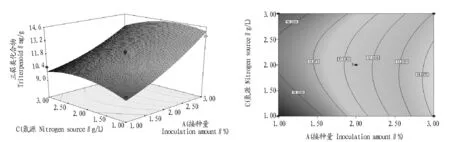
图7 接种量和氮源对三萜类化合物影响的响应曲面(a)和等高线(b)Fig.7 Response surface and contour line of the effects of inoculation amount and nitrogen source on the triterpenoid production of Amauroderma rude(Berk.)Torrend
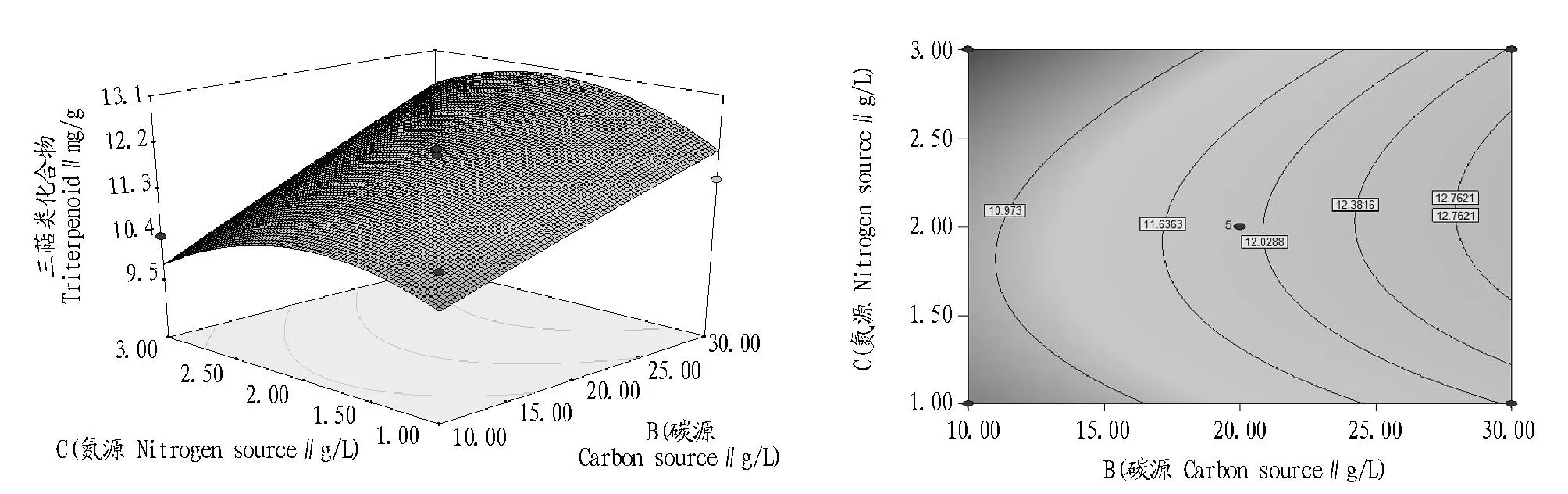
图8 氮源和碳源对三萜类化合物影响的响应曲面(a)和等高线(b)Fig.8 Response surface and contour of the effects of carbon and nitrogen sources on the triterpenoid production of Amauroderma rude(Berk.)Torrend
3结论与讨论
该研究先以单因素试验分析碳源、氮源、转速、pH、接种量对血芝液体深层发酵合成三萜类化合物的影响,选取其中3个主要影响因素,采取响应面分析法进一步优化血芝液体深层发酵合成三萜类化合物的最佳工艺条件。经试验综合确定了以土豆汁为基础培养基时,血芝液体深层发酵的最适碳源为蔗糖,最适氮源为尿素,最适接种量、pH和转速分别为3%、6及130 r/min。用响应面分析进一步优化得到发酵的最优组合为接种量3%、蔗糖30 g/L、尿素1.9 g/L,在此条件下培养的血芝菌丝体生长良好,胞内三萜类化合物含量为16.51 mg/g,比理论值(16.40 mg/g)大,不排除其他发酵因素影响。
对比其他研究发现,血芝的菌丝体发酵条件与灵芝科大多数菌种发酵条件有很高的相似性,可以相互借鉴[14-15]。而在三萜类化合物发酵条件上存在差异,如碳源和接种量有明显的不同,南韩灵芝的最适氮源和碳源为豆粕和淀粉,接种量20%[15],具体原因有待于进一步研究。
响应面试验优化后的结果对比单因素试验的结果有很明显的优化,且最大胞内三萜类化合物含量达郑林用等[11]研究得出结论的1.44倍。可见,响应面分析方法在对血芝三萜类化合物的发酵研究上是有效的,预计在血芝其他活性成分的研究上也将有一定的实际参考价值。
参考文献
[1] 赵继鼎,张小青.中国真菌志:18卷[M].北京:科学出版社,2002:163-165.
[2] JIAO C,XIE Y, YANG X, et al.Anticancer activity ofAmaurodermarude[J].PLOS ONE,2013,8(6):1-13.
[3] 罗俊,林志彬.灵芝三萜类化合物药理作用研究进展[J].药学学报,2002(7):574-578.
[4] 刘冬,孙海燕,李世敏.灵芝三萜类物质抗高血压实验研究[J].时珍国医国药, 2007,18(2):307-309.
[5] 马海昇,李海珍,姚志伟.血芝液体培养及条件优化的初步研究[J].化学与生物工程,2010,27(3):70-72.
[6] 胡永红,沈树宝.响应面分析法用于微生物培养基浓度的优化[J].工业微生物,2002,32(1): 9-12.
[7] 曾柏全,解西玉.响应面法优化曲酸发酵培养基研究[J].中国食品学报,2011(7):118-123.
[8] 周丹,刘世玲,边银丙.响应面法优化富硒金针菇菌株发酵培养基的研究[J].食用菌学报,2006,4(1):33-40.
[9] 夏险,刘健勇,涂俊铭.血芝深层液体培养研究初探[J].食用菌,2012(6):11-12.
[10] LU Z M,LEI J Y,XU H Y,et al.Optimization of fermentation medium for triterpenoid production fromAntrodiacamphorataATCC 200183 using artificial intelligence-based techniques[J].Applied microbiology and biotechnology,2011,92(2):371-379.
[11] 郑林用,黄小琴,杨志荣.血芝深层发酵条件优化初探[J].西南农业学报, 2007, 20(1): 107-110.
[12] 中华人民共和国国家药典委员会.中国药典:二部[S].北京:化学工业出版社,2000:1006.
[13] 陆震鸣.樟芝深层液态发酵及其三萜类化合物的研究[D].无锡:江南大学, 2009:17-30.
[14] 毛健,马海乐.灵芝菌体液态深层发酵条件的优化[J].食品科学,2009, 30(23):377-382.
[15] 余素萍,张劲松,杨焱,等.灵芝胞内三萜高产菌株的筛选及发酵条件的优化[J].微生物学通报,2005,32(1):57-61.
Optimization of Triterpenoids Production by Liquid Submerged Fermentation ofAmaurodermarude(Berk.)Torrend
YANG Li-mei,SU Ping,TU Jun-ming*(Hubei Key Laboratory of Edible Wild Plants Conservation & Utilization,Huangshi,Hubei 435002)
Abstract[Objective] To study the best production conditions of triterpenoids by liquid submerged fermentation ofAmaurodermarude(Berk.) Torrend. [Methods] Firstly, single factor experiment was carried to analyze the effects of carbon source, nitrogen source, rotational speed, pH and inoculation amount on the triterpenoids production by liquid submerged fermentation ofAmaurodermarude(Berk.) Torrend. Then, three major factors were selected. Finally, the Response Surface Methodology (RSM) was applied to further optimize the best production conditions of triterpenoids by liquid submerged fermentation ofAmaurodermarude(Berk.) Torrend. [Results] Single factor experiment indicated that the best production conditions were as follows: pH = 6; the rotational speed was 130 r/min; the optimum carbon source was sucrose; the optimum nitrogen was urea.The fermentation conditions optimized by RSM were 3% inoculation amount, 30 g/L sucrose, 1.9 g/L urea; in these conditions, the triterpenoids production ofAmaurodermarude(Berk.)Torrend reached 16.51 mg/g. [Conclusion] The study provides the practical reference basis for the study of the active ingredients ofAmaurodermarude(Berk.)Torrend.
Key WordsAmaurodermarude(Berk.) Torrend; Submerged fermentation; Triterpenoids; Response Surface Methodology (RSM); Optimization
收稿日期2015-12-21
作者简介杨丽梅(1990-),女,湖北黄石人,硕士研究生,研究方向:微生物学。*通讯作者,教授,博士,硕士生导师,从事微生物工程研究。
基金项目食用野生植物保育与利用湖北省重点实验室开放基金(EWPL201511)。
中图分类号S 567.3+1
文献标识码A
文章编号0517-6611(2016)02-158-04

