嗜麦芽寡养单胞菌SMP蛋白的胞外可调控分泌及序列分析
郭双双, 毕春霞, 杨 丽, 刘兴雨, 秦江楠, 朱元祺, 王 斌, 闫志勇*
(1.青岛大学 基础医学院,山东 青岛 266071; 2.青岛大学 附属青岛市立医院,山东 青岛 266071;3.青岛大学 附属青岛妇女儿童医院,山东 青岛 266071; 4. 青岛大学 附属医院,山东 青岛 266071)
嗜麦芽寡养单胞菌SMP蛋白的胞外可调控分泌及序列分析
郭双双1, 毕春霞2, 杨 丽3, 刘兴雨1, 秦江楠1, 朱元祺4, 王 斌1, 闫志勇1*
(1.青岛大学 基础医学院,山东 青岛 266071; 2.青岛大学 附属青岛市立医院,山东 青岛 266071;3.青岛大学 附属青岛妇女儿童医院,山东 青岛 266071; 4. 青岛大学 附属医院,山东 青岛 266071)
为了观察和探讨嗜麦芽寡养单胞菌SMP蛋白胞外可调控分泌现象及其机制,将收集到的环境株菌D2株及9株临床株在含不同成分的培养基中培养,取培养液上清利用SDS-PAGE电泳观察SMP蛋白分泌情况;提取各菌株基因组DNA,PCR扩增其smp基因并进行克隆和序列测定;将获得的SMP氨基酸序列用Blastp、Megalign等进行分析,并构建系统发育树。结果显示,不同来源的嗜麦芽寡养单胞菌胞SMP蛋白分泌均存在可调控现象,酵母提取物可抑制该蛋白的分泌,而适宜浓度的麦芽糖则具有促进作用。序列对比及系统发育树分析显示,SMP的氨基酸序列具有种属的特异性,且临床株和环境株中存在一定的差异,临床株中该蛋白的氨基酸序列高度保守,而环境株则序列差异相对明显的,但不同来源的菌株SMP均含有保守的信号肽;提示该蛋白可能与其致病性相关,其胞外分泌的可调控机制值得进一步深入探究。
嗜麦芽寡养单胞菌;蛋白分泌;调控分泌;序列分析
嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)是革兰阴性需氧菌,在自然界分布广泛,不同水源、土壤、植物根系等外界环境及动物和人体内均可分离到该菌[1]。研究发现,该菌可以降解某些有害有机物、吸附重金属离子、抵御植物病害、促进植物生长[2-4],并能够合成分泌氧化酶、碱性磷酸酶、酪氨酸酶、纤溶酶等多种生物活性物质[5-7]。此外,嗜麦芽寡养单胞菌也是临床常见的条件致病菌,且对多种抗菌药物天然耐药[8],因此,对该菌的深入研究具有重要意义。在前期研究中我们从海洋生物双齿围沙蚕的消化道中曾分离出一株嗜麦芽寡养单胞菌(D2株,保藏号CGMCC No.1868),可大量胞外分泌某种蛋白(protein ofS.maltophilia,SMP),并已经证实其分泌机制与Ⅱ型分泌系统(T2SS)有关[9];同时还发现该蛋白的胞外分泌具有可调控性,在某些培养基中可大量分泌,而在另外一些培养基中则分泌受抑制。为了探讨该现象,本文在前期研究基础上又收集了部分嗜麦芽寡养单胞菌临床株,观察了其SMP的调控分泌现象,对其编码基因进行了序列测定,并对其氨基酸序列进行了对比分析,以期为深入研究该蛋白的可调控胞外分泌机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源 嗜麦芽寡养单胞菌D2株分离自海洋生物双齿围沙蚕消化道;9株临床株采集自青岛大学各附属医院。
1.1.2 培养基(体积分数,%) ① LB液体培养基; ②蛋白胨液体培养基:蛋白胨1,NaCl 0.5; ③酵母蛋白胨液体培养基: 蛋白胨1, NaCl 0.5,酵母提取物0.5;④胰蛋白胨液体培养基: 胰蛋白胨1,NaCl 0.5; ⑤ ALB培养基: 胰蛋白胨1,NaCl 0.5,酵母提取物0.5,琼脂1.5,氨苄青霉素(Amp)终浓度100 μg/mL。
1.1.3 主要试剂 实验所用细菌基因组DNA提取试剂盒购自Promega公司,TaqDNA聚合酶、dNTPs、DNA分子量标准、限制性核酸内切酶(EcoRⅠ和Hind Ⅲ )、pMD18-T均购自TaKaRa公司;PCR产物纯化试剂盒、质粒提取试剂盒购自OMEGA公司。
1.2 方法
1.2.1 嗜麦芽寡养单胞菌SMP蛋白的可调控分泌观察 将收集到的不同来源的嗜麦芽寡养单胞菌菌株接种到含不同成分的液体培养基中培养后观察SMP蛋白的胞外分泌情况,具体操作如下。将D2菌株和9株临床株接种于LB平板培养基30 ℃过夜培养,取单个菌落接种于LB液体培养基中,30 ℃培养至OD600值约为0.6,以1∶100的体积比例将各菌株分别接种于酵母蛋白胨液体培养基、蛋白胨液体培养基、LB液体培养基、胰蛋白胨液体培养基和0.25%、0.5%、1.0%麦芽糖的蛋白胨液体培养基中,30 ℃培养48 h,调整OD600值为1.5,吸取等量菌液,12 000 r/min离心10 min后,直接吸取上清液进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),观察并分析蛋白分泌情况。
1.2.2 嗜麦芽寡养单胞菌smp基因的PCR扩增 细菌基因组DNA提取采用基因组DNA的试剂盒(Wizard Genomic DNA Purification Kit)参照说明书进行操作。参照文献[10]设计扩增SMP蛋白基因(smp)的引物,正向引物为5′-CATGCCCTGCCACTGATAGAC-3′,反向引物为5′-GGCGTGTAGTGAGCCGTTCCTC-3′,由上海生工生物工程公司合成。PCR反应体系(50 μL):模板2.0 μL,TaqDNA聚合酶0.5 μL,10×PCR缓冲液5.0 μL,dNTPs(2.5 mmol/each)8.0 μL,引物(10 μmol/L)各2.0 μL。扩增条件:94 ℃ 5 min后,94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,共30个循环,然后72 ℃延伸10 min,产物经1.2%琼脂糖凝胶电泳鉴定。
1.2.3 PCR产物的克隆及测序 PCR扩增片段使用OMEGA公司生产的切胶回收试剂盒(E.Z.N.A.Gel Extraction Kit)纯化后,分别在16 ℃低温循环仪中与pMD18-T载体过夜连接,TSS法转化入大肠埃希菌JM109中,接种ALB平板过夜培养,蓝白斑法筛选重组克隆。取阳性克隆接种ALB液体培养基过夜培养,用OMEGA公司质粒提取试剂盒(Plasmid Mini Kit I)提取质粒,经EcoRⅠ和HindⅢ双酶切鉴定后,送上海生工生物工程公司测序。
1.2.4 SMP蛋白氨基酸序列分析及系统发育树构建 用DNAStar软件分析获得的各基因序列,寻找完整的开放读码框架(ORF),并将其翻译成氨基酸序列。用NCBI的Blast比较各菌株SMP的氨基酸序列,用DNAstar之Megalign软件进行多序列比较,分析序列中的保守性,使用SignalP 4.1 分析SMP蛋白的信号肽剪切位点。从GenBank中选取收录的与SMP氨基酸相似度较高且来源明确的相关蛋白的氨基酸序列,用MEGA5.1软件以N-J法分析生成系统发育树,Bootstrap法(重复数25 000)进行检验。
2 结果与分析
2.1 嗜麦芽寡养单胞菌SMP蛋白的可调控分泌现象的观察与分析
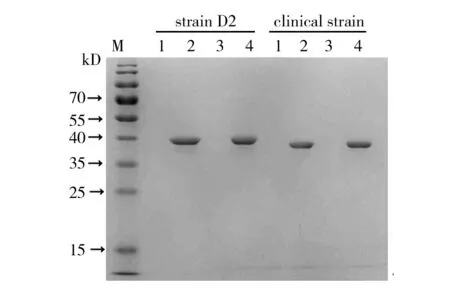
图1 4种培养基中嗜麦芽寡养单胞菌D2株和临床株MY1胞外分泌蛋白SDS-PAGEFig.1 Results of protein SDS-PAGE of S. maltophilia strain D2 and clinical strain MY1 in four kinds of culture medium
SDS-PAGE发现临床收集的9株嗜麦芽寡养单胞菌临床株及D2株在蛋白胨液体培养基和胰蛋白胨液体培养基中均可大量分泌胞外蛋白,而在酵母蛋白胨液体培养基和LB液体培养基中则未见明显分泌(图1示D2株和临床株MY1,其余临床株蛋白分泌结果与MY1完全一致,略,下同),提示酵母提取物抑制嗜麦芽寡养单胞菌蛋白的胞外分泌。此外,适量的麦芽糖可以提高蛋白胞外分泌的产量,其中在浓度为0.5%麦芽糖蛋白胨液体培养基中蛋白分泌量最多(图2)。

图2 不同浓度麦芽糖蛋白胨培养基中嗜麦芽寡养单胞菌D2和临床株MY1胞外分泌蛋白SDS-PAGEFig.2 Results of protein SDS-PAGE of S. maltophilia strain D2 and clinical strain MY1 in peptone medium with different concentration maltose
2.2 嗜麦芽寡养单胞菌smp基因的PCR扩增及克隆鉴定
PCR扩增9株嗜麦芽寡养单胞菌基因组所得到的产物长度约为1 377 bp,与设计相符。纯化产物后连接pMD18-T载体,转化得阳性克隆后酶切鉴定。部分PCR扩增产物1.2%琼脂糖凝胶电泳结果见图3,部分重组质粒酶切鉴定结果见图4。
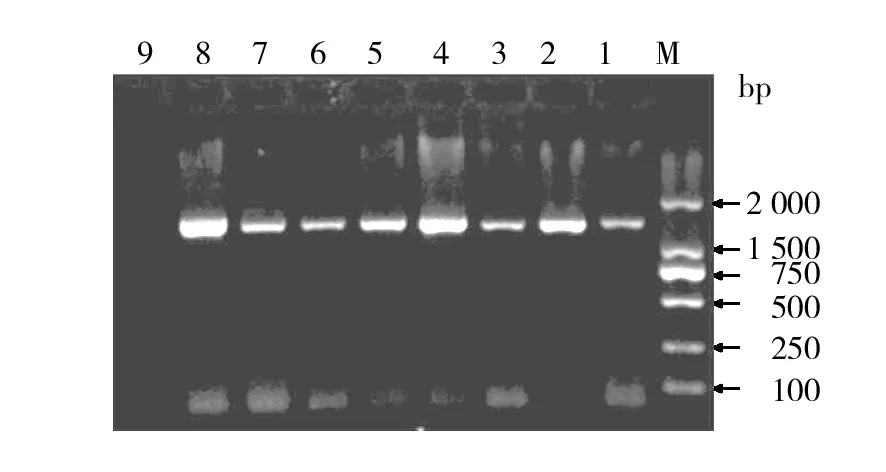
图3 嗜麦芽寡养单胞菌smp基因的PCR扩增Fig.3 Gel electrophoresis results of PCR production of smp gene
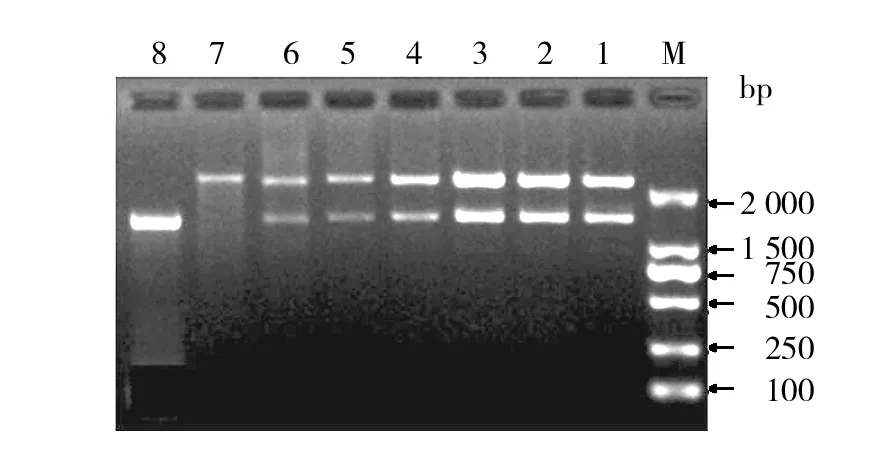
图4 重组质粒的酶切鉴定Fig.4 Identification of the recombinant plasmids by restriction enzyme
2.3 嗜麦芽寡养单胞菌SMP氨基酸序列的分析
所有测序序列均获得GenBank收录号(KX419559、KX419560、KX419561、KX419562、KX419563、KX419564、KX419565、KX419566、KX419567)。经分析,9株临床株smp基因的PCR产物序列内,均能找到一个完整的ORF,将其翻译均可获得一个长度为391氨基酸的序列,比此前我们获得的D2株 SMP氨基酸序列少19个氨基酸,这与蛋白电泳结果相符(图1)。对该蛋白序列进行进一步分析发现,都含有1个腺苷三磷酸结合盒转运蛋白(ABC转运蛋白)超家族保守结构域;SignalP 4.1 分析则显示临床株蛋白氨基酸序列在前端均存在一个长度为24氨基酸的信号肽序列,且与D2株信号肽序列一致。
经NCBI的Blastp比较发现,9株临床株与GenBank中嗜麦芽寡养单胞菌临床来源株K279a的碱性磷酸酶氨基酸序列相似度为96.2%~99.7%,与植物来源的R551-3株相比为78.6%~79.3%,而D2株与K279a和R551-3该氨基酸的相似度依次为68.5%和73.6%。此外,9株临床株与亲缘关系较近的假单胞菌属的铜绿假单胞菌、荧光假单胞菌及P.koreensis存在相似度为50%~45%的氨基酸序列。
2.4 嗜麦芽寡养单胞菌SMP蛋白氨基酸序列系统发育分析
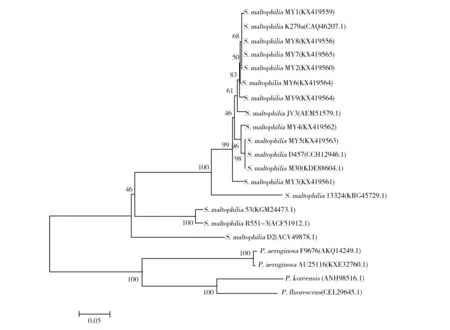
图5 嗜麦芽寡养单胞菌SMP蛋白氨基酸序列的系统发育分析Fig.5 Phylogenetic analysis of amino acid sequences of SMP protein of Stenotrophomonas maltophilia
从GenBank中收集部分与SMP相似度较高的序列,与9株临床株、D2株用MEGA5.1构建的系统发育树如图5所示,临床株SMP氨基酸序列与分离于血液的K279a、D457等亲缘较近,而与D2株和R551-3株的进化距离相对较远,而假单胞菌属中的铜绿假单胞菌、荧光假单胞菌及P.koreensis则在一个更远的独立分枝上,提示该氨基酸序列有显著的种属特异性,且与菌株分离来源有关。
3 讨 论
嗜麦芽寡养单胞菌是一种分布广泛的环境菌,同时也是现在医院感染的常见条件致病菌,研究发现不同菌株具有多种不同生物学活性,且各种物质代谢活跃[11-12]。前期研究发现,分离自海洋生物双齿围沙蚕体内的D2株能大量胞外分泌一种SMP蛋白,且其分泌受培养基成分的影响差异较大。本文对该现象进行了进一步的研究,以期能为探讨嗜麦芽寡养单胞菌蛋白分泌、致病及耐药机制提供新的线索。
首先观察了SMP蛋白分泌的影响因素,结果显示,临床分离株及来源于环境的D2株均可在蛋白胨培养基中大量胞外分泌该蛋白(研究中采用的是将未经浓缩的不含菌细胞的细菌培养液上清直接进行蛋白电泳),而当培养基中含有酵母提取物时(如LB培养基)则未见分泌,提示酵母提取物中的某种或某些成分对嗜麦芽寡养单胞菌该蛋白的分泌有较强的抑制作用。此外,在0.5%的麦芽糖中,蛋白的分泌较其他浓度稍高,而多种其他碳水化合物对该蛋白的分泌无明显影响。我们的其他研究已证明,SMP蛋白的分泌是通过T2SS进行的,T2SS广泛存在于革兰阴性细菌中,是该类细菌的主要代谢途径之一,参与胞外酶、蛋白酶、毒力因子的分泌,其在嗜麦芽窄食单胞菌发病机制中起重要作用[13-14]。那么可以推测,酵母提取物的蛋白分泌抑制作用可能是通过作用于T2SS中某个环节实现的,这一现象非常值得深入研究。我们计划利用高效液相色谱分析法(HPLC)分离酵母提取物,然后再测试各分离组分对SMP表达的影响,以进一步明确该成分。
通过对临床来源株和非临床来源株(以下称为环境株)SMP氨基酸序列的分析,也发现了比较有趣的现象:临床株的SMP蛋白具有很高的保守性,氨基酸序列同源性在96%以上,而环境株的同源性却仅在70%左右。以氨基酸序列构建的系统发育树显示,①临床株大多在一个进化枝上,环境株(D2、R551-3)则与之有一定的进化距离;②SMP有一定种属的保守性,与近缘的假单胞菌属(嗜麦芽寡养单胞菌曾经在分类学上属于该属)的细菌进化距离相对较远,序列同源性低至50%以下。该现象提示,SMP的序列变化可能与对人的致病性相关,亦或因为不同人体内环境差异较小,导致其序列在进化过程中保持稳定。
此外,临床株、环境株的SMP序列前端均含有较为保守的sec信号肽,再次提示其分泌可能与T2SS相关。对SMP蛋白氨基酸序列的分析还显示,该蛋白应该为一种碱性磷酸酶,此前的研究已表明其具有明显的碱性蛋白酶活性[15],因此SMP可能是一种具有多种生物学活性的蛋白。
综上所述,本研究所涉及的嗜麦芽寡养单胞菌均可以可调控地胞外分泌一种SMP蛋白,且分泌受酵母提取物中成分的抑制;临床株SMP的氨基酸序列具有较高的保守性,而环境株保守性相对较低;SMP是一种具有多种生物学活性的蛋白,对该菌的致病可能发挥着一定作用。因此,SMP及其胞外分泌的可调控机制值得进一步深入探究。
[1] Youenou B, Favre-Bonté S. Comparative Genomics of Environmental and ClinicalStenotrophomonasmaltophiliaStrains with Different Antibiotic Resistance [J]. Genome Biol Evol, 2015, 7(9): 244-255.
[2] MartínezR, PlascenciaC,AudeloR,et al. Cultivable endophytic bacteria from leaf bases of Agave tequilana and their role as plant growth promoters[J]. Braz J Microbiol, 2015, 45(4):1333-1339.
[3] Swiontek B, Jankiewicz U, Burkowska A, et al. Chitinolytic microorganisms and their possible application in environmental protection [J]. Curr Microbiol, 2014, 68(1): 71-81.
[4] Dwivedi S, Singh B, Al-KhedhairyA,et al. Isolation and characterization of butachlor-catabolizing bacterial strainStenotrophomonasacidaminiphilaJS-1 from soil and assessment of its biodegradation potential [J]. Lett Appl Microbiol, 2010, 51(1): 54-60.
[5] Jankiewicz U, Brzezinska M, Saks E. Identification and characterization of a chitinase ofStenotrophomonasmaltophilia,a bacterium that is antagonistictowards fungal phytopathogens[J].J Biosci Bioeng, 2012, 113(1):30-35.
[6] Saba I, Qazi P, Rather S, et al. Purification and characterization of a cold active alkaline protease fromStenotrophomonassp. [J]. World J Microbiol Biotechnol, 2012, 28(3): 1071-1079.
[7] 唐敏,李丽,肖蓉,等.嗜麦芽寡养单胞菌胞外蛋白酶功能研究进展[J].微生物学报,2016,56(5):731-739.
[9] 张卫, 毕春霞, 罗玮,等. 嗜麦芽寡养单胞菌D2株2套Ⅱ型分泌系统的全基因簇序列测定及分析[J]. 微生物学杂志, 2013, 33(5): 12-17.
[10]秦江楠,毕春霞, 陈秀琴,等. 嗜麦芽寡养单胞菌D2株smp基因缺失株的构建及鉴定[J]. 微生物学杂志, 2014, 34(3): 30-35.
[11]Brooke JS. New strategies againstStenotrophomonasmaltophilia: a serious worldwide intrinsically drug-resistant opportunistic pathogen[J]. Expert Rev Anti Infect Ther, 2014, 12(1): 1-4.
[12]Abbott I, Slavin M, Turnidge J, et al.Stenotrophomonasmaltophilia: emerging disease patterns and challenges for treatment [J]. Expert Rev Anti Infect Ther, 2011, 9(4): 471-488.
[13]Korotkov K, Sandkvist M, Hol W. The type II secretion system: biogenesis,molecular architecture and mechanism[J]. Nat Rev Microbiol, 2012, 10(5): 336-351.
[14]Karaba S, White R, Cianciotto N, et al.Stenotrophomonasmaltophiliaencodes a type II protein secretion system that promotes detrimental effects on lung epithelial cells[J]. Infect Immun, 2013, 81(9): 3210-3219.
[15]闫志勇, 毕春霞, 辛晓妮,等. 1株高产蛋白酶嗜麦芽寡养单胞菌的分离鉴定及其酶学活性的研究[J].微生物学杂志, 2010, 30(5): 7-11.
·写作常识·
本刊常用的计量单位
为了更好地执行国务院发布的《关于在我国统一实行法定计量单位的命令》的规定,根据国标(GB3100~3102-93)标准,单位符号一般用英文小写(正体),来源于人名的单位,其符号的首字母大写,只有体积单位升例外,它的符号用“L,(l)”,推荐采用L。现将本刊常用计量单位符号及与之容易混淆的符号介绍如下,希望作者参照执行。
时间:年用a,不用y,yr;星期、周(无符号),不用wk;月(无符号),不用mo;日用d,不用day;小时用h,不用hr;分钟用min,不用m;秒用s,不用sec表示。
溶液浓度:用mol/L,不用M(克分子浓度)和N(当量浓度)等非许用单位表示。
百分浓度:务必注明是重量百分浓度,还是体积百分浓度。
面积:公顷用hm2,不用ha,亩或公亩,换算因数为 1hm2=15亩。
旋转速度:用r/min,×g,不用rpm。
蒸汽压力:用Pa或kPa、MPa表示,不用大气压at,kg/m2或kg/cm2等。
光密度:用OD(斜体)表示。
生物大分子的分子量:蛋白质用u或ku,核酸用bp或kb表示。
Extracellular Regulatable Secretion and Sequence Analysis of SMP Protein ofStenotrophomonasmaltophilia
GUO Shuang-shuang1, BI Chun-xia2, YANG Li3, LIU Xing-yu1, QIN Jiang-nan1, ZHU Yuan-qi4, WANG Bin1, YAN Zhi-yong1
(1.Coll.ofBasicMed., 2.Affil.QingdaoMuni.Hosp., 3.Affil.QingdaoWom. &Child.Hosp., 4.AffilHosp.,ofQingdaoUni.,Qingdao266071)
In order to observe and investigate the regulatable SMP protein extracellular secretion phenomenon and its mechanism inStenotrophomonasmaltophilia, environmental strain D2 and nine strains collected from clinic were cultured in media containing different ingredients. The secretion of SMP protein in supernatant was observed using SDS-PAGE. Thesmpgene was amplified from genomes extracted from all strains. PCR products were cloned and sequenced to analyze amino acid sequences of SMP with Blastp and Megalign etc, and build phylogeny tree. The results showed that SMP secretion from different sources ofS.maltophilliaall have regulatable phenomenon. Yeast extract can inhibit the secretion of SMP protein and maltose of suitable concentration possessed enhancement. Amino acid sequence comparison and phylogenetic tree analysis showed that amino acid sequence of SMP has species specificity, and there are a certain differences between clinical and environmental strains. The amino acid sequence of SMP protein was highly conserved, while the difference was relatively significant in environmental strains. However, SMP of strains from different sources contains conserved signal peptide; Suggested that SMP protein probably correlated to the pathogenicity of the protein. The regulatable mechanism of SMP secretion is worthy for further deepening study.
Stenotrophomonasmaltophilia; protein secretion; regulative secretion; sequence analysis
山东省优秀中青年科学家科研奖励基金项目(BS2011SW005);山东省科技公关基金项目(2007GG3WZ05009)
郭双双 女,硕士研究生。研究方向为医学微生物学。E-mail:15264260038@163.com
2016-06-29;
2016-08-06
Q939.93;R378
A
1005-7021(2016)06-0082-06
10.3969/j.issn.1005-7021.2016.06.014
毕春霞 女,副主任技师。研究方向为临床检验诊断学。前两位作者对本文有同等贡献,均为第一作者。
* 通讯作者。男,博士,副教授,硕士生导师。研究方向为病原微生物学。Tel:0532-83780059,E-mail:yanzhiyong@qdu.edu.cn

