微藻水热液化生物油物理性质与测量方法综述
张冀翔,王东,魏耀东(中国石油大学(北京)化学工程学院,北京 102249)
微藻水热液化生物油物理性质与测量方法综述
张冀翔,王东,魏耀东
(中国石油大学(北京)化学工程学院,北京 102249)
摘要:微藻水热液化生物油由于性质较差,不能直接作为车载燃料使用,而作为原料油与现代石油炼制工艺相结合是一种新的应用途径。本文综述了微藻水热液化生物油的物理性质,包括密度、黏度、酸性、热值与元素组成、沸程、平均分子量等信息,介绍了常用的测量方法与手段。简要回顾了微藻水热液化生物油的精制研究,分析比较了不同精制方法及其效果。重点指出微藻水热液化生物油与重质原油和常减压渣油等劣质原料油相比,具有密度和黏度相近、酸值较高、氮氧元素含量较高、热值较低、重质组分和大分子含量较高等特点,加氢精制能够有效提升微藻水热液化生物油性质,但受反应器结焦、催化剂成本和氢气消耗等因素制约,至今未有突破性成果。
关键词:生物燃料;水热;液化;微藻;物理性质
第一作者及联系人:张冀翔(1986—),男,博士,讲师,从事生物质燃料研究。E-mail zhjx916@163.com。
生物质是唯一可以用于大规模制取液体燃料的含碳可再生能源。面对过度使用化石燃料带来的气候变化和环境污染等问题,由于生物质能的零碳排放特性,研究以生物质为原料生产液体运输燃料具有重大意义。以液体燃料为目标产物的生物质转化技术,包括生物化学转化和热化学转化两种途径,其中热化学转化又有快速热裂解、间接液化(气化-合成)和水热液化等不同工艺。水热液化,是指生物质在中等温度(200~375℃)和水热条件下反应,生成一种油状产物(生物油),同时得到气体、水相成分和固体残渣等其他副产物的过程。水热液化工艺不需要对原料进行干燥,降低了过程能耗,特别适合处理含水量较高的生物质原料。
进入21世纪后,伴随着第三代生物质燃料——微藻基生物燃料的研究热潮,水热液化工艺研究进入新的阶段。相比传统农林生物质,微藻具有单位时间内单位面积生物质产量高、不占用农业耕地等优势,是理想的生物质原料来源。一方面,研究者将水热液化工艺与微藻应用相结合,如处理含油微藻萃取后的藻渣[1-2],或将用于污水处理的微藻进行能源化利用,或与微藻在电厂烟气固碳方向的应用相结合等[3];另一方面,研究者开始关注生物油油品的改性,如利用加氢金属催化剂对水热液化工艺进行优化[4],或对制备得到的生物油进行精制等[5]。面对新的发展机遇,研究者也不断对水热液化工艺进行总结。国际上,TOOR等[6]总结了水热条件下生物大分子的转化机理,AMIN等[7]整理了不同工艺参数对水热液化工艺的影响,SAVAGE等[8]对催化剂作用下水生植物的水热反应进行了总结,SKERGET等[9]对农业和食品加工业废弃物水热反应的基本原理和研究进展进行了概括,XIU等[10]对生物油的性质及提质改性方法进行了综述。在国内,黄付彬等[11]对藻类直接液化制取液体燃料的研究现状和发展趋势进行了评述,王敏丽等[12]总结了纤维素、木质素、藻类等多种有机质的水热液化过程,并对液化机理进行了阐述。此外,还有一些关于生物质热化学转化的综述[3,13-15],也对水热液化工艺进行了论述。
然而以上综述中针对水热液化生物油油品分析的篇幅较少,为填补上述空白,本文将主要对微藻水热液化生物油(以下简称微藻生物油)的物理性质进行综述,包括密度、黏度、酸性、热值与元素组成、沸程、平均分子量等信息,比较分析其与重质原油和常减压渣油等劣质原料油之间的差异,并简要介绍常用的测量方法。
1 微藻生物油的物理性质
微藻水热液化反应结束后,液相产物通常会在重力作用下分层,形成漂浮在水相产物上的油状产物[2,16],研究者一般先将产物经溶剂(正己烷、二氯甲烷等)萃取,再把溶剂蒸发脱除得到生物油。通常,微藻生物油是一种黑色、不透明、沥青状物质。
1.1密度
生物油的密度在生产和储运过程中有着重要意义。生物油密度的测量方法(GB/T 2013)有密度计法(GB/T 1884)、比重瓶法(GB/T 13377)和U形振动管法(SH/T 0604)等。标准密度计法和比重瓶法的生物油用量较大,对于实验室小型水热液化装置,可采用U形振动管法。
由水热液化产物的分层现象可以推测,微藻生物油的密度比水略小。研究结果显示,微藻生物油密度约为0.940~0.970g/cm3,大于内燃机燃料油,与劣质原料油相当(0.930~1.000g/cm3)。ROUSSIS 等[17]对微藻Nannochloropsis进行水热液化,反应温度260℃,生物油密度为0.9612g/cm3(22.8℃)。ZHU等[2]对微藻N. salina在约350℃条件下进行水热液化,得到生物油密度为0.943g/cm3(40℃)。ELLIOTT等[18]研究了4种不同来源的微藻Nannochloropsis sp.,水热液化温度约350℃,生物油密度为0.943~0.960g/cm3(40℃)。可见不同原料、不同水热液化温度条件下,微藻生物油的密度差别不大。AMIN等[7]推荐300℃作为木质纤维素类生物质水热液化温度,最新的文献综述[19]显示,多数微藻水热液化研究者选择将反应温度升高到350℃(见表1)。
1.2黏度
黏度是评定油品流动性的指标,不仅与油品的输送性能密切相关,也是炼油工艺计算的重要参数,还直接影响燃料油的雾化性能。生物油黏度的实验室测量方法主要是毛细管黏度计法(GB/T 265) ,也可以利用各种自动黏度仪(ASTM D1200 D2983 D7042等)。自动黏度仪可以自动完成整个测量循环,测量精度高,测量范围宽,实验室有条件可以采用自动黏度仪进行测量。
微藻生物油黏度约为100~400cP(40℃,1cP=1mPa·s),与孤岛原油(333.7 cP,50℃[20])等重质原油接近,高于木质纤维素类生物质快速热裂解生物油(40~100cP 50℃[14])。DAS等[21]对微藻S. platensis进行水热液化,得到生物油黏度为189.8cP(40℃),高于同种原料热裂解生物油79.2cP (40℃)。ELLIOTT等[18]对4种微藻Nannochloropsis sp.的水热液化研究显示,制得的生物油黏度为109~338cP(40℃),且原料油脂含量对生物油黏度没有显著影响。MINOWA等[22]对微藻Dunaliella tertiolecta分别在250℃、300℃、340 ℃ 3个不同温度下进行水热液化,发现所得生物油的黏度随反应温度的升高明显降低。YUAN等[23]利用甲醇、乙醇和二烷等溶剂对微藻Spirulina进行水热液化,发现液化溶剂对生物油黏度和密度有很大影响。由于水在处理微藻等含水量较高的生物质原料时具有独特优势,因此本文不再讨论其他溶剂条件的情况。
1.3酸性
微藻生物油呈一定酸性,给其储存、运输和加工等环节带来腐蚀问题。与原油类似,生物油酸性常用总酸值(total acid number,TAN mgKOH/g) 来表示,主要的测量方法有滴定法(GB/T 264)、电位滴定法(GB/T 7304)、颜色指示剂法(GB/T 4945)、半微量颜色指示剂法(SH/T 0163)等。其中滴定法、颜色指示剂法和半微量颜色指示剂法是根据颜色的变化判断终点,方法简单,不需要其他特殊设备,但对深色油品的终点难以判断,而电位滴定法是根据电极电位的变化判断终点,不受溶液颜色的限制,更适合微藻生物油总酸值的测量。
总酸值较高的环烷基原油,如单家寺原油,其总酸值为7.4 mgKOH/g[20],微藻生物油总酸值则远高于此,达到50 mgKOH/g以上。DUAN等[5,24]对微藻Nannochloropsis sp.和C. pyrenoidosa进行水热液化,得到生物油总酸值分别为256mgKOH/g和 133.2mgKOH/g;ELLIOTT等[18]对4种微藻Nannochloropsis sp.的水热液化研究显示,生物油总酸值为59~74mgKOH/g。微藻生物油的酸性,主要来自水热液化反应中生成的酸性含氧化合物,因此在不同原料和不同工艺条件下会有一定差别。
1.4元素组成与热值
热值是燃料质量的一项重要指标,生物油热值越高,其能量密度越大,相对运输成本就越低。生物油热值可以通过氧弹量热仪直接测量,但更多研究者选择利用元素组成由计算公式得出。针对氮、硫元素和灰分含量的不同,常用的计算公式有Dulong公式HHV(MJ/kg) = 0.3382C + 1.4428 (H−O/8)、Boie公式HHV(MJ/kg) = 0.3516C + 1.16225H - 0.1109O + 0.0628N + 0.10465S、Channiwala和Parikh公式HHV(MJ/kg) = 0.3491C + 1.1783H + 0.1005S - 0.1034O - 0.0151N -0.0211Ash等,FASSINOU等[25]对计算公式进行了总结。元素组成,不仅是微藻生物油热值计算的依据,也是分析其复杂混合物体系化学组成和结构的入手点。研究者一般利用元素分析仪,分析生物油中碳、氢、氮、硫和氧元素含量。
由于不同种类微藻元素及化学组成存在差异,其水热液化生物油元素组成也有所不同。表1对微藻生物油的元素组成及热值进行了总结,其大致范围是碳70%~80%、氢8%~10%、氮4%~8%、硫<1%、氧8%~15%、热值32~38 MJ/kg。与重质原油或常减压渣油相比,微藻生物油的特点是:H/C比较低,氮、氧含量较高,硫含量较低。这意味着微藻生物油中含有较多的芳香基和不饱和键,且存在大量非烃化合物,如含氮、含氧化合物等,热值相对较低,但更加清洁。由表1可知,生物油中氮、氧含量远低于原料,说明水热液化过程中有脱氮、脱氧反应发生。TOOR等[26]研究显示,随着反应温度升高到350℃,生物油中氮、硫、氧含量显著降低,生物油热值升高。
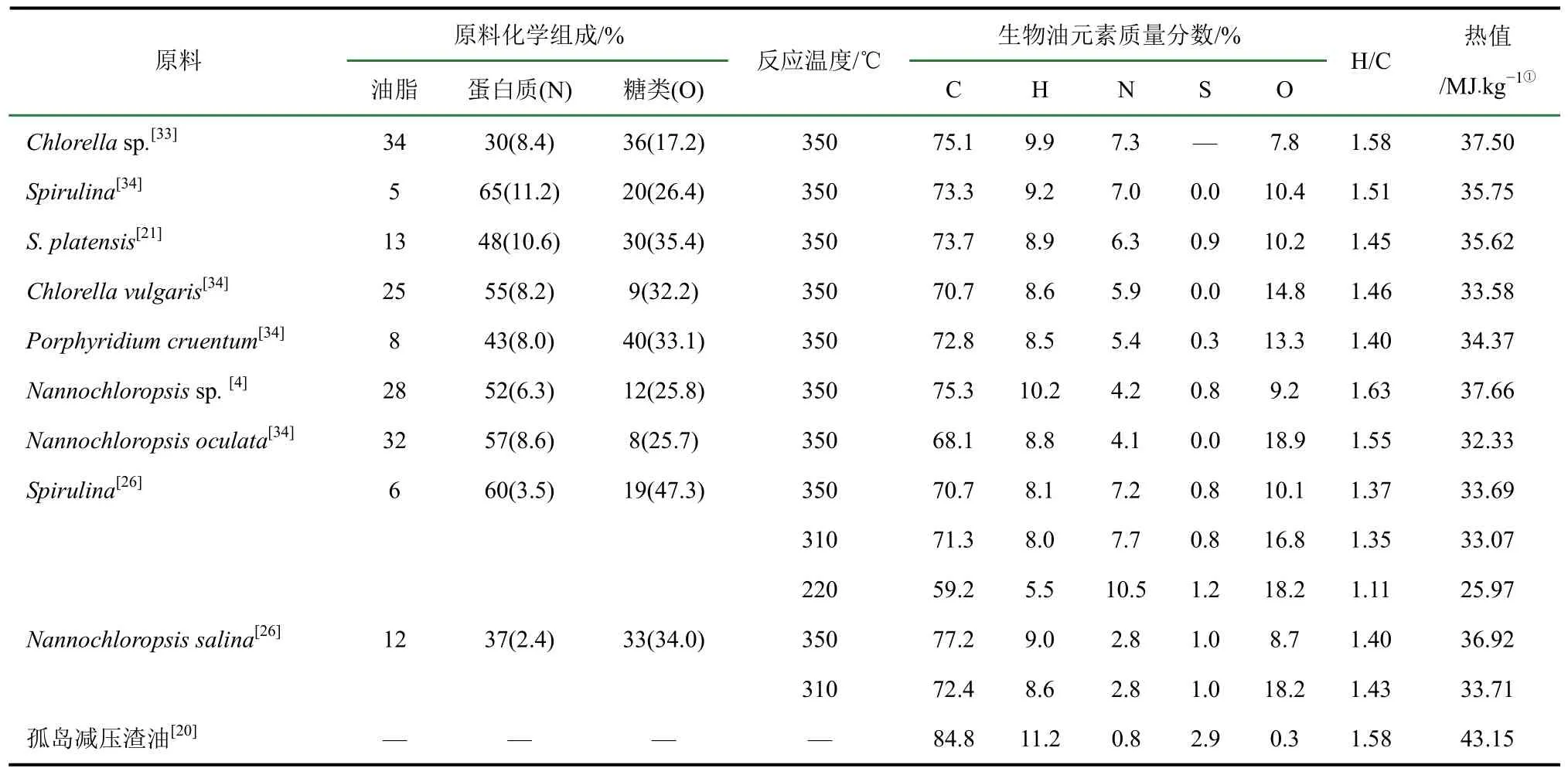
表1 微藻生物油的元素组成与热值
1.5沸程分布
由元素组成分析可知,微藻生物油与重质原油相比,烷烃特别是直链烷烃含量低,芳香基、不饱和键以及杂原子化合物含量高,因此其沸程分布也有所不同。生物油沸程分析主要是利用高温气相色谱(汽化温度>400℃)法进行模拟蒸馏(ASTM D2887,D7169)。ROSS等[27]提出利用热重法分析生物油沸程,但热重法受加热速率影响,当缺少高温气相色谱实验条件时,该方法可作为补充。
微藻生物油与重质原油相比,低沸点组分含量较低,高沸点组分含量较高。VARDON等[28]分析了微藻Spirulina、Scenedesmus生物油的沸程分布,并与Illinois页岩油进行了对比,微藻生物油沸程400℃以上约占46%~55%,其中约20%属于减压渣油(>538℃),而与轻质油品相关的低沸点(100~200℃) 组分含量不足5%,明显低于Illinois页岩油。ROSIS等[17]报道了相似的研究结果,微藻Nannochloropsis生物油沸程主要分布在332~549℃,约占64%,沸程254℃以下少于5%。EBOIBI 等[29]对微藻Spirulina sp.、Tetraselmis sp.生物油的实验数据也验证了微藻生物油沸程分布的一般特点。
1.6平均分子量
微藻生物油是一种复杂混合物体系,分子量范围很广,平均分子量可以通过尺寸排阻色谱法(size exclusion chromatography,SEC)测量,它是根据试样分子的尺寸和分子量不同来实现分离的。测量时生物油通常溶解在有机流动相中,因此该方法也被称为凝胶渗透色谱法(gel permeation chromatography,GPC)。
生物油中含有大量重质分子,VARDON等[30]报道微藻Spirulina生物油的重均相对分子质量Mw和数均相对分子质量Mn分别为1870和890,其相对分子质量范围一直延续到10000以上。VARDON 等[28]还对微藻Spirulina、Scenedesmus生物油和Illinois页岩油进行了分析对比,两种生物油的平均相对分子质量Mw/Mn分别为1860/700和3260/1330,远高于页岩油的670/270。ALBA等[31]报道了类似的结果,反应温度250℃,微藻Desmodesmus sp.生物油中含有大量重质分子(2000~10000),并有3个明显的分布峰(400~500,900~1000,1000~1100);当反应温度升高到375℃时,重质分子含量降低,轻质分子含量增加。BARREIRO等[32]测量了8种不同微藻生物油的相对分子质量分布,在上述相同范围内出现分布峰,随着反应温度的升高,峰逐渐宽化并向轻质分子一端移动。
2 微藻生物油的精制
除反应条件苛刻、设备投资成本较高外,生物油的劣质性进一步限制了其作为化石燃料替代品的应用范围。微藻生物油存在黏度大、酸值高、氮氧元素含量高、热值低等缺点,其性质与汽柴油相距甚远,不能直接作为内燃机燃料使用,因此研究者尝试了多种方法对微藻生物油进行加工精制。
2.1催化加氢液化
催化加氢液化是指在水热液化过程中,加入催化剂或氢气气氛,以提升生物油性质。催化加氢液化催化剂主要有均相酸碱催化剂和异相金属催化剂。
2.1.1均相酸碱催化剂
均相本酸碱催化剂主要是通过强酸或强碱性化合物,增加反应环境中H+或OH−浓度,促进生物质大分子分解和生物油生成[35]。其中研究较多的是Na2CO3,文献普遍认为Na2CO3可以增加液化反应转化率和生物油产率,并轻微提高生物油热值[22,36-38]。对于其他性质如黏度,则是温度的影响仍然起主导作用,催化剂在不同温度下对生物油黏度的影响并不一致。MINOWA等[22]以Na2CO3为催化剂,考察了微藻Dunaliella tertiolecta在不同温度下的液化行为,结果表明反应温度为300℃时,加入5%的Na2CO3可以明显降低生物油的黏度(14000cP降至5000cP),但在250℃和340℃条件下,加入催化剂使得生物油黏度有不同程度增加。JENA等[35]在相同的催化剂用量下进行了微藻Spirulina platensis的水热液化研究,结果显示反应温度为350℃时,加入Na2CO3使得生物油黏度增大(52.10cP升至74.60cP)。此外,ROSS等[27]对比了碱性催化剂(Na2CO3、KOH)和有机酸性催化剂(CH3COOH、HCOOH)对水热液化的影响,研究发现使用有机酸性催化剂生物油具有较低的沸点和较好的流动性。
2.1.2异相金属催化剂
异相金属催化剂主要是负载型贵金属或过渡金属催化剂,通过在反应过程中引入氢气气氛,促进加氢反应进行。由于加氢脱氧、加氢脱氮等各类加氢反应存在,生物油元素组成和热值均能得到改善。DUAN等[4]进行了微藻Nannochloropsis sp.的催化加氢液化研究,结果显示,在水热液化过程中加入Pt/C等催化剂后,生物油H/C和O/C分别由1.68 和0.092改善至1.74和0.082,黏度也明显降低。BILLER等[39]考察了Co-Mo/Al2O3、Ni/Al2O3和Pt/Al2O3对微藻Chlorella vulgaris和Nannochloropsis occulta水热液化的影响,3种催化剂都具有一定脱氧能力,其中Co-Mo/Al2O3和Pt/Al2O3可以脱除碳水化合物和蛋白质中的氧,而Ni/Al2O3可以脱除脂类中的氧,与不加催化剂相比,生物油中氧含量普遍降低了2%~10%。XU等[40]考察了Ce/HZSM-5对微藻Chlorella pyrenoidosa水热液化的影响,结果显示Ce/HZSM-5具有明显的脱氮效果,微藻生物油氮含量由7.44%降至0.24%。
2.2催化加氢精制
与催化加氢液化不同,催化加氢精制是在水热液化反应结束后,针对制得的生物油进行精制,常用催化剂包括石油化工加氢催化剂和贵金属催化剂。DUAN等[5,33]研究发现微藻生物油催化加氢精制效果明显,在Pt/C和高压氢气条件下,生物油O/C和N/C分别由0.063和0.054降至0.041和0.023,酸值由256 mgKOH/g降至25.3 mgKOH/g,热值提高到43.0 MJ/kg,此外Ru/C和Raney-Ni也有较好的提质效果。ELLIOTT等[18]利用连续流两段式加氢装置对微藻生物油进行了催化加氢精制研究,实验装置如图1所示[41]。生物油和氢气从顶部进入固定床催化反应器,以滴流的形式向下穿过床层,离开反应器后,产物被冷却并被双缸采样系统收集。区域一低温加氢段使用Ru/C催化剂,区域二高温加氢段使用硫化Co-Mo催化剂,通过两段式加氢处理,生物油密度降低到汽柴油水平(0.77~0.80g/mL),黏度降低至3.6cP(40℃)以下,酸值降低至0.2mgKOH/g以下,氮氧元素含量分别降低至0.25%和1.8%以下。
2.3热加工精制
由于催化加氢精制存在催化剂成本高和氢气消耗大等问题,ROUSSIS等[17]提出一种无需催化剂和高压氢气的生物油热处理方法,降低了精制成本。微藻生物油在不同温度(350℃、400℃、450℃)和氮气气氛下热处理60min后,密度由0.9612g/mL降至0.8780g/mL(22.8℃),氧元素含量由5.7%降至0.2%,热值提高到45 MJ/kg,金属元素含量也有所降低。通过模拟蒸馏发现,生物油中高沸点组分减少,低沸点组分增加,改善了生物油的沸程分布。另外,热处理还减少了生物油中的酸性组分,降低了总酸值。热加工精制产率与催化加氢精制相当,约为80%~86%,而反应压力大大降低,仅为4.2 MPa,是一种极具应用潜力的微藻生物油精制工艺。
微藻生物油的精制工艺主要有催化加氢液化、催化加氢精制和热加工精制,催化剂包括均相酸碱催化剂和异相金属催化剂。通常认为,催化加氢精制效果最佳,催化加氢液化和热加工精制则次之。催化加氢液化反应结束后,异相催化剂与固体残渣混合难以分离,且催化剂容易失活,不利于连续生产;均相催化剂成本较低,对微藻生物油的品质提升也有限。催化加氢精制多采用固定床反应器,方便催化剂再生,由于受反应器结焦、催化剂成本和氢气消耗等因素的限制,微藻生物油精炼制备车载动力燃料的研究至今未报道取得突破性进展。
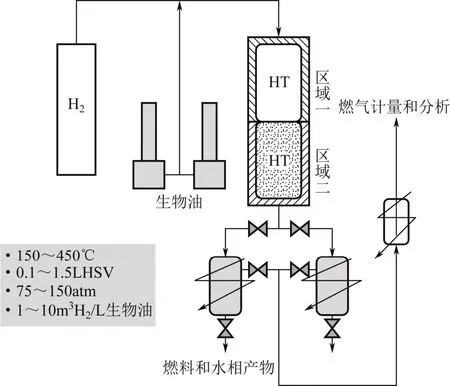
图1 微藻生物油连续流两段式加氢装置[41](1atm=1.013×105Pa)
3 结 语
微藻生物油近些年获得了很大关注,一些课题组已经展开其连续流生产工艺的研究,以便于未来的工业化放大。但要实现微藻生物油的商业推广,不仅需要成熟的技术工艺,还需要合适的应用途径来解决生产成本和经济性等问题。通过总结与分析可以得出,微藻生物油硫含量较低,其密度、黏度与重质原油和常减压渣油等劣质原料油性质相近,作为现代石油炼制工业原料油替代品有很大发展潜力。然而微藻生物油氮、氧元素含量较高,不仅降低了热值,还导致了较高的酸性和腐蚀性;沸程分布和平均相对分子质量也显示,其重质分子含量较高。催化加氢等工艺可以改善微藻生物油的物理性质,为了开发和优化生产、精制工艺,还需要对微藻生物油的化学组成和性质进行进一步研究。
参考文献
[1] CHENG J,HUANG R,YU T,et al. Biodiesel production from lipids in wet microalgae with microwave irradiation and bio-crude production from algal residue through hydrothermal liquefaction[J]. Bioresource Technology,2014,151:415-418.
[2] ZHU Y H. ALBRECHT K O,ELLIOTT D C,et al. Development of hydrothermal liquefaction and upgrading technologies for lipid-extracted algae conversion to liquid fuels[J]. Algal Research,2013,2(4):455-464.
[3] RENNAN L,OWENDE P. Biofuels from microalgae:a review of technologies for production,processing,and extractions of biofuels and co-products[J]. Renewable & Sustainable Energy Reviews,2010,14(2):557-577.
[4] DUAN P G,SAVAGE P E. Hydrothermal liquefaction of a microalga with heterogeneous catalysts[J]. Industrial & Engineering Chemistry Research,2011,50(1):52-61.
[5] DUAN P G,SAVAGE P E. Upgrading of crude algal bio-oil in supercritical water[J]. Bioresource Technology,2011,102(2):1899-1906.
[6] TOOR S S,ROSENDAHL L,RUDOLF A. Hydrothermal liquefaction of biomass:a review of subcritical water technologies[J]. Energy,2011,36(5):2328-2342.
[7] AKHTAR J,AMIN N A S. A review on process conditions for optimum bio-oil yield in hydrothermal liquefaction of biomass[J]. Renewable & Sustainable Energy Reviews,2011,15(3):1615-1624.
[8] YEH T M,DICKINSON J G,FRANCK A,et al. Hydrothermal catalytic production of fuels and chemicals from aquatic biomass[J]. Journal of Chemical Technology and Biotechnology,2013,88(1):13-24.
[9] PAVLOVIC I,KNEZ Z,SKERGET M. Hydrothermal reactions of agricultural and food processing wastes in sub- and supercritical water:a review of fundamentals,mechanisms,and state of research[J]. Journal of Agricultural and Food Chemistry,2013,61(34):8003-8025.
[10] XIU S N,SHAHBAZI A. Bio-oil production and upgrading research:a review[J]. Renewable & Sustainable Energy Reviews,2012,16(7):4406-4414.
[11] 黄付彬,冯丽娟,杨文超,等. 藻类直接液化制取液体燃料研究进展[J]. 化工进展,2012(10):2197-2201,2212.
[12] 王敏丽,陈会会,关清卿,等. 有机质亚/超临界水液化研究进展[J]. 化工进展,2014,33(2):337-345.
[13] PETERSON A A,VOGEL F,LACHANCE R P,et al. Thermochemical biofuel production in hydrothermal media:a review of sub- and supercritical water technologies[J]. Energy & Environmental Science,2008,1(1):32-65.
[14] HUBER G W,IBORRA S,CORMA A. Synthesis of transportation fuels from biomass:chemistry,catalysts,and engineering[J]. Chemical Reviews,2006,106(9):4044-4098.
[15] TRAN N H,BARTLETT J R,KANNANGARA G S K,et al. Catalytic upgrading of biorefinery oil from micro-algae[J]. Fuel,2010,89(2):265-274.
[16] YU G,ZHANG Y H,SCHIDEMAN L,et al. Distributions of carbon and nitrogen in the products from hydrothermal liquefaction of low-lipid microalgae[J]. Energy & Environmental Science,2011,4 (11):4587-4595.
[17] ROUSSIS S G,CRANFORD R,SYTKOVETSKIY N. Thermal treatment of crude algae oils prepared under hydrothermal extraction conditions[J]. Energy & Fuels,2012,26(8):5294-5299.
[18] ELLIOTT D C,HART T R,SCHMIDT A J,et al. Process development for hydrothermal liquefaction of algae feedstocks in a continuous-flow reactor[J]. Algal Research-Biomass Biofuels and Bioproducts,2013,2(4):445-454.
[19] CHOW M C,JACKSON W R,CHAFFEE A L,et al. Thermal treatment of algae for production of biofuel[J]. Energy & Fuels,2013,27(4):1926-1950.
[20] 徐春明,杨朝合. 石油炼制工程[M]. 北京:石油工业出版社,2009:5-45.
[21] JENA U,DAS K C. Comparative evaluation of thermochemical liquefaction and pyrolysis for bio-oil production from microalgae[J]. Energy & Fuels,2011,25(11):5472-5482.
[22] MINOWA T,YOKOYAMA S Y,Kishimoto M,et al. Oil production from algal cells of Dunaliella tertiolecta by direct thermochemical liquefaction[J]. Fuel,1995,74(12):1735-1738.
[23] YUAN X Z,WANG J Y,ZENG G M,et al. Comparative studies of thermochemical liquefaction characteristics of microalgae using different organic solvents[J]. Energy,2011,36(11):6406-6412.
[24] BAI X J,DUAN P G,XU Y P,et al. Hydrothermal catalytic processing of pretreated algal oil:a catalyst screening study[J]. Fuel,2014,120:141-149.
[25] FASSINOU W F,VAN DE STEENE L,TOURE S,et al. What correlation is appropriate to evaluate biodiesels and vegetable oils higher heating value (HHV)?[J]. Fuel,2011,90(11):3398-3403.
[26] TOOR S S,REDDY H,DENG S G,et al. Hydrothermal liquefaction of Spirulina and Nannochloropsis salina under subcritical and supercritical water conditions[J]. Bioresource Technology,2013,131:413-419.
[27] ROSS A B,BILLER P,KUBACKI M L,et al. Hydrothermal processing of microalgae using alkali and organic acids[J]. Fuel,2010,89(9):2234-2243.
[28] VARDON D R,SHARMA B K,BLAZINA G V,et al. Thermochemical conversion of raw and defatted algal biomass via hydrothermal liquefaction and slow pyrolysis[J]. Bioresource Technology,2012,109:178-187.
[29] EBOIBI B E O,LEWIS D M,ASHMAN P J,et al. Hydrothermal liquefaction of microalgae for biocrude production:improving the biocrude properties with vacuum distillation[J]. Bioresource Technology,2014,174:212-221.
[30] VARDON D R,SHARMA B K,SCOTT J,et al. Chemical properties of biocrude oil from the hydrothermal liquefaction of Spirulina algae,swine manure,and digested anaerobic sludge[J]. Bioresource Technology,2011,102(17):8295-8303.
[31] ALBA L G,TORRI C,SAMORI C,et al. Hydrothermal treatment (HTT) of microalgae:evaluation of the process as conversion method in an algae biorefinery concept[J]. Energy & Fuels,2012,26(1):642-657.
[32] BARREIRO D L,ZAMALLOA C,BOON N,et al. Influence of strain-specific parameters on hydrothermal liquefaction of microalgae[J]. Bioresource Technology,2013,146:463-471.
[33] DUAN P G,BAI X J,XU Y P,et al. Catalytic upgrading of crude algal oil using platinum/gamma alumina in supercritical water[J]. Fuel,2013,109:225-233.
[34] BILLER P,ROSS A B. Potential yields and properties of oil from the hydrothermal liquefaction of microalgae with different biochemical content[J]. Bioresource Technology,2011,102(1):215-225.
[35] JENA U,DAS K C,KASTNER J R. Comparison of the effects of Na2CO3,Ca3(PO4)2,and NiO catalysts on the thermochemical liquefaction of microalga Spirulina platensis[J]. Applied Energy,2012,98:368-375.
[36] ZOU S P,WU Y L,YANG M D,et al. Production and characterization of bio-oil from hydrothermal liquefaction of microalgae Dunaliella tertiolecta cake[J]. Energy,2010,35(12):5406-5411.
[37] YANG Y F,FENG C P,INAMORI Y,et al. Analysis of energy conversion characteristics in liquefaction of algae[J]. Resources Conservation and Recycling,2004,43(1):21-33.
[38] ZHOU D,ZHANG L A,ZHANG S C,et al. Hydrothermal liquefaction of macroalgae enteromorpha prolifera to bio-oil[J]. Energy & Fuels,2010,24:4054-4061.
[39] BILLER P,RILEY R,ROSS A B. Catalytic hydrothermal processing of microalgae:decomposition and upgrading of lipids[J]. Bioresource Technology,2011,102(7):4841-4848.
[40] XU Y F,ZHENG X J,YU H Q,et al. Hydrothermal liquefaction of Chlorella pyrenoidosa for bio-oil production over Ce/HZSM-5[J]. Bioresource Technology,2014,156:1-5.
[41] ELLIOTT D C,HART T R,NEUENSCHWANDER G G,et al. Catalytic hydroprocessing of fast pyrolysis bio-oil from pine sawdust[J]. Energy & Fuels,2012,26(6):3891-3896.
·技术信息·
Physical properties and their measuring methods of hydrothermal liquefaction bio-crude from microalgae:a review
ZHANG Jixiang,WANG Dong,WEI Yaodong
(School of Chemical Engineering,China University of Petroleum (Beijing),Beijing 102249,China)
Abstract:Hydrothermal liquefaction (HTL) bio-crude from microalgae cannot be directly used as transportation fuels,but can find new applications when integrated with modern petroleum processing techniques. The physical properties of HTL bio-crude from microalgae,including density,viscosity,acidity,elemental composition,heating value,boiling range distribution and average molecular weight,were summarized and compared to heavy crude oil and residue oil. The measuring methods were also briefly introduced. Upgrading of HTL bio-crude from microalgae was reviewed based on comparing various upgrading methods and performances. It is important to point out that compared with heavy crude oil and residue oil,HTL bio-crude from microalgae has similar density and viscosity,higher acidity,lower heating value,higher content of oxygen and nitrogen and high boiling point components and larger average molecular weight. Hydrotreating of HTL bio-crude from microalgae can significantly improve its quality. However,it was constrained by coking of the reactor,high catalysts cost and hydrogen consumption.
Key words:biofuel; hydrothermal; liquefaction; microalgae; physical property
基金项目:国家自然科学基金(21406265)及中国石油大学(北京)科研基金(2462013YJRC022)项目。
收稿日期:2015-05-04;修改稿日期:2015-05-29。
DOI:10.16085/j.issn.1000-6613.2016.01.013
中图分类号:TK 6
文献标志码:A
文章编号:1000–6613(2016)01–0098–07

