肿瘤相关巨噬细胞在肝癌组织中的表达及其与VEGF的相关性
胡鹏,王卫星,王鹏,邓文宏,余佳
(武汉大学人民医院普通外科,湖北 武汉 430060)
·论 著·
肿瘤相关巨噬细胞在肝癌组织中的表达及其与VEGF的相关性
胡鹏,王卫星,王鹏,邓文宏,余佳
(武汉大学人民医院普通外科,湖北 武汉 430060)
目的 研究肿瘤相关巨噬细胞(TAMs)在肝癌中的表达及其与血管内皮生长因子(VEGF)的相关性。方法采用免疫组织化学双染方法检测2010年1月至2014年1月在我院行肝癌切除术后收集的肝癌组织标本95例,采用免疫组化法分别检测组织中CD163(TAMs标记物)及VEGF的表达,光镜下对TAMs计数及VEGF阳性表达进行分析,并分析其与临床病理参数之间的关系。结果在肝癌组织分期Ⅰ~Ⅱ期的肝癌组织中TAMs平均浸润(38.39±22.13)个,Ⅲ~Ⅳ期的肝癌组织中TAMs平均浸润(48.95±25.32)个(P<0.05),未出现远处转移的肝癌患者组织中TAMs平均浸润(37.41±22.48)个,而出现远处转移的肝癌患者组织中TAMs平均浸润(47.56±26.45)个(P<0.05)。VEGF主要是在肿瘤细胞中呈中等强度表达;并且其表达强度与TAMs计数呈正相关关系(r=0.782,P<0.05)。结论TAMs在肝癌组织中的表达与肝癌侵袭转移特性以及分期有密切关系,并与VEGF表达呈正相关关系,提示TAMs与VEGF的表达可用来预测肿瘤的恶性程度,以及作为肝癌的辅助治疗和改善预后的潜在靶点。
肝癌;肿瘤相关巨噬细胞;血管内皮生长因子;相关性
肝细胞癌(简称肝癌)的发病率居全球男性肿瘤发病原因前列,是最常见的消化系统肿瘤之一[1]。近年来,肿瘤微环境在其发生、发展过程中起到至关重要的作用。存在于微环境中的巨噬细胞(TAMs)表达多种特异抗原,例如CD163、CD68等,被作为抗肿瘤作用较强的起关键作用的细胞,而且现在TAMs与肿瘤发生发展之间的关系逐渐被重视[2]。TAMs具有促进肿瘤侵袭与转移的作用,这种作用是通过参与上皮间质转化(EMT)、血管生成等产生的。据文献表明,TAMs对缺氧比较敏感,表达缺氧诱导因子相对较多,常聚集于微血管周边,而在血管的生成过程中血管内皮生长因子(VEGF)起到关键性的作用[3-4]。本文通过收集临床上肝癌患者的组织标本,并运用免疫组织化学方法检测CD163与VEGF在肝癌组织中的表达,探讨TAMs在肝癌组织中的表达以及与VEGF的相关性,现报道如下:
1 资料与方法
1.1 标本来源 收集武汉大学人民医院肝胆外科2014年1月至2015年6月期间行肝切除术并术后病理切片证实为肝细胞癌的95例石蜡标本,患者术前未行放、化疗等抑制肿瘤生长的治疗。其中男性76例,女性19例;年龄37~78岁,甲胎蛋白(AFP)≤400 μg/L者43例,AFP≥400 μg/L者52例;肝包膜完整者57例,不完整者38例;分化程度低者63例,分化程度高者32例;肝癌TNM分期:Ⅰ~Ⅱ期58例,Ⅲ~Ⅳ期37例;肝癌肿瘤组织Edmondson分级:Ⅰ~Ⅱ级61例,Ⅲ~Ⅳ级34例。
1.2 主要试剂 鼠抗人CD163单克隆抗体购自美国Santa Cruz公司;免疫组化试剂盒,免疫组化双染试剂盒购自北京中杉金桥生物公司。
1.3 免疫组化染色 标本先行甲醛固定,后行石蜡包埋,做成3 μm厚的切片。免疫组化染色严格遵循标准步骤操作。首先使用随机方法选择10个高倍镜下的视野,统计胞浆变成棕色的阳性细胞在其中的百分比,半定量标准如下:<10%(-),≥10%(+),实验使用含有牛血清的磷酸盐缓冲液(PBS)替代一抗作为阴性对照,阳性对照片由试剂公司提供。
1.4 TAMs计数 采用Leek等[5]使用的计数巨噬细胞的方法进行统计:先采用低倍镜观察并选取巨噬细胞比较密集的3个视野进行计数,然后在高倍镜下进行记数,最后获得三组的平均数用来分析。
1.5 VEGF的表达测定 采用半定量积分法判定结果。阳性细胞数在5%以内判为0分,5%~25%判为1分,25%~50%判为2分,50%~75%判为3分,大于75%判为4分;将细胞质染色为无色、浅黄色、棕黄色、棕褐色分别记为0分、1分、2分、3分四个等级。将上述所得结果的乘积作为VEGF的最终判定标准。
1.6 统计学方法 应用SPSS21.0软件进行统计学分析。计量数据以均数±标准差(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义,采用Spearmanm Rank程序进行相关性分析。
2 结 果
2.1 TAMs与VEGF在肝癌组织中的表达 VEGF、CD163染色主要存在于细胞质,细胞膜也有部分染色,见图1、图2。肝癌组织中VEGF与CD163的表达明显高于正常肝脏组织。
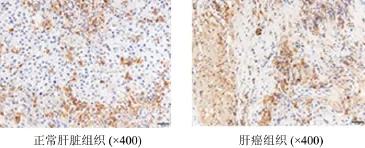
图1 CD163在不同肝脏组织中的表达

图2 VEGF在不同肝脏组织中的表达
2.2 肝癌组织中TAMs与VEGF的表达与临床病理之间的关系 TAMs浸润程度与肿瘤转移及TNM分期有关(P<0.05),见表1。VEGF在分化程度低的肝癌中的阳性率明显高于分化程度高者(P<0.05);VEGF的表达水平在Ⅰ~Ⅱ期肝癌组织中均比Ⅲ~Ⅳ期高(P<0.05);出现淋巴结转移的肝癌细胞中TAMs的阳性率明显高于未出现淋巴结转移者(P<0.05),见表2。

表1 肿瘤相关巨噬细胞浸润与肝癌临床病理特征之间的关系

表2 肝癌组织中VEGF阳性表达与临床病理之间的关系
2.3 TAMs计数与VEGF表达之间的关系 在浸润的间质细胞和癌细胞中,VEGF主要是在肿瘤细胞中呈中等强度表达;经Sperrman相关分析,肝癌组织中VEGF的表达强度与TAMs计数呈正相关关系(r=0.782,P<0.05),见图3。

图3 TAMs与VEGF的相关性:r=0.782,P<0.05
3 讨 论
近年来,炎症在肿瘤发生发展过程中起到不可替代的作用,肿瘤相关巨噬细胞(TAMs)分布于肿瘤免疫微环境中,并在肿瘤发生发展中起到至关重要的作用,越来越成为当前研究的热点。巨噬细胞存在于大多数肿瘤微环境之中,它们通过影响周围炎性介质的产生、细胞增殖信号、组织结构重塑、血管生成来促进肿瘤的生长。近来,TAMs在肿瘤侵袭、转移过程中被广泛关注。常规来说,TAMs存在于大多数恶性肿瘤组织中,并且肿瘤内部及周围均有肿瘤相关巨噬细胞的浸润。TAMs活化之后释放大量炎症介质,对肿瘤组织、细胞以及肿瘤周围组织、细胞产生影响,这可以导致免疫系统紊乱及免疫沉默。TAMs转移到肿瘤当中,并不起杀死肿瘤细胞的作用,而是促进肿瘤的发生、发展。多项研究显示,在肿瘤微环境中TAMs更容易极化成M2型巨噬细胞并促进肿瘤细胞的生长、侵袭跟转移。而CD163是M2型巨噬细胞特异性较高的一个标志物,目前认为其具有减弱炎症损伤,促进肿瘤生长、侵袭的重要作用[6-8]。
研究发现,氧含量的高低可以影响TAMs的表达,TAMs喜厌氧环境,多分布在肝癌等恶性肿瘤的缺氧部位。低氧环境可使细胞分泌前列腺素增加,提高了TAMs对趋化因子的敏感性,并诱导TAMs转移到肿瘤缺氧部位[9]。作为肿瘤侵润白细胞的一个主要成分,TAMs在肿瘤的发展中起到决定性的作用,这个作用是通过表达趋化因子、生长因子(VEGF)、金属蛋白酶类发挥的。而其中VEGF在其中起最重要的作用。
肿瘤生长最重要的是靠肿瘤血管的供血,而肿瘤的侵袭转移又依靠肿瘤血管。研究证实,肿瘤生长如果没有新生血管提供充足的血液则会停止生长,血管生成是肝癌生长的基础,并且促进肿瘤细胞向身体的各个器官转移。血管内皮生长因子具有非常强的促进血管生长的作用,在诱导肿瘤血管生成、促进肿瘤生长、侵袭及转移中起着非常重要的作用[10]。通过查阅文献得知,VEGF高表达于肝癌组织中[11]。本文通过对肝癌患者临床资料的整理以及免疫组化研究了VEGF及CD163在该部分患者组织中的表达情况,得出以上结果并通过表格及免疫组化图片证明,由以上结果可以看出VEGF在肝癌生长、转移以及癌症复发中起至关重要的作用,并可以为肝癌的治疗以及预后提供重要的依据。VEGF在肝癌Ⅲ~Ⅳ期中的表达明显高于Ⅰ~Ⅱ期中的表达(P<0.05),由此得出VEGF在促进肝癌的生长中起重要作用,其机制可能与VEGF具有促进肿瘤血管生成增多有关。其表达水平的增高,可以作为预测肝癌临床预后的重要的生物学指标之一。
TAMs是肿瘤微环境中的主要组成部分,并通过多种途径在肿瘤发生、生长、侵袭、转移及免疫抑制等方面起着促肿瘤作用[12]。在以上研究中得出,VEGF表达强度与TAMs计数呈正相关关系(P<0.05)。由此得出,在肝癌中TAMs可能是通过促进VEGF表达进而促进肿瘤血管的形成。
综上所述,TAMs与VEGF在肝癌组织中的高度表达并与肝癌侵袭转移特性以及分期有密切关系,因此推断TAMs可能通过促进VEGF的表达进而促进肿瘤生长,并且可以以此判断肿瘤的恶性程度,为肝癌的临床治疗和预后提供新的线索。
[1]Jemal A,Bray F,Center MM,et al.Global canaer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Komohara Y,Ohnishi K,Kuratsu J,et al.Possible involvement of the M2 anti-inflammatory macrophage phenotype in growth of human gliomas[J].Pmhol,2008,216(1):15-24.
[3] Knowles H,Leek R,Harris AL.Macmphage infiltration and ansio-genesis in human malignancy[J].Novartis Found Symp,2004, 256:189-200.
[4]Lewis CE,Pollard JW.Distinct roleof macrophages in different tumor microenvironments[J].Cancer Res,2006,66(2):605-612.
[5]Leek RD,Lewis CE,Whitehouse R,et al.Association of macrophage infiltration with angiogenesis and prognosis in invasive breast carcinoma[J].Cancer Res,1996,56(20):4625-4629.
[6]Barar J.Targeting tumor microenvironment:the key role of immune system[J].Bioimpacts,2012,2(1):l-3.
[7]Hagemann T,Lawrence T.Investigating macrophage and malignant cell interactions in vitro[J].Methods Mol Bi01,2009,512:325-332.
[8]Groot Kormelink T,Abudukelimu A,Redegeld FA.Mast cells as target in cancer therapy[J].CurrPharm Des,2009,15(16):1868-1878.
[9]Van Overmeire E,Laoui D,Keirsse J,et al.Hypoxia and tumor-associated macrophages:a deadly alliance in support of tumor pro-gression[J].Oncoimmunology,2014,3(1):e27561.
[10]Wu IH,Yao DF,Shi GS,et al.Abnormal experession of vascular endothelial growth facter(VEGF)and its clinical feather in tissues of human lung cancer[J].Journal of Nanjing Medical University,2005, 19(4):194-198.
[11]Li N,Zheng D,Xue J,et al.Cidan inhibits liver cancer cell growth by reducing COX-2 and VEGF expression and cell cycle arrest[J]. Experimental and Therapeutic Medicine,2015,10(4):1609-1614.
[12]Imano M,Okuno K,Itoh T,et al.Increased osteopontin-positive macrophage expression in colorectal cancer stroma with synchronous liver metastasis[J].World Journal of Surgery,2010.34(8):1930-1936.
Expression of tumor-associated macrophage in the tissue of hepatocellular carcinoma and the correlation with vascular endothelial growth factor.
HU Peng,WANG Wei-xing,WANG Peng,DENG Wen-hong,YU Jia.Department of General Surgery,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo investigate the expression of tumor-associated macrophages in hepatocellular carcinoma and its correlation with vascular endothelial growth factor(VEGF).MethodsNinety-five samples of hepatocellular carcinoma tissue collected from the patients undergoing hepatectomy from January 2010 to January 2014 in our hospital were detected by double immunohistochemical staining.The expression of CD163(TAMs marker)and VEGF in hepatocellular carcinoma were detected by immunohistochemistry.Then TAMs count and the positive expression of VEGF were analyzed under light microscope,and their relationship with clinical pathological parameters were analzyed.ResultsThe average infiltration of TAMs was(38.39±22.13)in hepatocellular carcinoma of stageⅠ~Ⅱ, (48.95±25.32)in hepatocellular carcinoma of stageⅢ~Ⅳ(P<0.05),which was(37.41±22.48)in the patients without distant metastasis and(47.56±26.45)in the patients with distant metastasis(P<0.05).VEGF was moderately expressed in hepatocellular carcinoma,and the expression intensity was positively correlated with TAMs count(r= 0.782,P<0.05).ConclusionThe expression of TAMs in the hepatocellular carcinoma has close relationship with the invasion and metastasis of hepatocellular carcinoma as well as staging,and it is positively correlated with expression of VEGF.The expression of TAMs and VEGF can be used to predict the malignant degree of tumor,and as an adjuvant therapy of liver cancer and potential targets to improve the prognosis.
Hepatocellular carcinoma;Tumor-associated macrophages;Vascular endothelial growth factor (VEGF);Correlation
R735.7
A
1003—6350(2016)05—0689—03
10.3969/j.issn.1003-6350.2016.05.001
2015-11-12)
国家自然科学基金(编号:81370562);国家自然科学基金青年项目(编号:81300356);天晴肝病扶持基金(编号:TQGB20140182)
王卫星。E-mail:sate.llite@163.com

