VEGF、EGFR、PDGF在人脑胶质瘤中的表达及其与恶性程度和预后的关系
李连进,佟建洲,崔敬,吴红纪,王惠宾
(保定市第一中心医院神经外二科,河北 保定 071000)
VEGF、EGFR、PDGF在人脑胶质瘤中的表达及其与恶性程度和预后的关系
李连进,佟建洲,崔敬,吴红纪,王惠宾
(保定市第一中心医院神经外二科,河北 保定 071000)
目的 探讨血管内皮生长因子(VEGF)、表皮生长因子受体(EGFR)、血小板衍生生长因子(PDGF)在人脑胶质瘤中的表达及其与肿瘤恶性程度和患者预后的关系。方法选取我院神经外科2010年11月至2013年8月手术切除并经病理证实的脑胶质瘤标本68例及同期正常脑组织标本12例,采用SP免疫组化法检测所有标本中VEGF、EGFR、PDGF的表达,分析其与胶质瘤各临床特征的关系,采用Spearman等级相关分析方法分析VEGF、EGFR、PDGF三者间的关系。结果胶质瘤组织中VEGF、EGFR和PDGF的表达阳性率分别为63.24%(43/68)、51.47%(35/68)和52.94%(36/68),均明显高于正常脑组织的0(0/12)、8.33%(1/12)和33.33%(4/12),差异均有统计学意义(P<0.05);在生存率方面,VEGF阳性患者低于VEGF阴性患者(23.26%vs 60.00%),EGFR阳性患者低于EGFR阴性患者(28.57%vs 51.52%),PDGF阳性患者低于PDGF阴性患者(27.78%vs 62.50%),差异均有统计学意义(P<0.05);Spearman等级相关分析显示,VEGF、EGFR及PDGF的表达与胶质瘤WHO分级呈显著正相关(rVEGF=0.428,rEGFR=0.407,rPDGF=0.431,P<0.05)。结论VEGF、EGFR、PDGF在人脑胶质瘤发生发展中起重要调节作用,可作为判断胶质瘤恶性程度和预后的重要生物学参考指标。
胶质瘤;血管内皮生长因子;表皮生长因子受体;血小板衍生生长因子;预后;相关性
胶质瘤是一种高度血管化的中枢神经系统原发性恶性肿瘤,其发生和发展与微血管形成密切相关。病理情况下肿瘤细胞释放出多种成血管因子诱导微血管形成,肿瘤组织经微血管从宿主获取养分,同时经微血管转送肿瘤细胞至宿主身体的其他部位,继续生长和诱导新的微血管形成,实现远处转移[1]。血管内皮生长因子(VEGF)、表皮生长因子受体(EGFR)、血小板衍生生长因子(PDGF)均在肿瘤血管生成中发挥着重要作用,其中VEGF是肿瘤细胞诱导微血管形成过程中的一个最重要的调节因子,参与了血管形成的全过程;EGFR是一种具有酪氨酸蛋白激酶活性的细胞膜受体,其与配体生长因子结合后自身磷酸化激活,进而通过多条信号转导功能,促进内皮细胞分裂增殖[2],最终促进血管生成;而PDGF是一种旁分泌生长因子,可通过自分泌及旁分泌作用刺激间质增生和微血管生成,与肿瘤生长、侵袭和转移密切相关。本研究通过检测人脑胶质瘤组织中VEGF、EGFR、PDGF的表达并与正常脑组织进行比较,分析其与肿瘤恶性程度和预后的关系,以期为胶质瘤抗血管生成治疗及生物免疫治疗提供理论基础。
1 资料与方法
1.1 一般资料 选取我院神经外科2010年11月至2013年8月手术切除并经病理证实的脑胶质瘤标本68例,患者术前均未进行放疗、化疗及生物免疫治疗等辅助治疗。其中男性39例,女性29例,年龄22~76岁,平均(42.76±6.49)岁。所有标本经常规组织病理学检查,其中确诊为星形细胞瘤36例,胶质母细胞瘤24例,少突星形和毛细胞形细胞瘤各4例。按照2007年WHO中枢神经系统胶质瘤分类标准[3]分级:Ⅰ级4例、Ⅱ级28例、Ⅲ级25例、Ⅳ级11例。12例正常人脑组织来源于脑外伤行去骨瓣减压手术患者,设为正常对照。
1.2 方法
1.2.1 仪器及试剂 (1)仪器:全自动封闭型组织脱水机、石蜡切片机(德国SLEE),倒置光显微镜、显微镜成像系统(日本OLYMPUS),烤箱及孵箱(上海实验仪器厂有限公司);(2)试剂:鼠抗人VEGF单克隆抗体(1:300)、鼠抗人EGFR单克隆抗体(1:200)、鼠抗人PDGF单克隆抗体(1:300)及通用型SP广谱试剂盒、DAB显色剂(ZLI-9031)、磷酸盐缓冲液(PBS),均购自上海亿新生物科技有限公司,均购自上海亿欣生物科技有限公司。
1.2.2 SP免疫组化染色法 将所有组织标本采用10%中性甲醛固定,常规石蜡包埋,行4 μm连续切片。石蜡切片脱蜡至水,加入3%H2O2,37℃孵育10 min,PBS冲洗3次,5 min/次。微波抗原热修复,加入50 μL牛血清白蛋白封闭液(BSA)封闭,置于37℃孵育,倾去勿洗。10 min滴加VEGF、EGFR、PDGF一抗(1:50稀释),4℃冰箱孵育过夜,PBS冲洗3次,5 min/次。滴加生物素标记的二抗,37℃孵育40 min,PBS冲洗3次,5 min/次;加入辣根过氧化物酶标记的链霉素卵白素工作液,37℃孵育30 min,PBS冲洗3次,5 min/次;DAB显色3~5 min,自来水充分冲洗;苏木素复染,常规脱水,透明,干燥,封片,显微镜下观察。操作均严格按照试剂盒说明书步骤进行。以PBS代替一抗作为阴性对照,以已知阳性切片作为阳性对照。
1.2.3 结果判定 VEGF表达于细胞质,呈棕黄色颗粒;EGFR表达于细胞膜和细胞质,呈棕黄色颗粒;PDGF表达于细胞质,呈棕黄色或棕褐色颗粒。高倍视野下(×400)随机选取10个视野,每个视野计数100个肿瘤细胞,计算阳性细胞百分率。计分标准:阳性细胞百分率<10%为0分;10%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。染色强度评分标准:无色为0分;淡黄色为1分;棕黄色为2分;棕色或棕褐色为3分。以计分和染色强度评分乘积>4分定义为阳性。
1.3 统计学方法 所有数据经核对证实后均经SPSS17.0统计学软件进行数据处理,计量资料以均数±标准差(±s)表示,两组间计数资料比较采用χ2检验,采用Spearman等级相关分析方法分析VEGF、EGFR及PDGF的表达与胶质瘤恶性程度的关系,以P<0.05为差异有统计学意义。
2 结 果
2.1 人脑胶质瘤和正常脑组织中VEGF、EGFR及PDGF的表达差异 VEGF在正常脑组织中不表达,EGFR及PDGF在正常脑组织中低表达,VEGF、EGFR及PDGF均在人脑胶质瘤组织中高表达。人脑胶质瘤和正常脑组织中VEGF、EGFR及PDGF的表达阳性差异具有统计学意义(P<0.05),见表1。

表1 人脑胶质瘤和正常脑组织中VEGF、EGFR及PDGF的表达阳性率的比较[例(%)]
2.2 VEGF、EGFR及PDGF的表达与人脑胶质瘤WHO分级的相关性 VEGF、EGFR及PDGF在不同级别胶质瘤组织中的表达阳性见表2和图1。结果显示,VEGF、EGFR及PDGF的表达阳性率随肿瘤分级的升高呈上升趋势,以在Ⅳ级胶质瘤组织中表达阳性率最高,其次为Ⅲ级,再次为Ⅱ级,最低为Ⅰ级,差异具有统计学意义(χ2VEGF=8.104,χ2EGFR=7.948,χ2PDGF= 6.774,P<0.05)。Spearman等级相关分析显示,VEGF、EGFR及PDGF的表达与胶质瘤WHO分级呈显著正相关(rVEGF=0.428,rEGFR=0.407,rPDGF=0.431,P<0.05)。
2.3 VEGF、EGFR及PDGF表达与患者生存的关系 VEGF、EGFR及PDGF表达阳性及阴性的生存曲线分析见图2。VEGF(23.26%)、EGFR(28.57%)及PDGF(27.78%)表达阳性患者累积生存率明显低于表达阴性患者(60.00%、51.52%、62.50%),差异均具有统计学意义(P<0.05)。
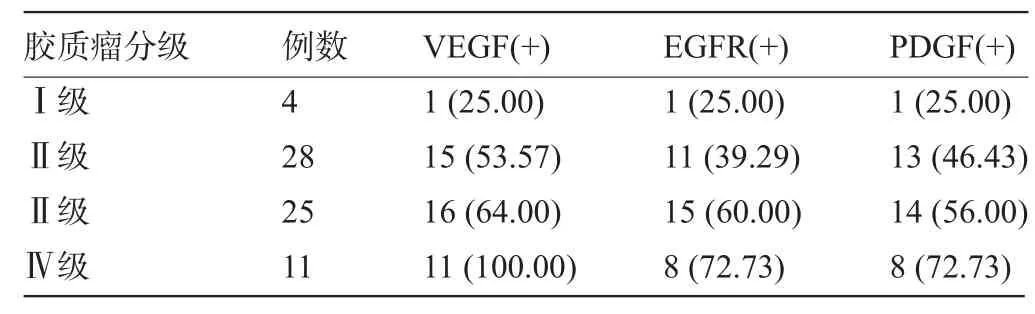
表2 VEGF、EGFR及PDGF在不同级别胶质瘤组织中的表达[例(%)]
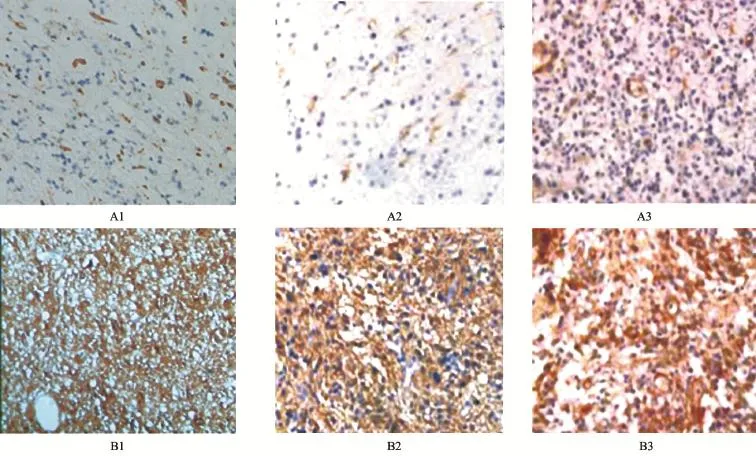
图1 VEGF、EGFR及PDGF在WHOⅡ级和Ⅳ级人脑胶质瘤中的表达
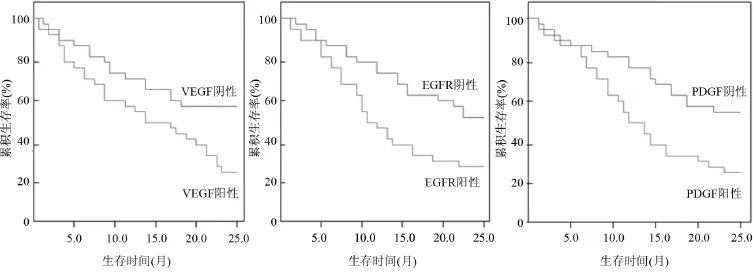
图2 VEGF、EGFR及PDGF表达阳性及阴性的生存曲线
3 讨 论
微血管生成在实体瘤生长和发展中起重要作用,若实体瘤内无微血管形成,肿瘤仅可以通过扩散缓慢生长,一旦形成微血管,肿瘤即呈指数型快速生长并进一步向周围浸润和进入血循环向远处转移,因此实体瘤的生长和发展具有血管依赖性[4]。而脑胶质瘤是一种高度血管化的中枢神经系统原发性恶性肿瘤,微血管生成是其生长和侵袭过程中的重要阶段。无控性增殖、侵袭性生长等特性导致脑胶质瘤临床治愈率低,预后差,是神经外科治疗中最棘手的难治性肿瘤之一[5]。近年来,随着分子靶向治疗研究的不断深入,针对脑胶质瘤微血管生成因子或受体的分子靶向治疗已成为研究的热点之一[6]。
VEGF、EGFR、PDGF均在肿瘤微血管生成中发挥重要作用,项高波等[7]研究显示,胶质瘤组织中VEGF的表达与肿瘤微血管密度呈明显正相关,其表达高水平可反映肿瘤微血管生成呈高度活跃。Wang等[8]研究报道,恶性胶质瘤中常出现EGFR扩增和过度表达,通过促进内皮细胞增殖,加快微血管生成,进而促进肿瘤进展。刘爱军等[9]研究报道,PDGF可与VEGF相互作用,通过自分泌及旁分泌作用刺激间质增生和微血管生成,从而有利于肿瘤生长、侵袭和转移。此外,已有多项研究证实,通过阻断VEGF、EGFR、PDGF信号转导可抑制肿瘤微血管形成,进而达到抑制肿瘤生长的目的[10-11]。因此,检测脑胶质瘤组织中VEGF、EGFR、PDGF是否为异常表达对评估VEGF、EGFR、PDGF作为脑胶质瘤分子靶向治疗的靶点的可行性具有较重要的临床意义。本研究采用免疫组织化学染色法检测68例脑胶质瘤组织和12例正常脑组织标本中VEGF、EGFR、PDGF的表达情况,并分析其与脑胶质瘤恶性程度和预后的关系。结果显示,人脑胶质瘤组织中VEGF、EGFR、PDGF表达阳性率均明显高于正常脑组织,且三者在不同分级的胶质瘤中的表达具有较大差异,随着胶质瘤分级增高,三者在胶质瘤组织中的表达阳性率上升,相关性分析显示VEGF、EGFR、PDGF的表达与胶质瘤WHO分级呈明显的相关性,且VEGF、EGFR、PDGF表达阳性的患者的生存率明显低于表达阴性者。表明VEGF、EGFR、PDGF在胶质瘤发生和发展中具有重要作用,且与胶质瘤恶性程度呈明显正相关,与胶质瘤恶性程度越高、浸润越明显、预后越差的临床属性相符合,可作为判断胶质瘤恶性程度和预后的重要生物学参考指标。此外,VEGF、EGFR、PDGF在脑胶质瘤组织中高表达,而在正常脑组织中低表达或无阳性表达,提示VEGF、EGFR、PDGF可作为脑胶质瘤分子靶向治疗的靶点。
综上所述,EGF、EGFR、PDGF在人脑胶质瘤发生发展中起重要调节作用,三者共同参与促进微血管形成的作用。VEGF、EGFR、PDGF的表达可作为判断胶质瘤恶性程度和预后的重要生物学参考指标,针对VEGF、EGFR、PDGF为靶点的脑胶质瘤信号转导干预治疗有待进一步的研究,有望通过抗胶质瘤微血管生成达到抑制肿瘤生长的目的。
[1]Jhaveri N,Chen TC,Hofman FM.Tumor vasculature and glioma stem cells:Contributions to glioma progression[J].Cancer Lett, 2014,16(14):783-786.
[2]唐天友,许莹莹,王建设,等.人脑胶质瘤组织MGMT和EGFR及Ki-67表达临床意义分析[J].中华肿瘤防治杂志,2013,20(11): 840-844.
[3]Rychlý B,Sidlová H,Daniś D.The 2007 World Health Organisation classification of tumours of the central nervous system,comparison with 2000 classification[J].Cesk Patol,2008,44(2):35-36.
[4] Sun H,Guo D,Su Y,et al.Hyperplasia of pericytes is one of the main characteristics of microvascular architecture in malignant glioma[J].PLoS One,2014,9(12):e114246.
[5]杨群英,沈冬,赛克,等.初诊恶性脑胶质瘤患者综合治疗的生存情况分析[J].中华医学杂志,2013,93(1):8-10.
[6]Khasraw M,Ameratunga MS,Grant R,et al.Antiangiogenic therapy for high-grade glioma[J].Cochrane Database Syst Rev,2014,9: CD008218.
[7]项高波,邓勇,鲍风,等.IL-24与VEGF在脑胶质瘤中的表达以及与肿瘤微血管密度的关系[J].安徽医科大学学报,2013,48(7): 810-813.
[8]Wang S,Zhao Y,Ruan Z,et al.Association between EGF+61 G/A and glioma risk in a Chinese population[J].BMC Cancer,2010,10: 221.
[9]刘爱军,王树伟,徐翔,等.血小板源性生长因子(PDGF)、血清反应因子(SRF)和波形蛋白在人脑胶质瘤中表达的临床意义[J].复旦学报:医学版,2014,41(1):111-114.
[10]李焘,王雄伟.EGFR及其下游通路在胶质瘤治疗中的研究进展[J].癌症防治研究,2011,38(10):1204-1206.
[11]Gressot LV,Doucette TA,Yuhui Y,et al.Signal transducer and activator of transcription 5b drives malignant progression in a PDGFB-dependent proneural glioma model by suppressing apoptosis[J].International Journal of Cancer,2015,136(9):2047-2054.
Expression and its relationship with the degree of malignancy and prognosis of VEGF,EGFR and PDGF in human brain gliomas.
LI Lian-jin,TONG Jian-zhou,CUI Jing,WU Hong-ji,WANG Hui-bin.Department of Neurosurgery,Baoding First Central Hospital,Baoding 071000,Hebei,CHINA
ObjectiveTo investigate the expression and its relationship with the degree of malignancy and prognosis of vascular endothelial growth factor(VEGF),epidermal growth factor receptor(EGFR),platelet derived growth factor(PDGF)in human gliomas.MethodsSixty-eight samples of brain glioma confirmed by pathology and 12 samples of normal brain tissue in Department of Neurosurgery in our hospital from November 2010 to August 2008 were selected.The SP immunohistochemical method was used to detect the expression of VEGF,EGFR and PDGF in all specimens,and analyzed the relationship between the expression of VEGF,EGFR,PDGF and the malignancy of glioma. The relationship between VEGF,EGFR and PDGF was analyzed by Spearman rank correlation analysis.ResultsThe expression positive rates of VEGF,EGFR and PDGF in glioma tissue were significantly higher than those in normal brain tissues[63.23%(43/68)vs 0(0/12),51.47%(35/68)vs 8.33%(1/12),52.94%(36/68)vs 33.33%(4/12),P<0.05].In terms of survival,the VEGF positive rates were significantly lower than VEGF negative(23.26%vs 60.00%),and EGFR positive rates were significantly lower than the EGFR negative(28.57%vs 51.52%),PDGF positive rates were significantly lower than PDGF negative(27.78%vs 62.50%,P<0.05).Spearman rank correlation analysis showed that the expression of VEGF,EGFR and WHO was significantly positively correlated with the WHO grading of gliomas(rVEGF=0.428,rEGFR=0.407,rPDGF=0.431,P<0.05).ConclusionVEGF,EGFR,PDGF play an important role in the occurrence and development of human glioma.It can be used as an important biological reference index to judge the degree of malignancy and prognosis of gliomas.
Glioma;Vascular endothelial growth factor(VEGF);Epidermal growth factor receptor(EGFR); Platelet derived growth factor(PDGF);Prognosis;Relationship
R687.4
A
1003—6350(2016)14—2251—04
10.3969/j.issn.1003-6350.2016.14.006
2016-01-27)
李连进。E-mail:6653879@qq.com

