淡水和半咸水条件下中华鲟幼鱼鳃上皮泌氯细胞的形态特征与数量分布
赵 峰,杨 刚,张 涛,王 妤,庄 平
(中国水产科学研究院东海水产研究所,长江口渔业生态重点实验室上海 200090)
淡水和半咸水条件下中华鲟幼鱼鳃上皮泌氯细胞的形态特征与数量分布
赵 峰,杨 刚,张 涛,王 妤,庄 平
(中国水产科学研究院东海水产研究所,长江口渔业生态重点实验室上海 200090)
为了探讨中华鲟幼鱼进入长江口半咸水环境后,渗透压适应调节过程中鳃上皮泌氯细胞的适应性变化,将幼鱼在淡水(盐度0)和半咸水(盐度15)两种条件下驯养60 d,利用光镜和扫描电镜技术对比分析鳃上皮泌氯细胞的形态、分布与数量特征。结果表明:幼鱼鳃上皮泌氯细胞主要集中分布于鳃小片基部和鳃小片之间的鳃丝上,细胞略呈椭圆形。半咸水条件下,幼鱼鳃丝上皮泌氯细胞数量和大小显著增加,鳃小片上皮泌氯细胞数量则未发生改变,但细胞大小显著增加;而鳃丝和鳃小片上皮泌氯细胞的形态在淡水和半咸水中均未发生显著变化。扫描电镜观察发现,鳃丝上皮泌氯细胞顶膜开口的形态分为3种类型:Ⅰ型,突起型;Ⅱ型,凹陷型;Ⅲ型,深洞型。淡水条件下,顶膜开口形态多为Ⅰ型和Ⅱ型,未发现Ⅲ型存在;而半咸水条件下,顶膜开口形态以Ⅲ型为主,Ⅰ型与Ⅱ型也有少量分布。
中华鲟;泌氯细胞;形态特征;数量分布;顶膜开口;形状因子;渗透调节
鳃是鱼类进行渗透压调节的主要器官,鳃上皮泌氯细胞在离子转运和维持体内渗透平衡方面发挥着重要作用[1]。泌氯细胞主要位于鳃丝上皮内,少量分布在鳃小片上[1]。广盐性硬骨鱼类由低渗的淡水转入高渗的海水过程中,鳃上皮泌氯细胞的形态、分布、数量及内部结构均发生明显的适应性改变,以排出过量的Cl-离子,从而维持体内渗透平衡,适应高渗环境[1-2]。有研究表明,纳氏鲟(Acipenser naccarii)[3-6]、墨西哥湾鲟(A.oxyrinchus dsotoi)[7]、中吻鲟(A.medirostris)[8]、施氏鲟(A.schrenckii)[9-10]、欧鳇(Huso huso)[11]等鲟类在盐度刺激下,鳃上皮泌氯细胞形态结构及数量也会发生改变,但不同种间存在着一定差异。
中华鲟(A.sinensis)生活史中数次历经淡水和海水生活环境,是典型的江海洄游性鱼类。每年10~11月性成熟的中华鲟由东海经长江口溯河洄游至长江中上游繁殖产卵,孵出的仔、稚鱼顺流而下,第二年5月末至6月初,中华鲟幼鱼到达长江口水域进行摄食肥育和入海洄游前的生理适应与调节[12],尤其是渗透压的调节与适应。HE等[13]、赵峰等[14-16]、封苏娅等[17]研究发现,中华鲟幼鱼与其它广盐性硬骨鱼类一样具有类似的渗透压及离子调节规律,但对鳃上皮泌氯细胞的相关研究仅见吴贝贝等[18]进行过免疫定位的研究报道。本研究利用光镜和电镜技术,比较分析了中华鲟幼鱼在淡水和半咸水条件下鳃上皮泌氯细胞的形态、分布与数量特征,旨在为深入开展中华鲟渗透压调节机制研究提供基础素材,丰富鱼类生理学资料。
1 材料与方法
1.1 实验鱼及驯养
实验用中华鲟幼鱼于2013年7月取自长江口淡水水域(23 mOsm·kg-1),平均体长(38.41 ±1.31)cm,平均体质量(190.73±18.55)g。实验前将中华鲟幼鱼在直径2 m的圆形玻璃钢养殖桶内暂养,暂养2周后,挑选规格整齐的幼鱼各6 ind分别置于淡水和半咸水(盐度15,440 mOsm·kg-1;除氯自来水与浓缩海水配制而成)中驯化养殖60 d。
实验及暂养期间,每2 d换水一次,每次换水30%,保持水体溶解氧不低于6 mg·L-1,水温(24±1)℃,pH 7.5~7.7,自然光照。每天按体质量的1.5%分早晚2次进行饲料投喂,并根据实验鱼摄食情况进行调整,以投喂后15~20 min吃完为宜。实验过程中,淡水和半咸水(盐度15)组均未发生死亡。
1.2 样品制备
从淡水和半咸水组中分别选取3 ind中华鲟幼鱼,用足量MS-222(Argent,Redmond,WA,USA)麻醉后,立即剪取右侧第二鳃弓上鳃丝6~8枚,分别用Bouin氏液和2.5%戊二醛固定,置于4℃冰箱保存。
光镜样品制备:将Bouin氏液固定的样品进行酒精梯度脱水,经水杨酸甲酯透明后将单个鳃丝石蜡包埋,切片,切片厚度为5μm,H.E染色,用Olympus CX41显微镜观察拍照。
扫描电镜样品制备:将2.5%戊二醛固定的样品进行如下处理:PBS(0.1 mol·L-1,pH 7.4)冲洗3次,每次15 min;用2%锇酸PBS(pH 7.4)固定1.5 h;PBS(0.1 mol·L-1,pH 7.4)冲洗2次,每次5 min;不同浓度酒精(30%—50%—70%—80%—90%—95%—100%Ⅰ—100%Ⅱ)逐级脱水,每次10 min;醋酸异戊酯转换,常规临界点干燥,真空离子镀膜;采用Hitachi S-4800扫描电子显微镜观察、拍照。
1.3 数据分析
用IPP 6.0软件(Media Cybernetics,USA)分别统计分析淡水组和半咸水组中华鲟幼鱼鳃丝(包含鳃小片基部)和鳃小片上的泌氯细胞数量、面积和形状因子,每尾鱼随机取10个鳃丝,共计30个鳃丝(n=30)。泌氯细胞计数为每100μm鳃丝或鳃小片上的泌氯细胞个数,细胞形状因子由4πA/P2求得(A为细胞面积,P为细胞周长),细胞形状因子接近1表明细胞呈圆形,若小于1则表明细胞呈椭圆形[18]。
实验数据以平均值±标准差(means±SD)表示,利用STATISTICA 6.0统计软件中的独立样本t检验(student’st-test)比较淡水与半咸水组之间差异的显著性,P<0.05为差异显著。
2 结果与分析
2.1 泌氯细胞形态、分布与数量
中华鲟幼鱼鳃丝显微结构见图1。鳃小片呈扁平囊状,垂直分布于鳃丝两侧。鳃丝和鳃小片均被特化的多层或单层上皮层所覆盖,上皮层由扁平细胞、泌氯细胞等不同类型细胞组成。泌氯细胞相对较大,为嗜酸性细胞,具有圆形细胞核(图1-a,b)。
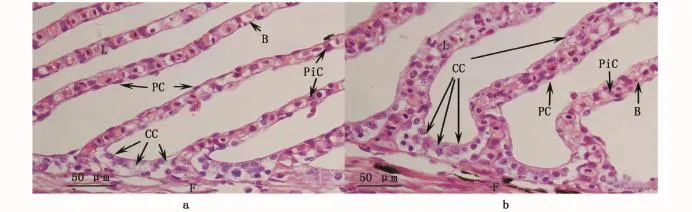
图1 淡水(a)和半咸水(b)驯养中华鲟幼鱼的鳃丝显微图片Fig.1 Lightmicrograph of gills in juvenile Acipenser sinensis adapted to freshwater(a)and brackish water(b)
淡水条件下,鳃上皮泌氯细胞集中分布于鳃小片基部及鳃小片之间的鳃丝上,显著高于鳃小片泌氯细胞数量(P<0.05;图1,表1),但鳃丝与鳃小片上泌氯细胞的平均表面积没有显著性差异(P>0.05;表1)。从表1可以看出,泌氯细胞形状因子小于1,说明泌氯细胞略呈椭圆形,鳃丝和鳃小片上泌氯细胞形态不存在显著性差异(P>0.05),而且大小也基本一致(P>0.05)。
半咸水驯养60 d后,鳃小片基部及鳃小片之间鳃丝上泌氯细胞数量显著增加(P<0.05;表1),但鳃小片上泌氯细胞数量未呈现显著差异(P>0.05)。与淡水组相比,无论是鳃丝还是鳃小片泌氯细胞的平均表面积也显著增加(P<0.05),而细胞形态未呈现显著性差异(P>0.05)。
2.2 泌氯细胞顶膜开口形态
泌氯细胞顶膜开口位于扁平细胞边缘(图2),通过顶膜开口泌氯细胞与胞外环境相连。泌氯细胞顶膜开口位于鳃丝上皮血管输入端平坦区域和边缘,极少出现在上皮层血管输出端。
按照泌氯细胞顶膜开口的形态和大小,可以将中华鲟幼鱼鳃上皮泌氯细胞顶膜开口大致分为3种类型:Ⅰ型,突起型,呈椭圆形,直径一般在2~3μm,表面具有大量突起的微绒毛(图2-i);Ⅱ型,凹陷型,略呈三角形,直径一般在2 μm以内,表面粗糙具有许多颗粒呈凹陷状(图2-ii);Ⅲ型,深洞型,狭长而深陷,直径1μm左右,表面具有许多细小颗粒(图2-iii)。
比较分析发现,淡水组中华鲟幼鱼鳃上皮泌氯细胞顶膜开口类型主要为Ⅰ型和Ⅱ型,Ⅰ型占绝大部分,少量Ⅱ型出现,未发现泌氯细胞顶膜Ⅲ型开口(图2-a)。而半咸水组中华鲟幼鱼鳃上皮泌氯细胞顶膜开口以Ⅲ型为主,也有少量Ⅰ型和Ⅱ型出现(图2-b)。
3 讨论
鳃上皮泌氯细胞是进行离子调节的主要场所,在鱼类渗透压调节方面发挥着重要功能[1-2,18]。泌氯细胞的形态结构、分布和数量会随着生活环境渗透压条件的改变而发生适应性变化,但不同种类间存在着一定差异[2]。一般来讲,广盐性硬骨鱼类在适应高渗或低渗环境时,鳃上皮泌氯细胞的分布呈现3种类型:(1)无论淡水或海水驯化时,泌氯细胞仅分布在鳃丝上皮内;(2)海水高渗环境时,泌氯细胞分布在鳃丝上皮内,但经淡水低渗环境驯化,泌氯细胞在鳃小片上皮内也会有分布;(3)无论淡水或海水驯化,鳃丝和鳃小片上皮内均有泌氯细胞分布[2]。本研究发现,无论是在淡水还是半咸水驯化后,中华鲟幼鱼鳃上皮泌氯细胞主要分布在鳃丝上,也有少量分布在鳃小片上。可见,中华鲟幼鱼鳃上皮泌氯细胞的分布属于第3种类型,与在纳氏鲟[3-6]、墨西哥湾鲟[7]、中吻鲟[8]、施氏鲟[9-10]和欧鳇[11]等鲟类的研究结果一致。FOSKETT等[19]研究发现,鳃丝上泌氯细胞较大,主要起离子外排作用,而鳃小片上泌氯细胞较小,主要起离子吸收作用。本研究中,发现中华鲟幼鱼鳃丝上皮泌氯细胞要大于鳃小片上的泌氯细胞,这与洄游性大麻哈鱼(Oncorhynchus keta)[20]和马苏大麻哈鱼(O.masou)[21]及美洲鲥(Alosa sapidissima)[22]的研究结果类似。
胞内大量的Na+,K+-ATPase是泌氯细胞进行离子转运的重要能量来源,通常广盐性鱼类鳃上皮泌氯细胞数量和体积会随着盐度增高而增加,为适应高渗环境提供更多动力[1-2,23]。半咸水条件下,中华鲟幼鱼鳃丝上皮泌氯细胞明显增多且体积增大,这与ALTINOK等[7]在墨西哥湾鲟、CARMONA等[3]在纳氏鲟和ZHAO等[9]在施氏鲟中观察到的结果一致;中华鲟幼鱼鳃小片上泌氯细胞个体尽管有所增大但数量未发生改变,而CATALDI等[4]和MCKENZIE等[5]却发现纳氏鲟进入高渗环境时鳃小片泌氯细胞呈现下降趋势。通常广盐性鱼类进入高渗环境时,鳃小片上泌氯细胞会消失,可能是因为高渗条件下不需要主动吸收离子所致[24]。这种中华鲟幼鱼与其它鲟类研究中鳃小片泌氯细胞变化的差异,可能与鲟的种类和规格大小有关,也可能与驯化盐度及时间等有关。自然条件下,由于长江口受到径流和潮汐的作用,中华鲟幼鱼栖息水域盐度变化较大(在0~15之间)[12],鳃上皮泌氯细胞的这种变化可能是中华鲟幼鱼对长江口波动盐度环境的适应性表现,也可能存在着独特的调节机制,需要进一步对中华鲟幼鱼在长江口栖息水域的渗透调节生理进行持续深入研究。

表1 中华鲟幼鱼鳃上皮泌氯细胞的数量、面积及形状因子Tab.1 Number,area and shape factor of branchial chloride cells of juvenile Acipenser sinensis

图2 中华鲟幼鱼鳃上皮泌氯细胞的顶膜开口形态(a.淡水组;b.半咸水组;i、ii、iii:分别为I型、II型、III型3种顶膜开口类型的放大图)Fig.2 Apical opening morphology of brachial chloride cells in juvenile Acipenser sinensis(a.freshwater group;b.brackish water group;i,ii,iii:magnification of three types of chloride cell apical opening)
胞外环境通过泌氯细胞顶膜开口被感知,从而刺激泌氯细胞结构改变、调整离子转运功能以适应外部环境变化;进而,顶膜开口形态也可以反映泌氯细胞形态功能的改变[2]。1996年,LEE等[25]率先开展了不同盐度下莫桑比克罗非鱼(Oreochromismossambicus)鳃上皮泌氯细胞顶膜形态与功能相关研究,将泌氯细胞顶膜开口划分为3种类型,即突起型(Ⅰ型)、凹陷型(Ⅱ型)和深洞型(Ⅲ型)。这一结果CHOI等[26]在后续研究中也予以了证实,然而FRIDMAN等[27]发现在尼罗罗非鱼(O.niloticus)中除上述3种类型外,还具有第4种类型,可能为Ⅲ型的过渡类型。本研究发现,中华鲟幼鱼鳃上皮泌氯细胞顶膜开口也呈现上述3种类型,其中淡水中存在Ⅰ型和Ⅱ型;半咸水中以Ⅲ型为主,Ⅰ型和Ⅱ型也有分布;与上述研究基本一致。研究证实,具有Ⅰ型和Ⅲ型顶膜开口的泌氯细胞分别在Cl-的吸收和外排中发挥重要作用[28-30],而具有Ⅱ型顶膜开口的泌氯细胞主要功能是吸收Ca2+[31]。从本研究来看,高渗条件下中华鲟幼鱼鳃上皮Ⅲ型顶膜开口的泌氯细胞代替了低渗条件下的I型顶膜开口的泌氯细胞,泌氯细胞形态结构发生了改变,其功能也从Cl-的吸收转变为外排,进行离子和渗透压调节,从而适应高渗环境。中华鲟幼鱼鳃上皮泌氯细胞的超微结构变化还需要进一步研究,以证实其是否存在着不同类型,或盐度刺激下其结构发生怎样的改变。
综上,鳃丝上皮泌氯细胞数量增多、体积增大和泌氯细胞顶膜开口形态发生改变是中华鲟幼鱼进行渗透压调节、维持渗透平衡的结构基础,是其适应长江口半咸水环境及入海洄游而作出的适应性调整,这些结果可为深入研究中华鲟渗透压调节机制奠定基础,丰富鲟类基础生物学资料。
[1] EVANSD H,PIERMARINIPM,CHOE K P.The multifunctional fish gill:dominant site of gas exchange,osmoregulation,acid-base regulation,and excretion of nitrogenous waste[J].Physiological Review,2005,85(1):97-177.
[2] HWANG P P,LEE T H.New insights into fish ion regulation and mitochondrion cells[J].Comparative Biochemistry and Physiology,2007,148A(3):479-497.
[3] CARMONA R,GARCIA-GALLEGO M,SANZ A,et al.Chloride cells and pavement cells in gill epithelia ofAcipenser naccarii:ultrastructure modifications in seawater-acclimated specimens[J].Journal of Fish Biology,2004,64(2):553-566.
[4] CATALDIE,CICCOTTIE,DIMARCO P,et al. Acclimation trials of juvenile Italian sturgeon to different salinities:morpho-physiological descriptors[J].Journal of Fish Biology,1995,47(4):609-618.
[5] MCKENZIE D J,CATALDI E,DIMARCO P,etal.Some aspects of osmotic and ionic regulation in Adriatic sturgeonAcipenser naccariiⅡ:morphophysiological adjustments to hyperosmotic environments[J].Journal of Applied Ichthyology,1999,15(2):61-66.
[6] MARTINEZ-ALVAREZ R M,SANZ A,GARCIAGALLEGOM,etal.Adaptive branchialmechanisms in the sturgeonAcipenser naccariiduring acclimation to saltwater[J].Comparative Biochemistry and Physiology,2005,141A(2):183-190.
[7] ALTINOK I,GALLI SM,CHAPMAN F A.Ionic and osmotic regulation capabilities of juvenile Gulf of Mexico sturgeon,Acipenser oxyrinchus desotoi[J].Comparative Biochemistry and Physiology,1998,120A(4):609-616.
[8] ALLEN P J,CECH J J,KULTZ D.Mechanisms of seawater acclimation in a primitive,anadromous fish,the green sturgeon[J].Journalof Comparative Physiology,2009,179B(7):903-920.
[9] ZHAO F,ZHUANG P,ZHANG L Z,et al.Changes in growth and osmoregulation during acclimation to saltwater in juvenile Amur sturgeonAcipenser schrenckii[J].Chinese Journal of Oceanology and Limnology,2010,28(3):603-608.
[10] 侯俊利,陈立侨,庄 平,等.不同盐度驯化下施氏鲟幼鱼鳃泌氯细胞结构的变化[J].水产学报,2006,30(3):316-322.
HOU J L,CHEN L Q,ZHUANG P,et al.Structural changes of chloride cells in gills epithelia of juvenileAcipenser schrenckiiacclimated to various salinities[J].Journal of Fisheries of China,2006,30(3):316-322.
[11] KRAYUSHKINA LS,KISELEVASG,MOISEYENKOS N.Functional changes in the thyroid gland and the chloride cells of the gills during adaptation of the young Beluga sturgeon Huso huso to a hypertonic environment[J].Journal of Ichthyology,1976,16(5):834-841.
[12] 庄 平,刘 健,王云龙,等.长江口中华鲟自然保护区科学考察与综合管理[M].北京:海洋出版社,2009:239-240.
ZHUANG P,LIU J,WANG Y L,et al.The Yangtze Estuary nature reserve for Chinese sturgeon:scientific studies and management[M].Beijing:China Ocean Press,2009:239-240.
[13] HE X G,ZHUANG P,ZHANG L Z,et al.Osmoregulation in juvenile Chinese sturgeon(Acipenser sinensisGray)during brackish water adaptation[J].Fish Physiology and Biochemistry,2009,35(2):223-230.
[14] ZHAO F,QU L,ZHUANG P,et al.Salinity tolerance as well as osmotic and ionic regulation in juvenile Chinese sturgeon(Acipenser sinensisGray)exposed to different salinities[J].Journal of Applied Ichthyology,2011,27(2):231-234.
[15] 赵 峰,张 涛,侯俊利,等.长江口中华鲟幼鱼血液水分、渗透压及离子浓度的变化规律[J].水产学报,2013,37(12):1795-1800.
ZHAO F,ZHANG T,HOU J L,et al.Changes in blood moisture,osmolality and ion concentration of juvenile Chinese sturgeon(Acipenser sinensis)in the Yangtze Estuary[J].Journal of Fisheries of China,2013,37(12):1795-1800.
[16] ZHAO F,ZHUANG P,ZHANG T,et al.Isosmotic points and their ecological significance for juvenile Chinese sturgeonAcipenser sinensis[J].Journal of Fish Biology,2015,86(4):1416-1420.
[17] 封苏娅,赵 峰,庄 平,等.中华鲟幼鱼鳃丝Na+-K+-ATPaseα亚基渗透调节的分子机制初步研究[J].水产学报,2012,36(9):1386-1391.
FENG S Y,ZHAO F,ZHUANG P,et al.Preliminary studies on molecular mechanism of salinity regulation of Na+,K+-ATPaseα-subunit in gills of juvenile Chinese sturgeon(Acipenser sinensis)[J].Journal of Fisheries of China,2012,36(9):1386-1391.
[18] 吴贝贝,赵 峰,张 涛,等,中华鲟幼鱼鳃上氯细胞的免疫定位研究[J].上海海洋大学学报,2015,24(1):20-27.
WU B B,ZHAO F,ZHANG T,et al.Immunolocalization of chloride cell on the gills of juvenileAcipenser sinensis[J].Journal of Shanghai Ocean University,2015,24(1):20-27
[19] FOSKETT JK,LOGSDON C D,TURNER T,et al.Differentiation of the chloride extrusion mechanism during seawater adaptation of a teleost fish,the cichlid Sarotherodon mossambicus[J].The Journal of Experimental Biology,1981,93(1):209-224.
[20] UCHIDA K,KANEKO T,YAMAUCHI K,et al.Morphometrical analysis of chloride cell activity in the gill filaments and lamellae and changes in Na+,K+-ATPase activity during seawater adaptation in chum salmon fry[J].Journal of Experimental Zoology,1996,276(3):193-200.
[21] MIZUNO S,URA K,OKUBO T,et al.Ultrastructural changes in gill chloride cells during smoltification in wild and hatchery-reared masu salmonOncorhynchus masou[J].Fisheries Science,2000,66(4):670-677.
[22] ZYDLEWSKIJ,MCMORMICK SD.Developmental and environmental regulation of chloride cells in young American shad,Alosa sapidissima[J].Journal of Experimental Zoology,2001,290(2):73-87.
[23] EVANSD H.The Physiology of Fishes[M].Boca Raton:CRC Press,1993:315-341.
[24] LAURENT P,CHEVALIER C,WOOD C M.Appearance of cuboidal cells in relation to salinity in gills ofFundulus heteroclitus,a species exhibiting branchial Na+butnotCl-uptake in freshwater[J].Cell and Tissue Research,2006,325(3):481-492
[25] LEE T H,HWANG P P,LIN H C,et al.Mitochondria-rich cells in the branchial epithelium of the teleost,Oreochromismossambicus,acclimated to various hypotonic environments[J].Fish Physiology and Biochemistry,1996,15(6):513-523.
[26] CHOI J H,LEE K,INOKUCHI M,et al.Morphofunctional modifications in gill mitochondriarich cells of Mozambique tilapia transferred from freshwater to 70%seawater,detected by dual observation ofwhole-mount immunocytochemistry and scanning electron microscopy[J].Comparative Biochemistry and Physiology,2011,158A(4):132-142.
[27] FRIDMAN S,RANA K J,BRON J E.Structural differentiation of apical opening in active mitochondria-rich cells during early life stage of Nile tilapia(Oreochromis niloticusL.)as a response to osmotic challenge[J].Fish Physiology and Biochemistry,2013,39(5):1101-1114.
[28] CHANG I C,LEE T H,YANG C H,et al.Morphology and function of gill mitochondria-rich cells in fish acclimated to different environments[J].Physiological and Biochemical Zoology,2001,74(1):111-119.
[29] CHANG I C,WEI Y Y,CHOU F I,et al.Stimulation of Cl-uptake and morphological changesin gill mitochondria-rich cells in freshwater tilapia(Oreochromismossambicus)[J].Physiological and Biochemical Zoology,2003,76(4):544-552.
[30] 廖雅丽,张晨捷,高权新,等.鱼类离子细胞及离子通道的研究进展[J].海洋渔业,2015,37(1):77-86.
LIAO Y L,ZHANG C J,GAO Q X,et al.New insights into ionocytes and ion channels[J].Marine Fisheries,2015,37(1):77-86.
[31] TSAI J C,HWANG P P.Effects of wheat germ agglutinin and colchicine on microtubules of the mitochondria-rich cells and Ca2+uptake in tilapia(Oreochromismossambicus)larvae[J].The Journal of Experimental Biology,1998,201(15):2263-2271.
Characters ofmorphology,distribution and quantity of branchial chloride cells of juvenile Acipenser sinensis acclimated in freshwater and brackish water
ZHAO Feng,YANG Gang,ZHANG Tao,WANG Yu,ZHUANG Ping
(Key laboratory of Fisheries Ecology of the Yangtze Estuary,East China SeaFisheries Research Institute,Chinese Academy Fishery Sciences,Shanghai 200090)
To understand the adaptive changes of branchial chloride cells(CCs)in juvenile Chinese sturgeon Acipenser sinensis in the Yangtze Estuary,juveniles were acclimated to 0(freshwater,FW)and brackish water(salinity 15,BW)for 60 days.Histological and ultrastructural observation on branchial CCs were comparatively studied in juveniles adapted either in FW or BW.Results showed that:CCswere slightly oval,and mainly distributed in the base of lamellae and interlamellar regions of filaments.When juveniles were adapted in BW,the number and size of branchial CCs on filaments increased significantly.However,there was no change on number of CCs,and there was a significant increase on size of CCs on lamellae.The morphology of CCs on filaments and lamellae did not change in fish adapted to FW or BW.Apical opening of CCswas largely classified into the following three types:I,convex type;II,concave type;III,deep-hole type.In FW,apical opening of CCs on juvenile Chinese surgeon gills presented as type Iand II,and no type IIIwas found.After the fish was adapted in BW,apical opening of CCs on juvenile gillswasmainly type III,and a small amountof type Iand IIapical opening appeared.The increase of number and size of branchial CCs on filaments and the morphological changes of apical opening of CCs is the adapting adjustment of juvenile Acipenser sinensis for osmoregulation and maintaining osmotic balance.
Acipenser sinensis;chloride cell;morphology and distribution;quantity character;apical opening;osmoregulation
S 917
A
1004-2490(2016)01-0035-07
2015-08-01
公益性行业(农业)科研专项资金项目(201203065)
赵 峰(1978-),男,博士,副研究员,主要从事河口渔业生态与保护生物学研究。E-mail:zhaof@ecsf.ac.cn
庄 平,研究员。E-mail:pzhuang@ecsf.ac.cn

