陆地棉GhRACK1启动子的克隆与缺失分析
杨江涛 庞伟民 王旭静 吕少溥 唐巧玲 王志兴中国农业科学院生物技术研究所, 北京 100081
陆地棉GhRACK1启动子的克隆与缺失分析
杨江涛庞伟民王旭静*吕少溥唐巧玲王志兴*
中国农业科学院生物技术研究所, 北京 100081
摘要:在基因工程发展中, 有应用前景的纤维特异表达启动子的缺乏是制约棉花纤维品质改良的主要因素之一。本研究利用反向PCR方法克隆到陆地棉纤维优势表达基因GhRACK1的上游启动子GhRACK1-P。GhRACK1-P全长为1987 bp, 含有TATA-box、CAAT-box、MYB2和I-box等顺式作用元件和调控元件。根据调控元件的分布对GhRACK1-P进行不同程度的缺失, 获得了p1、p2、p3和p4缺失体; 构建不同缺失体和全长GhRACK1-P的植物表达载体, 并通过农杆菌介导法导入烟草, 获得不同类型转基因烟草。GUS组织化学染色结果表明, 全长启动子GhRACK1-P只能驱动gus基因在转基因烟草的幼根及根毛中表达, 其他缺失体驱动gus基因在转基因烟草的花粉、叶片和根中表达, 为组成型表达启动子。由于根毛与棉花纤维具有相似的发育机制, 推测全长GhRACK1-P可能为纤维优势表达启动子。本研究结果为棉花纤维品质改良基因工程提供了新的调控元件。
关键词:纤维优势表达; GhRACK1启动子; 克隆; 缺失分析
本研究由国家转基因生物新品种培育重大专项(2014ZX08010-005)资助。
This study was supported by the National Major Project of Breeding for New Transgenic Organisms (2014ZX08010-005).
第一作者联系方式: E-mail: JT_Y1990@163.com
我国既是棉花生产大国, 也是原棉消费大国,棉花生产在国民经济中占有十分重要的地位。目前我国棉花纤维品质中等且单一, 虽然基本上可满足纺织业的要求, 但原棉品质不如美国和澳大利亚等产棉国, 缺乏国际竞争力。因此, 棉花纤维品质改良成为当前我国棉花育种的主要目标之一。
受种质资源缺乏、育种周期长、产量性状与品质性状负相关等因素的影响, 利用常规育种技术较难培育出纤维品质优良的棉花新种质。基因工程技术的发展为培育纤维品质优良的棉花新品种提供了
新的途径。经过近20年的努力, 目前研究者们已克隆了多个纤维发育相关基因和纤维优势表达启动子,并在棉花纤维品质改良基因工程中得到应用, 取得了可喜的进展[1-5], 但目前仍缺乏有真正应用价值的优良基因和调控元件。
RACK1蛋白(receptor for activated C kinase 1,活化态C激酶1受体)普遍存在于动植物中, 是一种高度保守的WD40重复蛋白, 在细胞骨架、蛋白运输、细胞信号转导及分生组织形成等生命活动中扮演重要角色[6]。自1993年首次从烟草愈伤组织中克隆了对生长素2,4-D响应的RACK1基因以来[7], 目前已从拟南芥、水稻、烟草、苜蓿、油菜等多种植物中克隆到了RACK1基因[7-11]。本实验室通过叶片和纤维差减杂交得到了RACK1基因的EST序列, 并通过RACE技术克隆得到了GhRACK1基因的全长序列, RT-PCR表明此基因在纤维中优势表达, 荧光定量PCR分析表明此基因在纤维伸长期的表达量大约是叶片中的20倍左右, 上述结果均表明GhRACK1在纤维中优势表达[12]。
鉴于GhRACK1在纤维中优势表达, 本研究通过反向PCR方法克隆GhRACK1基因的5′上游启动子GhRACK1-P, 根据GhRACK1-P上调控元件的分布进行不同程度的缺失, 利用GhRACK1-P缺失体驱动gus基因在烟草中表达, 分析不同GhRACK1-P缺失体转基因烟草中GUS的组织表达模式, 以期获得棉纤维中优势表达的启动子, 为棉花纤维品质改良基因工程提供新的调控元件。

表1 反向PCR扩增所需引物和模板Table 1 Primer and template for inverse-PCR amplification
1 材料与方法
1.1试验材料
烟草品种NC89、陆地棉苏棉12、大肠杆菌DH5α、农杆菌LBA4404、植物表达载体pCamBIA 2300由本实验室保存。限制性内切酶、Taq酶和T4连接酶购自TaKaRa或NEB试剂公司。其他化学试剂为国产分析纯。
1.2反向PCR克隆GhRACK1基因的启动子GhRACK1-P
利用植物基因组DNA提取试剂盒(天根生化,北京)提取苏棉12的基因组DNA。分别经Bgl II和Msc I单酶切后自连环化。同时根据已知序列设计引物并进行反向PCR扩增, 反应所需引物和模板详见表1。PCR条件94℃ 5 min; 94℃ 30 s, 72~63℃ 30 s, 72℃, 3 min, 每循环降低1℃, 依次进行10个循环; 94℃ 30 s, 66℃ 30 s, 72℃ 3 min, 30个循环; 72℃10 min。最终PCR产物与T-载体连接后转化大肠杆菌, 挑选阳性克隆并测序鉴定。
1.3GhRACK1-P缺失体的克隆与植物表达载体构建
根据GhRACK1-P序列设计引物R-1、F-600、F-1036、F-1260、F-1620和F-1987。为构建载体方便, 在R-1的3′端添加了Xba I酶切位点, 在F-1987、F-600、F-1036、F-1260和F-1620的3′端添加了Pst I酶切位点。以GhRACK1-P质粒为模板, 以R-1/F-1987、R-1/F-600、R-1/F-1036、R-1/F-1260和R-1/F-1620为引物进行PCR扩增, 反应条件为94℃
5 min; 94℃ 45 s, 62℃或55℃ 30 s, 72℃ 1~2 min, 30个循环; 72℃ 10 min (表2)。获得的PCR产物与T-载体连接后转化大肠杆菌, 挑选阳性克隆并测序鉴定, 正确的阳性克隆分别被命名为GhRACK1-P、p1、p2、p3和p4。
Hind III和EcoR I双酶切pBI121和pCamBIA 2300, 分别回收3 kb和9 kb左右的DNA条带, 连接后形成中间载体pCamBIA230035S。Pst I和Xba I双酶切pCamBIA230035S、p1、p2、p3、p4和GhRACK1-P, 分别回收大片段和相应的小片段, 连接后形成植物表达载体PGhrack-1、PGhrack-2、PGhrack-3、PGhrack-4和PGhrack-5。
1.4农杆菌介导法转化烟草
利用热击法将表达载体PGhrack-1、PGhrack-2、PGhrack-3、PGhrack-4和PGhrack-5转入农杆菌LBA4404。含有目标载体的农杆菌LBA4404在含有250 mg L–1链霉素、250 mg L–1利福平和100 mg L–1卡那霉素的YEB液体培养基中被活化。收集菌体并用液体MS基本培养基重悬稀释至OD600为0.1~0.2。将继代培养15 d左右的烟草组培苗叶片切成2 mm左右的长条, 于农杆菌液中侵染10 min。然后放在含有2 mg L–16-BA和0.5 mg L–1NAA的MS培养基上, 25℃暗培养3~4 d。将外植体转移到含有NAA 0.5 mg L–1、6-BA 2 mg L–1、Kan 100 mg L–1和Carb 500 mg L–1的MS固体培养基上分化培养, 3~4周后即有再生芽的出现。待再生芽长到1 cm左右时, 将其移到含有Kan 100 mgL–1和Carb 500 mg L–1的MS培养基上进行生根培养。
1.5转基因烟草的PCR检测
根据GhRACK1-P缺失体序列设计系列引物。提取转基因烟草基因组DNA, 利用对应的引物进行PCR扩增, 反应条件为94℃ 5 min; 95℃ 1 min, 50~54℃ 30 s, 72℃ 1 min, 32个循环; 72℃ 10 min,具体见表3。

表2 GhRACK1-P缺失体的克隆所需引物和反应条件Table 2 Primer and PCR progress for cloning of GhRACK1-P truncations

表3 转基因烟草PCR检测所需引物Table 3 Primers for PCR detection of transgenic tobacco
1.6GUS组织化学染色
参考Jefferson等[13]的方法, 将植物组织浸入适量X-Gluc溶液中, 密封, 37℃避光过夜, FAA固定15 min, 然后依次用75%、85%、95%和100%酒精脱色,观察是否有蓝色出现。
2 结果与分析
2.1GhRACK1-P的克隆及序列分析
第一次反向PCR获得了514 bp的上游序列, 第二次反向PCR获得了1473 bp的上游序列。将两次反向PCR所得序列拼接后获得了GhRACK1基因的5′端上游序列1987 bp。
利用http://www.cbrc.jp/research/db/TFSEARCH. html在线软件预测GhRACK1基因上游的1987 bp中可能的转录起始位点, 发现它可能位于–71 bp, 序列为TCATTCT, 此序列符合PyPyANT/APyPy的保守序列结构。PlantCare分析其上面调控元件的分布,发现此序列上除了含有TATA-box、CAAT-box等顺式作用元件外, 还含有3个与根特异表达有关的RootmotifTAPOX1、1个与表皮毛发育有关的MYB2、以及TBOX、LIBOX、IBOXCORE等组织特异性调控元件(图1)。

图1 GhRACK1-P的序列及其部分调控元件Fig. 1 Sequence of GhRACK1-P and its partial regulation elements
2.2启动子缺失及植物表达载体的构建
根据GhRACK1-P序列上与表皮毛、根、纤维特异表达相关作用因子的分布, 对GhRACK1-P进行了不同程度的缺失, 利用PCR方法克隆得到了p1、p2、p3、p4 四个缺失体。相对于全长启动子GhRACK1-P来说, p4缺失体上主要缺失了与表皮毛发育相关的调控元件MYB2, p3缺失体上主要缺失了表皮毛发育相关的调控元件MYB2、组织特异性启动元件OSE1、种皮特异性启动元件PROLAMIBOX, p2缺失体上主要缺失了表皮毛发育相关的调控元件MYB2、根特异表达调控元件RootmotifTAPOX1、组织特异性启动元件OSE1、种皮特异性启动元件PROLAMIBOX、纤维特异相关的启动子元件L1BOX、参与棉花纤维发育与乙烯合成途径的IBOXCORE等, p1缺失体上缺失了所有的与根和纤维特异表达相关的调控元件, 主要含有TATA-box、CAAT-box等启动子必需的调控元件(图2)。
以pCAMBIA2300为基础载体, 以gus为报告基因, 分别构建了全长启动子GhRACK1-P和4个启动子缺失体的植物表达载体。在构建的系列植物表达载体中, 报告基因gus基因由GhRACK1启动子的不同缺失体驱动, 由nos终止子终止表达; 筛选标记基因为npt II, 由CaMV 35S启动子驱动表达, 35S polyA终止表达。构建的植物表达载体经多酶切鉴定和测序证明是正确的(图3)。

图2 GhRACK1-P的缺失示意图Fig. 2 Schematic diagram of deletion of GhRACK1-P

图3 植物表达载体基因表达盒示意图Fig. 3 Schematic diagram of plant expression vector35S P: CaMV 35S promoter; npt II: Neomycin phosphotransferase gene; 35S polyA: CaMV 35S 3’-UTR polyA; PGhrack promoter: different truncation of GhRACK1-P; gus: Beta glucuronidase gene; Nos T: Nos terminor.
2.3不同缺失体转基因烟草的获得和PCR检测
将含不同启动子缺失体的植物表达载体通过冻融法导入农杆菌LBA4404, 并利用农杆菌介导法导入烟草NC89中, 获得了分别含有启动子缺失体p1、p2、p3、p4和全长启动子GhRACK1-P的转基因烟草。
提取转基因烟草DNA进行PCR检测, 结果不同类型的转基因烟草中均扩增出了相应的目的条带,含有启动子缺失体p1、p2、p3和p4和全长启动子GhRACK1-P的转基因烟草中扩增的目的条带大小分别约为330、790、486、521、971和450 bp (图4)。经PCR检测后, 分别获得了40、28、32、34和41株含有启动子缺失体p1、p2、p3、p4和全长启动子GhRACK1-P的转基因烟草。
2.4不同缺失体的时空表达模式分析
分别取不同类型转基因烟草的根、叶和花粉经GUS组织化学染色发现, 含有启动子缺失体p1、p2、p3和p4的转基因烟草的根、叶和花粉中均有GUS的表达, 而全长启动子GhRACK1-P的转基因烟草只能在幼根及根毛中检测到GUS表达。说明只有全长启动子GhRACK1-P为幼根及根毛特异表达, 其他缺失体均为组成型表达(图5)。相对于启动子缺失体而言, 全长启动子序列主要增加了MYB2元件和ROOTMOTIFTAPOX1等与表皮毛和根特异表达有关的调控元件, 据此推测, 全长启动子上的这些元件与其组织特异表达密切相关, 可能是其在根毛和幼根中表达所必需的。
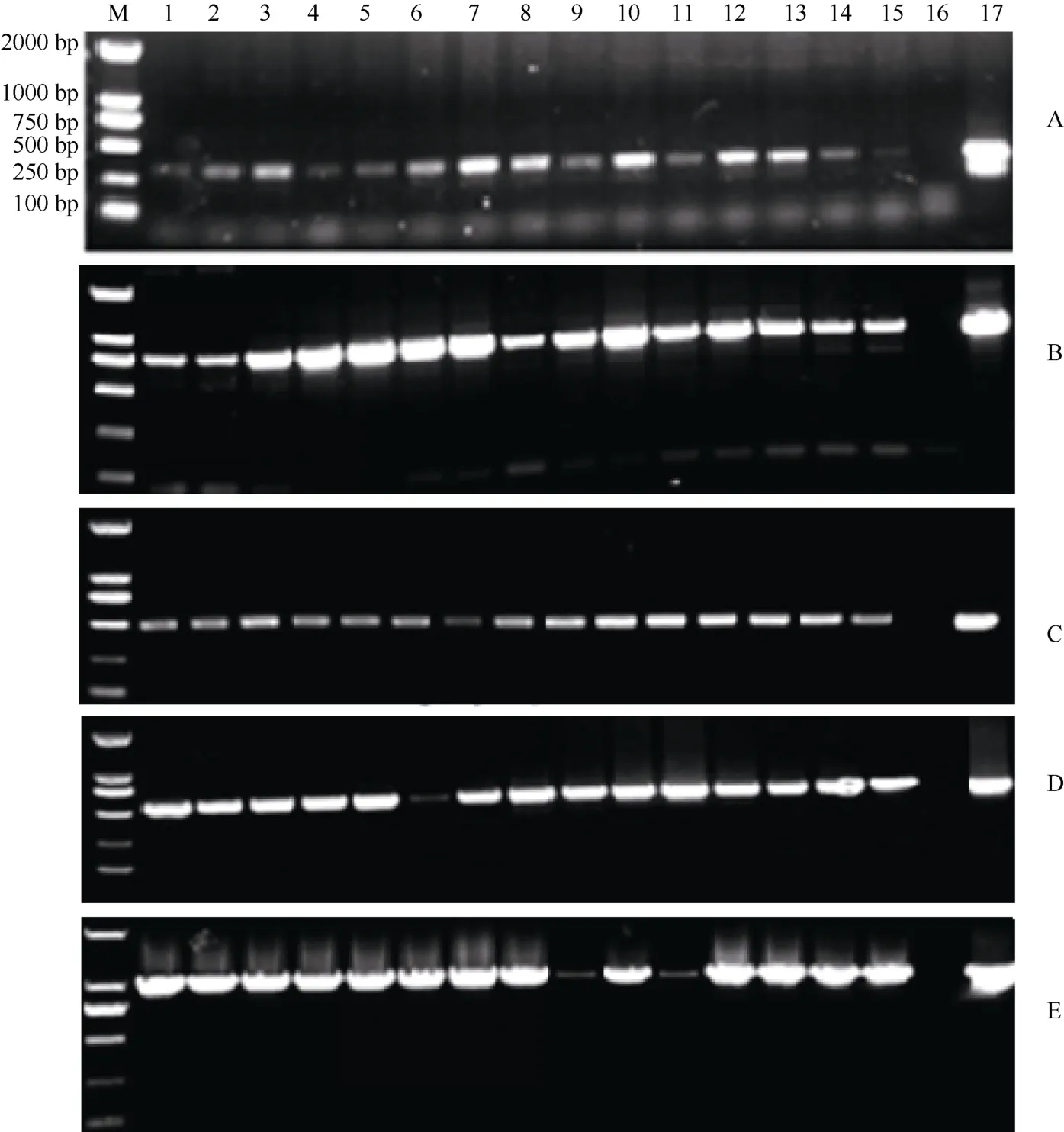
图4 转基因烟草的PCR检测Fig. 4 PCR detection of transgenic tobaccoA, B, C, D, E分别为含有启动子缺失体p1、p2、p3、p4和全长启动子GhRACK1-P的转基因烟草的PCR检测; M: 2k marker; 1~15: 转基因烟草; 16: NC89; 17: 质粒DNA。A, B, C, D, E represent PCR detection of transgenic tobacco containing p1, p2, p3, p4, and GhRACK1-P, respectively. M: 2k marker; 1–15: transgenic tobacco plants; 16: NC89; 17: Plasmid DNA.
3 讨论
为实现目标基因在转基因植物中的定时、定位表达, 降低植物体内代谢负担和减轻对作物本身的不利影响, 组织特异性启动子越来越受到研究者的关注。组织特异性启动子除了具有核心启动子区外,还具有调控基因在组织中特异表达的调控元件, 这些组织特异表达调控元件在启动子中的分布位置、数目和种类决定其组织表达特性。目前, 已发现了多个与组织特异和诱导表达相关的调控元件, 如RHEs为根毛特异表达的调控元件[14-15]; CANNTG、ACGT和GATA等顺式作用元件为决定组织特异表达相关转录因子的结合位点[16]。
5′端缺失法是研究启动子表达特性和调控元件功能最常用的方法之一, 利用限制性内切酶、核酸外切酶、PCR等方法从启动子5′端上游对启动子进行不同程度的缺失, 通过检测缺失体驱动报告基因在转基因植物中的表达情况来推断启动子不同缺失片段的结构和功能[17]。
利用PlantCare在线软件分析了本研究获得的GhRACK1-P启动子上面调控元件的分布, 发现除含有TATA-box、CAAT-box等顺式作用元件外, 含有与根特异表达有关的RootmotifTAPOX1和与表皮毛发育有关的MYB2等组织特异性调控元件。含不同启动子缺失体转基因烟草的GUS组织化学染色结果表明, 缺失体p1、p2、p3和p4均驱动gus基因在叶片、幼根和花粉中表达, 不具有组织特异性, 说明–644 ~ –640 bp和–1257 ~ –1253 bp处的Rootmotif-TAPOX1不是GhRACK1-P启动子组织特异表达所必需的; 缺失启动子上–1920 ~ –1916 bp处的RootmotifTAPOX1和–1846 ~ –1841 bp处的MYB2
元件后, GhRACK1-P启动子的幼根及表皮毛特异表达的特性也随之消失, 推测–1920 ~ –1916 bp处的RootmotifTAPOX1和–1846 ~ –1841 bp处的MYB2元件是幼根及表皮毛特异表达必需的。
棉纤维是从胚珠外珠被上的单个表皮细胞分化和发育而来的, 与烟草和拟南芥的表皮毛具有相似的发育机制[18-19]。鉴于棉花遗传转化周期比较长,转化效率低, 研究者们经常利用模式植物来分析纤维优势表达基因启动子的表达模式, 如纤维优势表达基因GhRDL1启动子在棉纤维中为优势表达, 在模式植物拟南芥中表现出表皮毛特异表达的模式[20];编码脂转移蛋白的基因Fsltp4在棉纤维发育中高表达, 其启动子在转基因烟草中表现出表皮毛特异表达的特性[21]。本研究利用GhRACK1-P分别驱动gus 和gfp基因在转基因烟草中稳定和瞬时表达, 前者结果说明GhRACK1-P驱动gus基因只在转基因烟草的幼根及根毛中表达, 后者结果证明GhRACK1-P驱动gfp基因只在烟草叶片的表皮毛表达(未发表数据), 据此初步推测GhRACK1-P为纤维优势表达启动子, 但其组织表达特性仍需在转基因棉花中进一步研究。
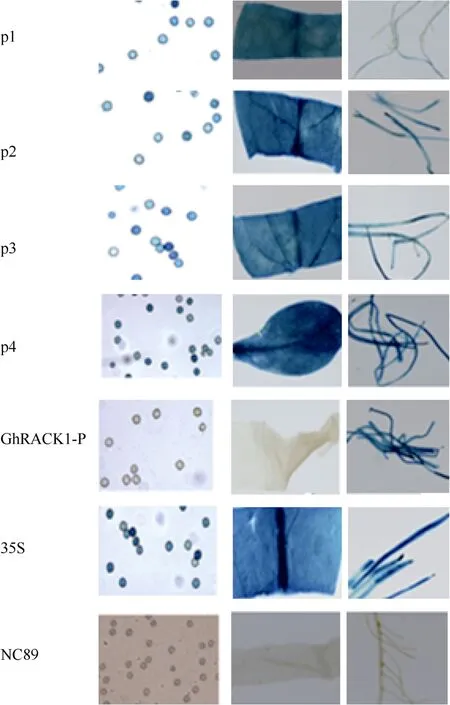
图5 不同类型转基因烟草的GUS组织化学染色分析Fig. 5 Histochemical GUS assay of transgenic tobaccop1, p2, p3, p4, GhRACK1-P, 35S和NC89依次代表含启动子缺失体p1、p2、p3和p4, 全长启动子GhRACK1-P, CaMV 35S启动子转基因烟草和非转基因烟草NC89的花粉、叶片和根染色情况。p1: pollen, leaf and root of transgenic tobacco with p1; p2: pollen, leaf and root of transgenic tobacco with p2; p3: pollen, leaf and root of transgenic tobacco with p3; p4: pollen, leaf and root of transgenic tobacco with p4; GhRACK1-P: pollen, leaf and root of transgenic tobacco with GhRACK1-P; 35S: pollen, leaf and root of transgenic tobacco with CaMV 35S promoter; NC89: no transgenic tobacco NC89.
4 结论
克隆了陆地棉纤维优势表达基因GhRACK1的启动子GhRACK1-P。只有全长GhRACK1-P在转基因烟草幼根及根毛中特异表达, 初步推测GhRACK1-P为纤维优势表达启动子。
References
[1] Huang G Q, Gong S Y, Xu W L, Li W, Li P, Zhang C J, Li D D, Zheng Y, Li F G, Li X B. A fasciclin-like arabinogalactan protein, GhFLA1, is involved in fiber initiation and elongation of cotton. Plant Physiol, 2013, 161: 1278–1290
[2] Lee J, Burns T H, Light G, Sun Y, Fokar M, Kasukabe Y, Fujisawa K, Maekawa Y, Allen R D. Xyloglucan endotransglycosylase/hydrolase genes in cotton and their role in fiber elongation. Planta, 2010, 232: 1191–1205
[3] 孟亚雄, 张金文, 马小乐, 张金林, 仲军, 王化俊. 棉纤维特异启动子LTP12驱动的基因phaB、phaC双价载体构建.草业科学, 2010, 19(3): 170–176
Meng Y X, Zhang J W, Ma X L, Zhang J L, Zhong J, Wang H J. Constructing expression vector of genes phaB and phaC derived by specific promoter LTP12 for cotton fiber. Acta Pratac Sin, 2010, 19(3): 170–176 (in Chinese with English abstract)
[4] 吕少溥, 王旭静, 唐巧玲, 王志兴. 棉纤维特异基因及其启动子的研究进展. 生物技术进展, 2014, 4(1): 1–6
Lü S P, Wang X J, Tang Q L, Wang Z X. Research progress of fiber-specific gene and promoter from cotton. Curr Biotech, 2014, 4(1): 1–6 (in Chinese with English abstract)
[5] Shan C M, Shang-guan X X, Zhao B, Zhang X F, Chao L M, Yang C Q, Wang L J, Zhu H Y, Zeng Y D, Guo W Z, Zhou B L, Hu G J, Guan X Y, Chen Z J, Wendel J F, Zhang T Z, Chen X Y. Control of cotton fibre elongation by a homeodomain transcription factor GhHOX3. Nat Commun, 2014, 5: 5519
[6] Ron D, Mochly-Rosen D. Agonists and antagonists of protein kinase C function, derived from its binding proteins. J Biol Chem, 1994, 269: 21395– 21398
[7] Ishida S, Takahashi Y, Naqata T. Isolation of cDNA of an auxin-regulated gene encoding a G protein beta subunit-like protein from tobacco BY-2 cells. Proc Natl Acad Sci USA, 1993, 90: 11152–11156
[8] Iwasaki Y, Komano M, Ishikawa A, Sasaki T, Asahi T. Mo-
lecular cloning and characterization of cDNA for a rice protein that contains seven repetitive segments of the Trp-Asp forty-amino-acid repeat (WD-40 repeat). Plant Cell Physiol, 1995, 36: 505–510
[9] Vahlkamp L, Palme K. AtArcA, accession No. U77381, the Arabidopsis thaliana homolog of the tobacco ArcA gene (PGR97-145). Plant Physiol, 1997, 115: 863
[10] McKhann H I, Frugier F, Petrovics G, de la Peña T, Jurkevitch E, Brown S, Kondorosi E, Kondorosi A, Crespi M. Cloning of a WD-repeat-containing gene from alfalfa (Medicago sativa): a role in hormone-mediated cell division. Plant Mol Biol, 1997, 34: 771–780
[11] Kwak J M, Kim S A, Lee S K, Oh S A, Byoun C H, Han J K, Nam H G. Insulin-induced maturation of Xenopus oocytes is inhibited by microinjection of a Brassica napus cDNA clone with high similarity to a mammalian receptor for activated protein kinase C. Planta, 1997, 201: 245–251
[12] 庞伟民, 靳茜, 王旭静, 杨江涛, 吕少溥, 唐巧玲, 王志兴.陆地棉纤维优势表达基因GhRACK1的克隆与序列分析.生物技术进展, 2015, 5: 366–370
Pang W M, Jin X, Wang X J, Yang J T, Lü S P, Tang Q L, Wang Z X. Cloning and sequence analysis of GhRACK1 gene dominant expressed in fiber from Gossypium hirsutum. Curr Biotech, 2015, 5: 366–370 (in Chinese with English abstract)
[13] Jefferson R A, Kavanagh T A, Bevan M W. GUS fusions: beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J, 1987, 6: 3901–3907
[14] Taniguchi M, Izawa K, Ku M S, Lin J H, Saito H, Ishida Y, Ohta S, Komari T, Matsuoka M, Sugiyama T. The promoter for the maize C4pyruvate, orthophosphate dikinase gene directs cell- and tissue-specific transcription in transgenic maize plants. Plant Cell Physiol, 2000, 41: 42–48
[15] Won S K, Lee Y J, Lee H Y, Heo Y K, Cho M, Cho H T. cis-element- and transcriptome-based screening of root hair-specific genes and their functional characterization in Arabidopsis. Plant Physiol, 2009, 150: 1459–1473
[16] Nitz I, Berkefeld H, Puzio P S, Grundler F M. Pyk10, a seedling and root specific gene and promoter from Arabidopsis thaliana. Plant Sci, 2001, 161: 337–346
[17] 王旭静, 李为民, 唐巧玲, 贾士荣, 王志兴. 中棉(Gossypium arboreum)光锈导基因Gacab启动子在转基因烟草中的功能缺失分析. 作物学报, 2009, 35: 1006–1012
Wang X J, Li W M, Tang Q L, Jia S R, Wang Z X. Function deletion analysis of light-induced Gacab promoter from Gossypium arboreum in transgenic tobacco. Acta Agron Sin, 2009, 35: 1006–1012 (in Chinese with English abstract)
[18] Suo J F, Liang X E, Li P, Zhang Y S, Xue Y B. Identification of GhMYB109 encoding a R2R3 MYB transcription factor that expressed specifically in fiber initials and elongating fibers of cotton (Gossypium hirsutum L.). Biochem Biophys Acta, 2003, 1630: 25–34
[19] Wang S, Wang J W, Yu N, Li C H, Luo B, Gou J Y, Wang L J, Chen X Y. Control of plant trichome development by a cotton fiber MYB gene. Plant Cell, 2004, 16: 2323–2334
[20] 上官小霞, 吴霞, 李燕娥. 棉花GhRDL1基因启动子分析. 华北农学报, 2010, 25(1): 6–10
Shang-guan X X, Wu X, Li Y E. Analysis of the promoter of cotton GhRDL1 gene. Acta Agric Boreali-Sin, 2010, 25(1): 6–10 (in Chinese with English abstract)
[21] Shang-guan X X, Xu B, Yu Z X. Promoter of a cotton fiber MYB gene functional in trichomes of Arabidopsis and glandular trichomes of tobacco. J Exp Bot, 2008, 59: 3533–3542
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151218.0915.020.html
Cloning and Deletion Analysis of GhRACK1 Promoter from Gossypium hirsutum
YANG Jiang-Tao, PANG Wei-Min, WANG Xu-Jing*, LÜ Shao-Pu, TANG Qiao-Ling, and WANG Zhi-Xing*
Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Abstract:The absence of fiber specific promoter with future prospect is one of the main factors to restrict the development of genetic engineering in cotton fiber improvement. A 1987 bp length promoter sequence of Gossypium hirsutum GhRACK1 gene, which encodes receptor for activated C kinase 1 and precedantly expresses in fiber, was cloned by combination of inverse PCR and touchdown PCR method. Sequence analysis showed there were lots of promoter regulation elements such as cis acting factor and the tissue specific regulation elements. The full-length GhRACK1-P and truncations from –600 to –1 bp, –1036 to –1 bp, –1260 to –1 bp and –1620 to –1 bp were obtained by PCR method. Each of the truncations was fused with gus gene and inserted into plant expression vectors pCamBIA2300. All constructs were transformed into Nicotiana tabacum var. NC89 through Agrobacterium-mediated transformation method. GUS histochemical assay showed that the full-length GhRACK1-P promoter was expressed in root and exhibited a tissue-specific expression manner. All of the truncations were expressed in root, leaf and pollen and exhibited a constitutive expression manner. Because there is the similar developmental mechanism between cotton fiber and tobacco young root or trichome, the results indicate that GhRACK1- P may be a fiber specific expression promoter.
Keywords:Preferential expression in fiber; GhRACK1 promoter; Clone; Deletion analysis
收稿日期Received(): 2015-05-29; Accepted(接受日期): 2015-11-20; Published online(网络出版日期): 2015-12-18.
通讯作者*(Corresponding authors): 王旭静, E-mail: wangxujing@caas.cn, Tel: 010-82106124; 王志兴, E-mail: wangcotton@126.com, Tel: 010-82106102
DOI:10.3724/SP.J.1006.2016.00368

