HA转hGM-CSF HepG2疫苗对IL-6诱导HepG2细胞EMT的影响及机制
朱全杰,段晓明,何 蜜,刘海涛
(1.湖南师范大学附属长沙医院,长沙 410006;2.长沙市第四医院消化内科,长沙 410006;3.湘潭市中心医院肿瘤内科,湘潭 411100;4.湖南师范大学附属长沙医院,长沙 410006)
HA转hGM-CSF HepG2疫苗对IL-6诱导HepG2细胞EMT的影响及机制
朱全杰1,段晓明2,何 蜜3,刘海涛4
(1.湖南师范大学附属长沙医院,长沙 410006;2.长沙市第四医院消化内科,长沙 410006;3.湘潭市中心医院肿瘤内科,湘潭 411100;4.湖南师范大学附属长沙医院,长沙 410006)
目的:探讨HA转hGM-CSF HepG2疫苗逆转IL-6诱导HepG2肝癌细胞上皮-间质转化(EMT)的机制。方法:体外用HA转hGM-CSF HepG2疫苗共培养受IL-6刺激的HepG2细胞,采用Traswell迁移实验,Westernblot、RT-PCR方法分别检测疫苗处理前后HepG2细胞的增殖及侵袭能力的变化、EMT标志物E-cadherin、调控因子(p-Stat3、Twist)蛋白及E-cadherin mRNA、Twist mRNA表达变化情况。结果:①IL-6组较阴性对照组穿膜细胞数明显增多,侵袭能力明显增强,差异有统计学意义。②IL-6组较阴性对照组E-cadherin的表达水平降低,p-Stat3、Twist蛋白表达升高,差异均有统计学意义。③疫苗组的穿膜细胞数较其他三组明显减少,侵袭能力下降,差异均有统计学意义。④转染后的疫苗组较其他三组E-cadherin蛋白表达升高,而p-Stat3、Twist蛋白表达下降,且差异均有统计学意义。⑤疫苗组较其他三组E-cadherin mRNA表达上调、Twist mRNA表达下调,且差异均有统计学意义。结论:①IL-6能诱导HepG2细胞产生EMT现象。②60Co处理的转hGM-CSF基因HepG2疫苗可能通过下调转录因子Twist 及Stat3的表达进而逆转IL-6诱导HepG2细胞EMT。
肝癌;hGM-CSF 基因;上皮-间质转化;肿瘤疫苗;IL-6
肝癌是我国常见的恶性肿瘤之一,位居我国肿瘤死亡率第三位[1],尽管当前肝脏外科的诊疗技术不断提高,但有机会手术治疗的患者仍不到30%;即使手术,3年复发率仍高达75%,究其原因主要是肝癌起病隐匿,转移率高,多数患者就诊时已是中晚期,且目前认为肝癌的发生发展是一个多基因,多途径和多阶段的复杂过程,发病机制尚不完全明确,这个肝癌综合治疗带来了一定难度[2,3]。研究显示在肿瘤细胞中JAK/STAT3 信号通路持续激活可促进肿瘤的发生发展;白细胞介素6(interleukin-6,IL-6)通过激活STAT3,促进肿瘤细胞上皮-间质转化(epithelial-mesenchymal transition,EMT),增强肿瘤细胞对免疫系统的侵袭作用[4-6]。肿瘤细胞发生EMT后twist基因表达上调,E-钙黏蛋白(E-cadherin)表达下调,p-stat3上调,使细胞黏附能力下降,侵袭和迁移能力增强[7]。在我们前期的研究中已证实HA纳米载体转hGM-CSF基因的HepG2 疫苗具有增强机体抗肿瘤免疫应答,降低免疫耐受,抗肿瘤的作用[8]。但具体机制仍不十分清楚,本研究主要通过将hGM-CSF基因转染HepG2细胞,并制备成肿瘤疫苗,然后观察其对IL-6诱导HepG2细胞EMT的影响及其可能的机制。
1 资料与方法
1.1 细胞培养与试剂HepG2细胞株由中南大学湘雅细胞库馈赠。人IL-6购于Peprotech公司;羟基磷灰石购买于上海源叶生物公司;(Human)GM-CSF质粒购自于上海吉凯基因;一抗试剂:单克隆β-actin抗体购自于美国proteintech公司、单克隆抗体(E-cadherin、twist、p-stat3)均购自于美国abcam公司;二抗试剂均购自于美国proteintech公司;ranswell板(8 μm)购自Corning公司;ECL化学发光检测试剂盒购于 Pierce公司;RNaseA购于中国上海碧云天生物公司;逆转录试剂盒、qRTPCR试剂盒购买于北京康为世纪公司。
1.2 IL-6诱导HepG2 EMT参照文献[9]方法;将人肝细胞癌HepG2细胞用含10%小牛血清的RPMI-1640培养液常规培养,用PBS重悬细胞并调细胞密度为1×107/mL,在37℃、5%CO2孵箱中培养,胰酶消化、传代,取对数生长期细胞实验。IL-6组用含50 ng/mL IL-6孵育HepG2细胞24 h(IL-6组),阴性对照组则采用单纯培养基培养24 h(阴性对照组),于倒置显微镜下观察细胞形态变化。
1.3 基因转染及疫苗制备参照文献[10]方法;将课题组构建的GV230-hGM-CSF 真核表达载体转染至HepG2细胞株(重组质粒组),用含10%小牛血清的RPMI-1640培养液常规培养,PBS重悬细胞并调细胞密度为1×107/mL;取体外培养的转入hGM-CSF基因的HepG2细胞,经亚致死剂量(10 Gy)的放射线间断照射后制备成转hGM-CSF基因的HepG2疫苗(疫苗组);采用Western-blot和RT-PCR方法验证两种细胞hGMCSF基因的表达;筛选稳定转染的细胞并扩增培养;以转染空载质粒(空质粒组)及未经转染的HepG2细胞(空白对照组)作为对照。
1.4 Transwell 试验HepG2细胞的体外侵袭能力:在侵袭小室的上、下室之间铺有用基质胶(matrigel)制备好的侵袭膜,取各组对数期细胞悬液用(0 ng/mL、50 ng/ mL,IL-6作用24 h),按100 μL每孔,接种于侵袭膜上,37℃、5%CO2培养24 h,擦去膜上细胞及基质胶,取膜、固定、结晶紫染色,显微镜下计算穿膜细胞数。每组细胞设3个复孔,重复3次实验。
1.5 Western blot 法检测Twist、E-cadherin 和Stat3蛋白的表达提取各组细胞蛋白,BCA 法测定蛋白浓度。按照每孔50 μg总蛋白进行SDS-PAGE电泳,转膜,用5%脱脂奶粉的TBST封闭1h,一抗(β-actin 1:4000、E-cadherin 1:10000、twist 1:500、p-stat3 1:200000)4℃孵育过夜,TBST漂洗,二抗(1:3000),室温孵育1h,TBST 漂洗3次,每次15min,ECL化学发光,采集图像,每组实验重复3次。
1.6 qRT-PCR 法检测E-cadherin 和Twist mRNA的表达用PBS 洗涤各组细胞3次,向各孔加入1 mL RNAiso Plus,按说明书方法提取总RNA,吸取2 μL RNA溶液于石英比色皿中,用无酶水定容至100 μ L,紫外分光光度仪测A260 /A280的比值,重复3次,计算RNA 浓度(RNA浓度(ng/μL)=A260×稀释倍数×40),以mRNA为模板将其逆转录为cDNA。以β-actin为内参基因,使用2-△△Ct法计算基因的相对表达水平,引物序列见(表1),引物由南京金斯瑞公司合成。
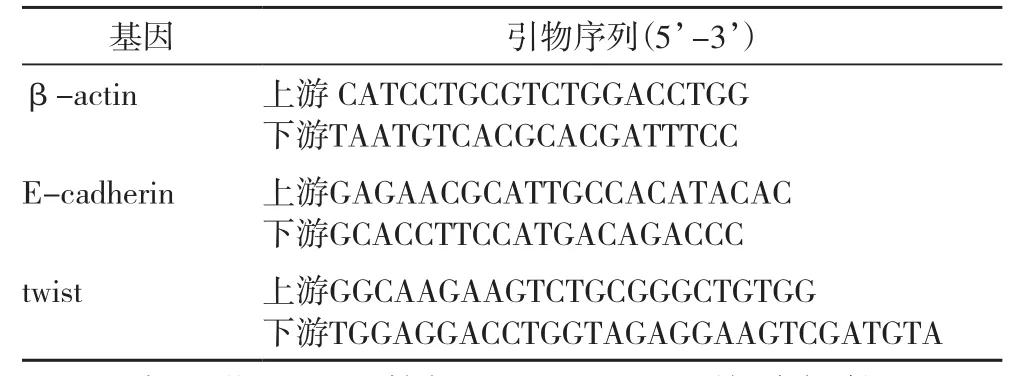
表1 PCR 引物序列
1.7 统计学方法数据经SPSS 19.0统计软件处理。计量资料以“mean±SD”表示,两组数据间比较采用t检验,多组数据间比较用单因素方差分析,组间两两比较满足方差齐性要求时用LSD,如不满足方差齐性要求时采用Tambane,s T2,以P<0.05为差异有统计学意义。
2 结果
2.1 IL-6诱导及转染hGM-CSF基因后HepG2细胞侵袭能力的变化Transwell 显示,IL-6组较阴性对照组侵袭能力明显增强,IL-6组穿膜细胞数为(174.4± 6.3)个,而阴性对照组穿膜细胞数为(112.5±3.1)个,差异有统计学意义(P<0.05)(见图1)。转染hGM-CSF基因后疫苗组较其他三组侵袭能力下降,疫苗组的穿膜细胞数为(61.4±3.6)个,分别与重组质粒组(83.6±6.0)个、空质粒组(169.4±5.2)个、空白对照组(171.4±5.6)个比较,差异均有统计学意义(P<0.05)(见图2)。
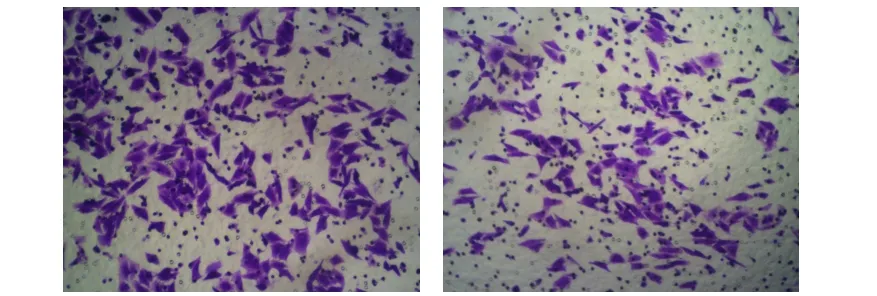
图1 IL-6诱导HepG2细胞后侵袭能力的变化(100×):A IL-6组B.阴性对照组

图2 转染hGM-CSF基因对IL-6诱导HepG2细胞侵袭能力影响的变化(100×):C.空白对照组D.重组质粒组E.空质粒组F.疫苗组
2.2 IL-6诱导及转染hGM-CSF基因后HepG2细胞EMT标志物表达的变化
2.2.1 IL-6诱导后HepG2细胞EMT标志物表达的变化(表2)
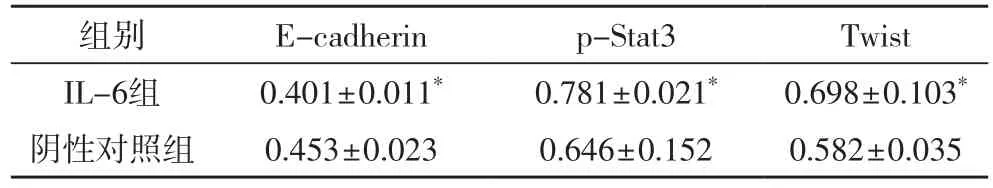
表2 各组细胞p-STAT3、Twist 及E-cadherin 蛋白相对表达量比较
2.2.2 转染hGM-CSF基因后HepG2细胞EMT标志物及相关调控因子的变化(表3)
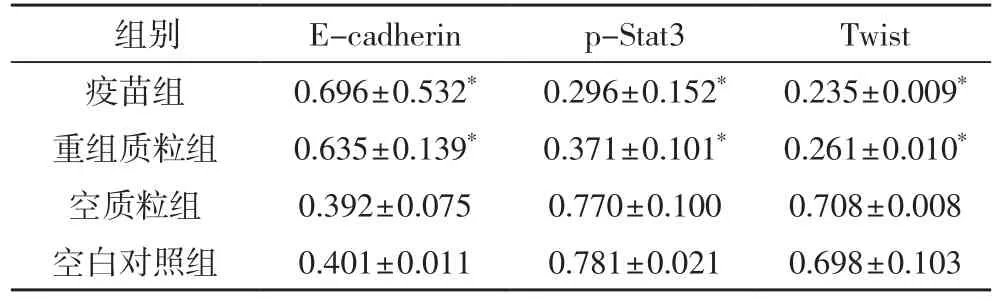
表3 各组细胞p-STAT3、Twist 及E-cadherin 蛋白相对表达量比较
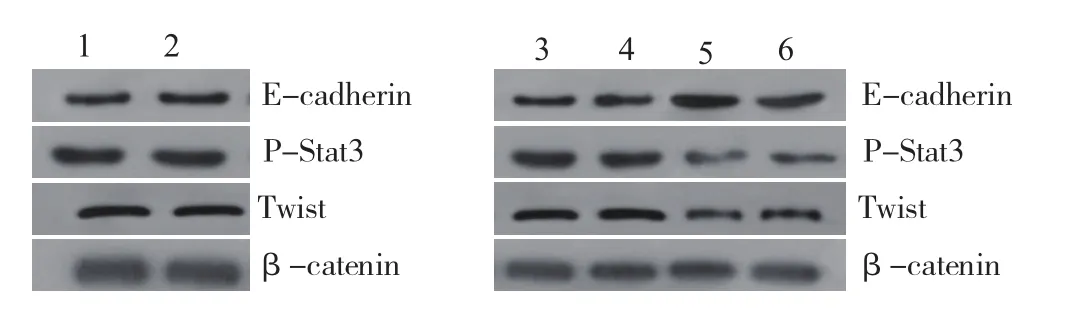
图3 Western-blot法检测IL-6诱导及转染hGM-CSF基因后HepG2细胞EMT标志物表达的变化:1.阴性对照组 2.IL-6组 3.空白对照组 4.空质粒组 5.疫苗组 6.重组质粒组
2.3 转染hGM-CSF基因后HepG2细胞Twist、E-cadherin mRNA相对表达的影响
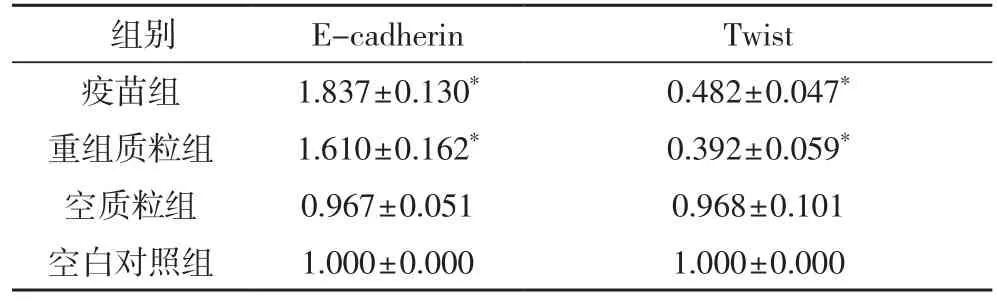
表4 各组细胞Twist、E-cadherin mRNA 表达比较
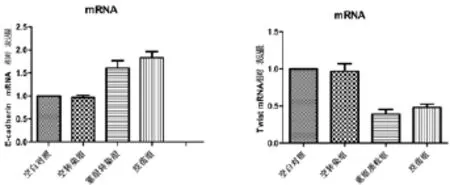
图4 qRT-PCR法检测转染hGM-CSF基因后HepG2细胞后E-cadherin、Twist mRNA相对表达
3 讨论
越来越多的研究证实EMT可促进多种肿瘤细胞的转移,如膀胱癌、原发性肝癌、结肠癌和恶性黑色素瘤等[11-13]。EMT最主要的分子标志是上皮细胞标记物E-Cadherin的表达下调,且E-Cadherin蛋白的表达缺少是上皮性肿瘤细胞侵袭的前提条件[9]。相关报道,IL-6可持续激活JAK/STAT3 信号通路,诱导肿瘤细胞EMT,促进肿瘤细胞的转移和侵袭[14-15]。我们的研究显示用IL-6处理HepG2细胞后,HepG2细胞间隙增宽,呈纺锤状或长梭形,细胞核颜色变深,诱导HepG2细胞向间质表型转变,这与吴畅等[9]的实验结果一致。Traswell侵袭实验证实经诱导的HepG2细胞侵袭能力明显增强;在蛋白及基因表达水平,我们发现,用IL-6处理HepG2细胞后,STAT3磷酸化水平升高,并使相关转录因子Twist蛋白及基因表达上调,EMT相关标志蛋白E-cadherin蛋白及基因表达下调,这与宋莹等[16]肝细胞生长因子诱导人肝癌细胞上皮间质转化作用机制研究结果相似。以上结果表明IL-6确实具有诱导HepG2细胞发生EMT的作用,且使HepG2细胞侵袭能力明显增强。
本实验进一步的研究显示将60Co处理的转hGMCSF基因HepG2疫苗与经50 ng/ml IL-6处理的实验细胞共培养24 h后,Traswell侵袭实验显示疫苗组较CON组、重组质粒组及空白对照组相比,其穿膜细胞数减少,提示转染后细胞侵袭能力下降;Western-blot实验显示疫苗组较CON组、重组质粒组及空白对照组E-cadherin蛋白表达升高,而p-Stat3、Twist蛋白表达下降,且RT-PCR实验显示疫苗组较另外三组E-cadherin mRNA表达上调、Twist mRNA表达下调,这与隋强君等[17]在阻断肝癌细胞STAT3信号通路激发机体抗肿瘤免疫应答作用机制研究结果相似。还有研究显示活化的STAT3 信号参与Twist、E-cadherin蛋白表达,调控EMT过程,并介导肝癌的侵袭与转移,p-STAT3/Twist/ E-cadherin 信号轴异常可能导致肝癌病人预后差[18-20]。相关研究证实Th1/Th2细胞的偏移在EMT中发挥重要作用[21,22]。本课题组前期已证实该疫苗能通过增加HepG2 细胞免疫原性,诱导Th1 漂移,促进PBMC增殖、分化,干扰Th2类细胞因子如lL-6等对CD4+T 细胞调节,增加INF-γ的分泌,提高其对HepG2 细胞的杀伤作用[8]。而我们的实验证实转hGM-CSF基因HepG2疫苗与IL-6共培养的HepG2细胞后p-Stat3、Twist蛋白表达下降,Twist mRNA表达下调,提示IL-6/ p-STAT3/Twist信号轴被抑制。因此我们认为HA转hGM-CSF的HepG2细胞疫苗可能通过增强免疫应答,诱导Th1漂移,阻断JAK/STAT3信号转导,下调Twist的表达,逆转IL-6诱导HepG2细胞EMT,抑制肝癌的侵袭和转移。
综上所述,IL-6能促进HepG2细胞向间质细胞表型转变,而转hGM-CSF的HepG2细胞疫苗可通过阻断JAK/STAT3信号通路逆转肝癌HepG2细胞EMT,为肝癌的免疫治疗提供新思路,但其具体机制还有待进一步研究。
[1] Zhang HJ, Yao DF, Yao M, et al. Expression characteristics and diagnostic value of annexin A2 in hepatocellular carcinoma[J]. World J Gastroenterol, 2012, 18(41): 5897 -5904.
[2] 习臻畅, 张坚松. LRG1基因在肝细胞癌中的表达情况研究[J]. 湖南师范大学学报(医学版), 2015(2): 24-27.
[3] Yamashita Y, Taketomi A, Shirabe K, et al. Outcomes of hepatic resection for huge hepatocellular carcinoma (≥10 cm in diameter)[J]. J Surg Oncol, 2011, 104(3): 292-298.
[4] Jiang J, Tang Y, Liang X. EMT: A new vision of hypoxia promoting cancer progression[J]. Cancer Biology & Therapy, 2011, 11(8): 714-23.
[5] Scheel C, Weinberg RA. Cancer stem cells and epithelialmesenchymal transition: concepts and molecular links[J]. Semin Cancer Biol, 2012, 22(5-6): 396-403.
[6] 侯嘉杰, 孙倍成. STAT3: 慢性炎症介导肿瘤发生和进展的关键节点[J]. 生物化学与生物物理进展, 2014, 41(1): 69-78.
[7] Nerstedt A, Johansson A, Andersson C X, et al. AMP-activated protein kinase inhibits IL-6-stimulated inflammatory response in human liver cells by suppressing phosphorylation of signal transducer and activator of transcription 3(STAT3)[J]. Diabetologia, 2010, 53(11): 2406-16.
[8] 苏小芳, 段晓明, 黄璐, 等. HA纳米载体转hGM-CSF基因的HepG2疫苗的抗肿瘤活性研究[J]. 现代生物医学进展, 2012, 12(10): 1824-1827.
[9] 吴畅, 刘海玲, 何琼琼, 等. IL-6调节Twist的表达对肝癌细胞BEL-7402上皮-间质转化的影响[J]. 临床与实验病理学杂志, 2013, 29(4): 351-355.
[10] 郭淦华, 段晓明, 刘晓宇, 等. 羟基磷灰石纳米颗粒载体介导hGMCSF基因转染HepG 2细胞及对其生长的影响[J]. 肿瘤, 2008, 28(3): 224-227.
[11] Chaffer C L, Brennan J P, Slavin J L, et al. Mesenchymal-to-epithelial transition facilitates bladder cancer metastasis: role of fibroblast growth factor receptor-2[J]. Cancer Research, 2006, 66(23): 11271-8.
[12] Lee T K, Poon R T, Yuen A P, et al. Regulation of angiogenesis by Id-1 through hypoxia-inducible factor-1alpha-mediated vascular endothelial growth factor up-regulation in hepatocellular carcinoma [J]. Clinical Cancer Research, 2006, 12(23): 6910-9.
[13] Alonso S R, Tracey L, Ortiz P, et al. A high-throughput study in melanoma identifies epithelial-mesenchymal transition as a major determinant of metastasis [J]. Cancer Research, 2007, 67(7): 3450-60.
[14] Su Y W, Xie T X, Sano D, et al. IL-6 stabilizes Twist and enhances tumor cell motility in head and neck cancer cells through activation of casein kinase 2 [J]. Plos One, 2011, 6(4): 604-607.
[15] Kida H, Ihara S, Kumanogoh A. Involvement of STAT3 in immune evasion during lung tumorigenesis [J]. Oncoimmunology, 2013, 2(1): e22653-e22653.
[16] 宋莹, 刘浩, 尹江, 等. 肝细胞生长因子诱导人肝癌细胞上皮间质转化[J]. 中国生物化学与分子生物学报, 2015(7): 716-722.
[17] 隋强君. 阻断肝癌细胞STAT3信号通路激发机体抗肿瘤免疫应答作用机制研究[D]. 山东大学, 2014.
[18] 朱皓皞. Twist基因在恶性肿瘤中的研究与进展[J]. 实用癌症杂志, 2012, 27(2): 215-217.
[19] Zhang C, Guo F, Xu G, et al. STAT3 cooperates with Twist to mediate epithelial-mesenchymal transition in human hepatocellular carcinoma cells [J]. Oncology Reports, 2015, 33(4): 1872-82.
[20] Liu Y, Fuchs J, Li C, et al. IL-6, a risk factor for hepatocellular carcinoma: FLLL32 inhibits IL-6-induced STAT3 phosphorylation in human hepatocellular cancer cells [J]. Cell Cycle, 2010, 9(17): 3423-3427.
[21] Diehl S, Anguita J, Hoffmeyer A, et al. Inhibition of Th1 differentiation by IL-6 is mediated by SOCS1 [J]. Immunity, 2000, 13(6): 805-15.
[22] 崔轶凡, 李旭京, 李培硕, 等. Th1/Th2细胞在EMT患者外周血中的表达及其意义[J]. 中国妇幼保健, 2010, 25(15): 2052-2053.
The effect of HepG2 tumor vaccine transfected hGM-CSF gene mediated by HA nanoparticles on inducing HepG2 cells epithelial-mesenchymal transition through IL-6
Zhu Quan-jie1, Duan Xiao-ming2, He Mi3, Liu Hai-tao4
(1. The Affiliated Changsha Hospital of Hunan Normal University, Changsha 410006, China; 2. Department of Gastroenterology, Fouth Hospital of Changsha, Changsha 410006, China; 3. Department of oncology, Xiangtan Central Hospital, Xiangtan 411100, China; 4. The Affiliated Changsha Hospital of Hunan Normal University, 410006, China)
ObjectiveTo investigate the mechanism of HepG2 tumor vaccine transfected hGM-CSF gene mediated by HA nanoparticles on inducing HepG2 cells epithelial-mesenchymal transition through interleukin-6(IL-6).MethodsHepG2 cells transfected with GM-CSF Gene after60Co irradiation vaccine were co-cultured with IL-6 stimulated HepG2 cells in vitro. The vaccine group and other group cells migration and invasion were detected by transwell chamber assays; the expression of E-cadherin, p-Stat3, Twist proteins was evaluated by Western blot; the expressions of EMT-associated genes: E-cadherin, Twist in HepG2 cells were analyzed with real-time fluorescence quantitative (q RT-PCR).Results①By pretreatment with IL-6, the ability of cell migration and invasion was significantly increased; IL-6 group cells passing through the reconstituted basement membrane higher than negative control group. ②The expression level of E-cadherin in IL-6 group was lower than that in negative control group, the expression of Twist and p-Stat3 protein was increased. ③Vaccine group cells passing through the reconstituted basement membrane less than other three groups. ④vaccine group than the other three groups of E-cadherin protein expression increased, whereas the expression of p-STAT3 and twist proteins decreased . ⑤In Vaccine group the expression of E-cadherin mRNA up-regulated compared with other groups, while Twist mRNA down-regulated.Conclusion①IL-6 has the ability to induce HepG2 cells to produce EMT. ②HepG2 cells transfected with GM-CSF Gene after60Co irradiation vaccine may reverse IL-6 induced HepG2 cell EMT by down-regulated the expression of transcription factor Twist and Stat3.
hepatoma carcinoma; GM-CSF gene; epithelial-mesenchymal transition; tumor vaccine; IL-6
R73-36+2;R735.7
A
1673-016X(2016)06-0004-04
2016-08-28
湖南省卫生厅科研基金资助项目(NO.2005-178)
段晓明,E-mail:xiaomingduan@21cn.com

