3D打印PLA-HA复合材料构建组织工程骨的实验研究
张海峰 杜子婧 毛曦媛 赵丹阳 杜朝 姜闻博 韩冬
200011, 上海交通大学医学院附属第九人民医院整复外科(张海峰、杜子婧、毛曦媛、赵丹阳、杜朝、韩冬);200011, 上海市骨科内置物重点实验室(张海峰);200240, 上海交通大学材料科学与工程学院(姜闻博)
·实验研究·
3D打印PLA-HA复合材料构建组织工程骨的实验研究
张海峰杜子婧毛曦媛赵丹阳杜朝姜闻博韩冬
200011,上海交通大学医学院附属第九人民医院整复外科(张海峰、杜子婧、毛曦媛、赵丹阳、杜朝、韩冬);200011,上海市骨科内置物重点实验室(张海峰);200240,上海交通大学材料科学与工程学院(姜闻博)
【摘要】目的探讨并观察3D打印聚乳酸(PLA)-羟基磷灰石(HA)复合支架材料在体内成骨的可行性。方法将骨髓基质细胞与3D打印PLA-HA复合材料进行体外复合培养,通过扫描电镜观察细胞在支架材料上的生长黏附情况。选择成年新西兰大白兔单侧胫骨内侧建立体内生物反应器模型,分离隐动、静脉血管束,并剥离胫骨内侧骨膜,将游离的动静脉血管束完全穿越支架材料内部并固定于胫骨骨膜囊内,此种方法构建的组织工程骨为实验组;单纯将复合骨髓基质细胞的3D打印PLA-HA复合材料回植于胫骨内侧骨膜囊内,此种方法构建的组织工程骨为对照组。术后6周取材,分别采用聚合酶链式反应(PCR)检测骨分化相关基因,并进行显微CT三维重建及骨形态计量分析、HE染色组织学观察。结果骨髓基质细胞能在3D打印PLA-HA复合材料上黏附生长。定量PCR检测成骨分化基因OPN及COLⅠ的表达,结果显示实验组OPN及COLⅠ相对表达量分别为8.0333±0.5820和7.5452±0.5608;对照组OPN及COLⅠ相对表达量分别为5.7248±0.9975和4.0173±0.2654,差异有统计学意义(P<0.05)。显微CT扫描显示,实验组新生骨组织体积及骨小梁相对数目较对照组高,且差异有统计学意义(P<0.05)。组织学观察可见实验组有新生骨组织形成,部分新生骨组织为编织骨,骨细胞体积大、数量多,呈编织状排列,骨细胞分化成熟;对照组可见部分新生骨样组织形成,骨细胞分化较成熟。结论以骨髓基质细胞为种子细胞,3D打印PLA-HA复合材料为支架,复合隐动、静脉血管束及自体骨膜,在体内能构建出功能相对完善的组织工程骨;3D打印PLA-HA复合材料可作为骨组织工程中支架材料。
【关键词】3D打印;体内生物反应器;骨组织工程;聚乳酸;羟基磷灰石
Experimental reserarch of constructing tissue engineered bone using three-dimensional printed polylactic acid-hydroxyapatite composite scaffoldsZHANGHai-feng1,2,DUZi-jing1,MAOXi-yuan1,ZHAODan-yang1,DUChao1,JIANGWen-bo3,HANDong1.
DepartmentofPlasticandReconstructiveSurgery,ShanghaiNinthPeople’sHospital,ShanghaiJiaotongUniversitySchoolofMedicine1,Shanghai200011,China;ShanghaiKeyLaboratoryofOrthopaedicImplants2,Shanghai200011,China;ShanghaiJiaotongUniversitySchoolofMaterialsScienceandEngineering3,Shanghai200240,China
Correspondingauthor:HANDongE-mail:handong12000@163.com
【Abstract】ObjectiveTo explore the feasibility of constructing the tissue engineered bone using three-dimensional (3D) printed polylactic acid-hydroxyapatite (PLA-HA) composite scaffolds. Methods Bone marrow stromal cells (BMSCs) were seeded on 3D printed PLA-HA composite scaffolds, then they were cultured in vitro. The BMSCs of growing morphology and adhesion were observed with the scanning electron microscopy. An animal model of vivo bioreactor on adult New Zealand rabbits inside the unilateral tibial was established. Then saphenous arteriovenous blood bundles were fully free and dissected, and the tibial upper periosteum was isolated. The vascular bundle crossed through the central channel of scaffolds and was fixed with a suture under the periosteum capsule. Using the above way to construct bioreactor in vivo was marked experimental group, and only 3D printed PLA-HA scaffolds combined with autologous BMSCs transplanted to tibial periosteum without blood vessel was designated as control group. In the postoperative 6 weeks, quantitative statistics of osteogenic related genes in real-time reverse transcription polymerase chain reaction (PCR) method, 3D reconstructions as well as bone morphology measurement and analysis in micro-Computed Tomography (micro-CT), histological examination stained with hematoxylin and eosin (HE) were evaluated, respectively. Results BMSCs had fine adhesion capability in 3D printed PLA-HA composite scaffolds. Osteopontin (OPN) and collagen type Ⅰ (COLⅠ) were expressed in both groups by PCR measurement. The relative levels of expression of OPN and COLⅠ in the experimental group were 8.0333±0.5820 and 7.5452±0.5608, and they were 5.7248±0.9975 and 4.0173±0.2654 in the control group. There existed significant differences between two groups (P<0.05). The outcomes from micro-CT analysis revealed that the amount of newly formed bone volume and bone trabecula in experimental group and it in control group had significant differences (P<0.05). Histological examination in experimental group showed that there were newly formed bone, and partial newborn bone arrayed into woven bone accompanied with the mature bone cell differentiation. In the control group, newly formed bone had the less mature cell differentiation. Conclusion This experimental study shows that the combination of BMSCs, 3D printed PLA-HA scaffolds, vascular pedicle implantation and autogenous periosteum to construct the bioreactor in vivo can achieve fully functional tissue engineered bone. Meanwhile, 3D printed PLA-HA composite scaffolds could be selected as biomaterials in bone tissue engineering.
【Key words】Three-dimensional printing; In vivo bioreactor; Bone tissue engineering; Polylactic acid; Hydroxyapatite
由创伤、肿瘤、感染和先天性畸形等原因造成的骨缺损,尤其是大块骨缺损的修复和功能重建一直是整复外科及骨科医生面临的难题。目前常用的自体骨移植、异体骨移植、异种骨移植、人工合成替代物移植等治疗方式在不同程度上存在一定问题[1-2]。近年来,体内生物反应器研究的不断深入以及3D打印技术的快速发展为解决个性化骨缺损修复提供了新方法[3-5],其中3D打印支架材料在体内生物反应器的成骨研究是骨组织工程中的重要部分。本研究采用体外细胞复合材料法及体内植入法研究3D打印的聚乳酸 (PLA)-羟基磷灰石(HA)复合材料在体内生物反应器这一特定环境中的成骨情况,目的是探索3D打印PLA-HA复合材料在骨组织工程领域中的成骨性能,为修复大块骨缺损奠定基础,同时也为材料改良提供实验依据。
1材料与方法
1.1实验动物与材料
实验动物:健康成年新西兰大耳白兔8只,雄性,体重(2.5±0.2)kg,由上海交通大学医学院实验动物中心提供。
材料:HA(上海积硕材料科技有限公司);PLA(山东济南岱罡生物工程有限公司);Dulbecco改良的Eagle培养基(DMEM 培养基,美国 Gibco公司);胎牛血清(美国 HyClone公司);HE染色试剂盒(南京建成生物制品有限公司);聚合酶链式反应(PCR)仪器(美国Applied Biosystems公司);光学显微镜(日本 OLYMPUS公司);显微摄影数码相机(美国 KODAK公司);扫描电镜(美国 Quanta公司);显微CT (瑞士SCANCO MEDICAL AG公司)。
1.2制备3D打印PLA-HA复合材料
先利用三维计算机辅助设计(CAD)软件设计支架材料。材料大小为直径5 mm、高度 6 mm的中空圆柱体,同时将材料属性设置为孔径500 μm、孔隙率60%。将设计完成的材料使用CAD软件转换成STL格式并输入3D打印机。调整3D打印机相关属性参数进行打印材料,本实验选用的3D打印技术是在熔融沉积造型术(FDM)基础上选用生物挤压方法进行打印生物复合材料PLA-HA[6-7]。最后,清除及修整多余的支撑材料,完成整个生物支架的打印(图1)。

图1 3D打印PLA-HA材料
1.3细胞体外复合培养
1.3.1骨髓基质细胞分离、培养与传代
选取健康成年新西兰大白兔,50 mL注射器针头于一侧胫骨平台穿刺抽取骨髓液2~3 mL,加入肝素化50 mL无菌离心管内。将骨髓与20 mL含10%胎牛血清和双抗DMEM培养基(青霉素100 U/mL、链霉素100 U/mL)混匀,接种于10 cm的培养皿中。置于37 ℃、5%CO2培养箱孵育。每隔3日半量换液,9 d后完全换液,以后每日换液1次。待原代培养细胞长满瓶底面积90%时,进行传代培养,按1∶3接种在新的10 cm细胞培养皿内。传至第三代进行细胞计数。
1.3.2支架材料与骨髓基质细胞体外复合培养
对传至第三代的细胞进行细胞计数,并以5×104个/mL制成细胞悬液于24孔板内接种至3D打印PLA-HA复合材料,于不同时间进行处理,用于观察及检测。
1.4建立体内实验模型
健康成年新西兰大白兔以质量百分比为3%的戊巴比妥钠(20 mg/kg)行耳缘静脉注射,用质量百分比为5%的氯胺酮(50 mg/kg)行肌肉注射麻醉,兔胫骨周边常规备皮,消毒铺巾。于双侧胫骨上端作一S形切口,长度约4.0 cm,根据实验设计仔细解剖相应隐动、静脉血管束,显微镜下充分游离远近端血管束(图2a),同时行隐动、静脉血管束远端结扎备用。在胫骨外侧弧形切开骨膜边缘,剥离胫骨内侧骨膜备用(图2b)。取复合骨髓基质细胞的PLA-HA支架材料置入骨膜下,并将骨膜塑成圆柱形,游离隐动、静脉血管束并从支架材料正中穿过,5-0显微缝线将骨膜游离缘密闭缝合,形成一密闭的腔室,构建体内生物反应器,再将骨膜与周围组织加强缝合固定,最后逐层关闭创口(图2c),此种方法构建的组织工程骨为实验组;动物对侧胫骨内侧行弧形切开骨膜边缘,分离大骨膜,将复合骨髓基质细胞的PLA-HA支架材料置入骨膜囊内,缝合骨膜及皮肤,此为对照组。术后肌肉注射青霉素80万单位/次,每日2次,持续3 d。术后第6周取材,进行检测。
1.5检测指标
1.5.1光学显微镜观察
每日使用倒置光学显微镜观察细胞生长情况及细胞与支架材料复合培养情况。
1.5.2扫描电镜观察
分别于各时间点将复合细胞培养的支架材料取出,2%戊二醛固定,梯度酒精脱水,乙酸异戊酯置换,临界点干燥,表面喷金后进行观察。
1.5.3一般情况及大体观察
术后观察新西兰大白兔饮食、饮水、活动及切口反应等情况。
1.5.4成骨分化相关基因检测

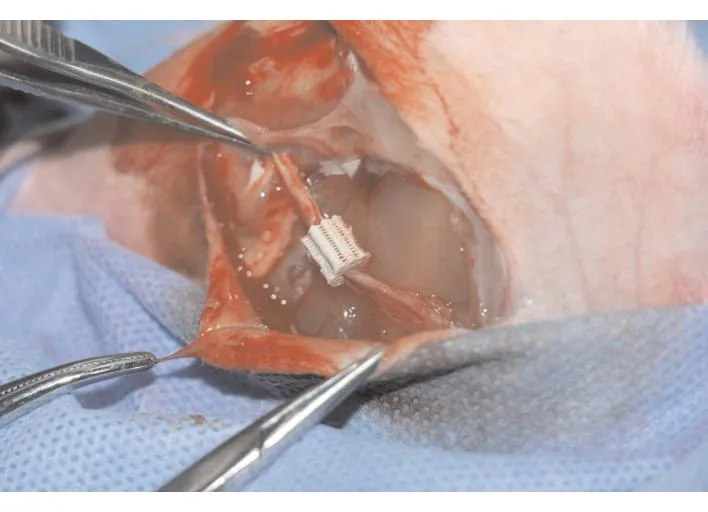
图2a分离新西兰兔隐动、静脉血管束,同时将血管贯穿材料内部

图2b 新西兰兔胫骨骨膜分离备用

图2c 体内生物反应器构建完成
1.5.5显微CT扫描
术后第6周处死动物,取胫骨内侧标本用4%甲醛溶液固定。待其固定48 h后,将所有标本连续显微CT扫描2 h,进行三维重建扫描并采用图像分析系统对其进行形态计量学分析。
1.5.6组织学观察
将胫骨内侧标本用4%甲醛溶液固定后,脱钙、石蜡包埋、切片,行HE染色,光学显微镜下进行形态学观察。
1.6统计方法
采用SPSS 16.0统计软件包进行分析。数据以均数±标准差表示,所测数据比较采用t检验,P<0.05 为有统计学意义。
2结果
2.1体外复合培养实验
2.1.1光学显微镜观察
原代培养骨髓基质细胞24 h后细胞开始贴壁,48 h后大量细胞贴壁,细胞呈短小梭形或多角形,排列不规则;培养1周左右,细胞生长迅速并互相融成集落,呈旋涡状排列(图3)。普通光学显微镜下可见细胞在材料孔隙内生长状态良好,部分细胞直接贴附于材料周边生长,未见细胞衰老及异常分裂现象。

图3 光学显微镜下观察骨髓基质细胞生长情况 (×40)
2.1.2扫描电镜观察
骨髓基质细胞于3D打印PLA-HA材料上复合培养第6天,扫描电镜下可见骨髓基质细胞紧密黏附于PLA-HA支架材料表面,细胞向支架材料孔隙四周伸出伪足,分泌的细胞外基质包绕于细胞周围,部分细胞间伪足相互接触融合(图4)。

图4扫描电镜下观察骨髓基质细胞在3D打印PLA-HA材料上的黏附情况(×600)
2.2体内植入实验
2.2.1大体观察
全部动物存活,无异常死亡。切口均干燥、无分泌物,未见明显感染。
2.2.2定量PCR检测结果
定量PCR检测结果显示,实验组和对照组在各时间段均有阳性表达;实验组成骨分化基因OPN及COLⅠ表达量较对照组高,且差异有统计学意义(P<0.05,表1)。
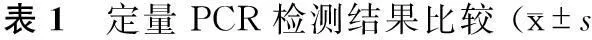
)
*与实验组比较,P<0.05
2.2.3显微CT三维重建结果
显微CT三维重建结果显示,实验组与对照组骨密度、组织微结构存有一定差异(图5a、b)。骨组织微结构参数显示,实验组新生骨组织体积(BV)、骨组织体积比(BV/TV)、骨小梁数目(Tb.N)、骨小梁分离度(Tb.Sp)均大于对照组,且差异具有统计学意义(P<0.05,表2)。

图5a 显微CT三维重建观察实验组新生骨情况

图5b 显微CT三维重建观察对照组新生骨情况
2.2.4组织学观察
实验组经HE染色可见有新生骨组织形成,骨陷窝细胞存在,骨小梁相互连接成网;部分新生骨组织为编织骨,骨细胞体积大,数量多,呈编织状排列;骨细胞分化成熟;新生骨组织内部及周边可见微小血管生成(图6a)。对照组经HE染色可见部分新生骨样组织形成,骨小梁较细,分离度增大,骨细胞分化较成熟(图6b)。
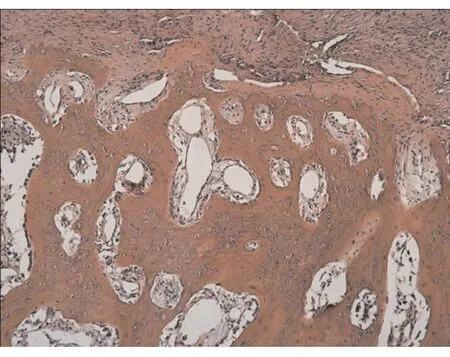
图6a 术后实验组组织学观察(×40)
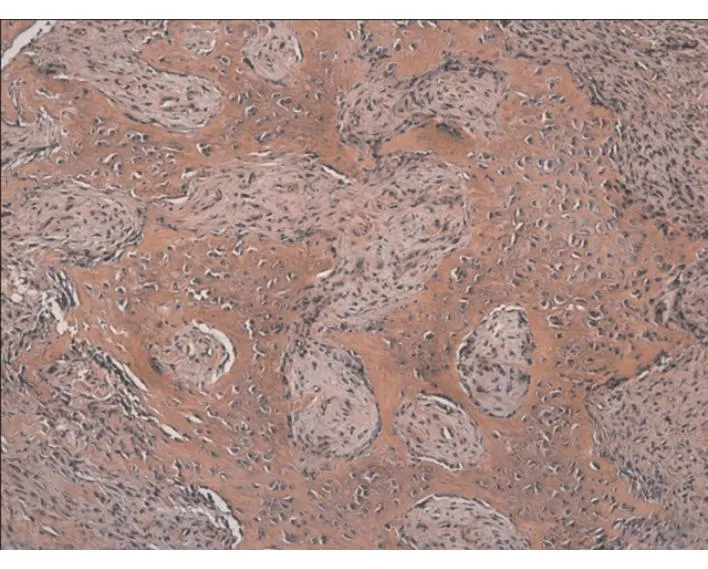
图6b 术后对照组组织学观察(×40)

组别BV/mm3BV/TV/%Tb.N/mm-1Tb.Sp/mm实验组4.7152±0.04460.2548±0.00012.0063±0.01210.5056±0.0565对照组3.7841±0.0606*0.2045±0.0020*1.8308±0.0550*0.4475±0.0779*
* 与实验组比较,P<0.05
3 讨论
3.13D打印技术概述
3D 打印也称增材制造技术,是一种以数字模型为基础,在计算机控制下,通过多层次连续叠加的方式最终堆积成完整实物的技术[8-9]。目前随着3D打印技术的逐步发展,其在医学领域的应用范围不断扩展,其中包括个性化组织缺损修复、复杂三维结构准确定位和三维重建、复杂手术方案制定及医疗教学等方面[10-13]。近年来,越来越多的个性化生物打印材料应用于人体疾病诊断与治疗,并取得满意的临床效果[14-15]。在3D打印技术的辅助下,在制备生物支架材料过程中可实现材料孔径、孔隙率、贯通性调控,同时具备精度高及可重复性好等优势,这为组织工程领域支架材料的研究提供新的思路和方法,同时也为临床上选择合适材料提供技术支持[16]。
3.23D打印PLA-HA复合材料的优势
PLA-HA复合材料是骨组织工程中常用的生物支架材料[17]。PLA是一种具备优良生物相容性、较高力学强度和生物降解性的聚合物,其强度和刚度同时也具有可衰减性,然而它的生物活性较弱[18-19]。HA具备良好的生物相容性和骨传导性,能为骨细胞黏附生长提供良好环境,有助于新骨的形成和生长,同时可提高材料韧性,满足一定的力学强度要求,但由于缺乏足够的强度和疲劳承受能力,不适合作为结构材料使用[20]。以PLA为基质、HA为生物加强相,通过3D打印技术制备的PLA-HA复合支架材料具有良好的生物相容性、合适的强度和韧性,是一种较理想的新型支架材料[21]。实验中所选取的3D打印PLA-HA复合材料的孔径为500 μm,孔隙率为60%,其材料结构可促进组织工程中新生骨及新生血管生成[22]。
3.3体内生物反应器的选择
近年来,骨组织工程的发展仍面临着新生骨组织难以修复大块骨缺损的问题。体内生物反应器能在一定程度上促进组织工程骨的生长,提高新生骨组织质量及数量,这为解决骨组织工程中的难题提供了良好的借鉴方法[23-24]。体内生物反应器是在体内创造一个特定的空间如骨膜下、肌肉、腹膜腔等,利用生物体自身潜能再生所需的组织结构来修复相应的组织缺损。研究[25-26]表明,为进一步促进新生骨的再生速度以满足大块骨缺损修复的需要,加入知名血管束作为构建组织工程骨血管来源是十分关键的步骤。许多研究[27]表明,骨膜内富含成骨细胞和骨祖细胞,具有较强的成骨能力,可再生与之功能相适应的骨组织结构。部分由骨膜所构成的体内生物反应器在促进新生骨再生方面具备难以比拟的优势[28]。而在机体可利用的血管束中,隐动、静脉血管束解剖位置恒定、表浅,也是非主要功能性血管,因此利用隐血管束作为组织工程骨血管的来源,既不会对机体运动功能造成损伤,又可满足在体内构建血管化组织工程骨的需要。前期研究[23-24]表明,利用隐动、静脉血管束构建的体内生物反应器能促进功能良好的新生骨组织生长。
3.4 实验结果分析
目前很多生物材料已在体内生物反应器内得到探索及应用,然而3D打印复合材料在体内生物反应器内的研究较少。研究特定环境中3D打印材料的成骨性能,能为3D打印PLA-HA复合材料在骨组织工程中的支架研究奠定实验基础。本研究中,体外实验发现骨髓基质细胞在3D打印PLA-HA复合材料上生长状态良好,可见此种材料具备优良的细胞相容性;体内研究表明实验组及对照组术后在一定时间内切口均未出现明显感染,同时均有新生骨组织出现,这在一定程度上表明支架材料在体内具备较好的组织相容性。为进一步研究3D打印PLA-HA复合材料在体内生物反应器内的成骨性能,实验中选取结果可靠的骨膜下构建组织工程骨为对照,在实验组中加入知名血管束构建体内生物反应器,结果提示其较对照组明显促进新生骨生长速度,这与体内生物反应器所提供的特定成骨微环境及血管促进成骨作用密不可分。实验结果表明,3D打印PLA-HA复合材料在具备良好生物相容性的基础上,能在体内生物反应器内促进新生骨生长,这为3D打印PLA-HA复合材料修复大块骨缺损奠定了实验基础。
由上可见,3D打印PLA-HA复合材料能在体内生物反应器内构建性能较好的组织工程骨,其可作为骨髓基质细胞载体进一步应用于骨组织工程相关研究中。然而,3D打印材料仍存在诸如3D打印材料后期成骨性能、降解速度及生物力学性能有待研究;改良其孔径及孔隙率能否进一步促进骨组织新生;植入体内的3D打印复合材料与新生血管的具体关系;随着3D打印技术第三阶段的到来,其能否实现与种子细胞的同步打印,促进组织工程新领域的扩展等问题。相信不久的将来,这些问题都会得到解决。
参考文献
[1]Smith BT, Shum J, Wong M, et al. Bone tissue engineering challenges in oral & maxillofacial surgery[J]. Adv Exp Med Biol, 2015, 881:57-78.
[2]Moshiri A, Oryan A, Shahrezaee M. An overview on bone tissue engineering and regenerative medicine: current challenges, future directions and strategies[J]. J Sports Med Doping Stud, 2015, 5(2):e144.
[3]姜雨晨,陈雁西. 3D 打印技术在足踝外科的应用价值[J]. 国际骨科学杂志, 2015, 36(1):15-17.
[4]王燎,戴尅戎. 骨科个体化治疗与3D打印技术[J]. 医用生物力学, 2014, 29(3):193-199.
[5]张海峰,韩冬. 体内生物反应器在骨组织工程血管化中的研究进展[J]. 中国修复重建外科杂志, 2014, 28(9):1173-1176.
[6]Jiang W, Shi J, Li W, et al. Morphology, wettability, and mechanical properties of polycaprolactone/hydroxyapatite composite scaffolds with interconnected pore structures fabricated by a mini-deposition system[J]. Polym Eng Sci, 2012, 52(11):2396-2402.
[7]Jiang W, Shi J, Li W, et al. Three dimensional melt-deposition of polycaprolactone/bio-derived hydroxyapatite composite into scaffold for bone repair[J]. J Biomater Sci Polym Ed, 2013, 24(5):539-550.
[8]Gibson I, Rosen D W, Stucker B. Additive Manufacturing Technologies[M]. New York: Springer, 2010:4-8.
[9]Bandyopadhyay A, Bose S, Das S. 3D printing of biomaterials. MRS Bull, 2015, 40:108-115.
[10]李翠笛,陈芳萍,王金武,等. 负载 rhBMP-2 钙磷硅基活性骨修复材料的 3D 打印构建及生物学性能研究[J]. 国际骨科学杂志, 2015, 36(3):187-193.
[11]潘伟,郝永强,严孟宁,等. 个体化数字导板结合3D打印技术在旋转铰链型人工膝关节置换术中的应用[J]. 国际骨科学杂志, 2015, 36(3):231-234.
[12]Zhao S, Zhang J, Zhu M, et al. Three-dimensional printed strontium-containing mesoporous bioactive glass scaffolds for repairing rat critical-sized calvarial defects[J]. Acta Biomater, 2015, 12:270-280.
[13]Mota C, Puppi D, Chiellini F, et al. Additive manufacturing techniques for the production of tissue engineering constructs[J]. J Tissue Eng Regen Med, 2015, 9(3):174-190.
[14]Chae MP, Rozen WM, McMenamin PG, et al. Emerging applications of bedside 3D printing in plastic surgery[J]. Front Surg, 2015, 2:25.
[15]Fan H, Fu J, Li X, et al. Implantation of customized 3-D printed titanium prosthesis in limb salvage surgery: a case series and review of the literature[J]. World J Surg Oncol, 2015, 13:308.
[16]Woodfield TB, Guggenheim M, von Rechenberg B, et al. Rapid prototyping of anatomically shaped, tissue-engineered implants for restoring congruent articulating surfaces in small joints[J]. Cell Prolif, 2009, 42(4):485-497.
[17]Abdal-hay A, Sheikh FA, Lim JK. Air jet spinning of hydroxyapatite/poly(lactic acid) hybrid nanocomposite membrane mats for bone tissue engineering[J]. Colloids Surf B Biointerfaces, 2013, 102:635-643.
[18]Rasal RM, Janorkar AV, Hirt DE. Poly (lactic acid) modifications[J]. Prog Polym Sci, 2010, 35(3):338-356.
[19]Suganuma J, Alexander H. Biological response of intramedullary bone to poly-L-lactic acid[J]. J Appl Biomater, 1993, 4(1):13-27.
[20]Dorozhkin SV. Bioceramics of calcium orthophosphates[J]. Biomaterials, 2010, 31(7):1465-1485.
[21]Barbieri D, Renard AJ, de Bruijn JD, et al. Heterotopic bone formation by nano-apatite containing poly(D,L-lactide) composites[J]. Eur Cell Mater, 2010, 19:252-261.
[22]Karageorgiou V, Kaplan D. Porosity of 3D biomaterial scaffolds and osteogenesis[J]. Biomaterials, 2005, 26(27):5474-5491.
[23]Han D, Guan X, Wang J, et al. Rabbit tibial periosteum and saphenous arteriovenous vascular bundle as an in vivo bioreactor to construct vascularized tissue-engineered bone: a feasibility study[J]. Artif Organs, 2014, 38(2):167-174.
[24]Han D, Dai K. Prefabrication of a vascularized bone graft with Beta tricalcium phosphate using an in vivo bioreactor[J]. Artif Organs, 2013, 37(10):884-893.
[25]王思明,阚娜,张磊. 异位预成中心性血管化人工骨的构建[J]. 中国组织工程研究, 2014, 18(33):5271-5275.
[26]Kokemueller H, Spalthoff S, Nolff M, et al. Prefabrication of vascularized bioartificial bone grafts in vivo for segmental mandibular reconstruction: experimental pilot study in sheep and first clinical application[J]. Int J Oral Maxillofac Surg, 2010, 39(4):379-387.
[27]Augustin G, Antabak A, Davila S. The periosteum. Part 1: anatomy, histology and molecular biology[J]. Injury, 2007, 38(10):1115-1130.
[28]Service RF. Tissue engineering. Technique uses body as ‘bioreactor’ to grow new bone[J]. Science, 2005, 309(5735):683.
(收稿::2015-11-16; 修回:2015-12-08)
(本文编辑:卢千语)
DOI:10.3969/j.issn.1673-7083.2016.01.013
通信作者:韩冬E-mail: handong12000@163.com
基金项目:国家自然科学基金(81272132)

