侧裂脑膜瘤切除术
张广柱 张洪钿 洪鹏 戴宜武 秦家振 赵春平
·教学视频·
侧裂脑膜瘤切除术
张广柱 张洪钿 洪鹏 戴宜武 秦家振 赵春平
一、背景知识
对于常见的颅内肿瘤,脑膜瘤的发生率仅次于胶质瘤。目前对于脑膜瘤,无论其良恶性,手术治疗为其首选治疗。对于如何选择手术入路,提高手术全切率,防止复发,需要对肿瘤的分布及大小等因素进行详细判断。特别是肿瘤基底的位置、可能的肿瘤供血动脉来源、是否侵袭附近的蛛网膜及脑结构。此外,脑膜瘤的体积越大、位置越深,相对与周围组织结构的关系越密切,切除的难度越大。
对于脑膜瘤的评估,术前可进行头颅MR增强T1相扫描,观察肿瘤的边界、具体大小、基底部来源和脑膜尾征。通过头颅MR T2相可粗略判断肿瘤的软硬程度,如相对高信号提示肿瘤质软,相对低信号提示肿瘤质硬,存在混杂信号则提示肿瘤软硬混杂。这对需要分块切除的脑膜瘤具有一定的手术预测和指导意义。通过头颅CT可观察脑膜瘤内的钙化情况,同样为肿瘤质地的判断。钙化多的肿瘤往往质地更硬。大部分情况下,可根据MR提示的血管流空影观察可能的脑膜瘤血供,当怀疑颅内或脑内较大或术中较难处理的血管对脑膜瘤供血时,可行全脑血管造影术,进一步明确判断,或术前栓塞,以减少术中出血。
脑膜瘤的切除根据不同的位置和大小,可考虑完整切除或分块切除。对于分块切除,可采用超声吸引装置超声刀或常规手术器械。必要情况下,可采用低频单极对质硬肿瘤进行直接切割。理论的完美情况是先截断肿瘤的血供,再进行肿瘤的切除。当然实际过程中,二者可能是同时进行的。
侧裂区的脑膜瘤意指位置位于侧裂,基底部可能位于硬脑膜或侧裂内软膜,可以由脑膜中动脉分支或侧裂内血管分支供血的肿瘤。因其位于侧裂,其手术具有一定的特殊性和风险。术中需要注意对侧裂内大脑中动脉分支 (M3和M4)及侧裂静脉的保护。当肿瘤体积较大时,肿瘤可部分延伸入额颞叶内,与蛛网膜和软脑膜的界限不易轻松解剖出来。建议采用显微镜仔细分离切除,避免损伤额上回、颞上回脑组织,对于左侧侧裂脑膜瘤尤其如此(图1)。

图1 侧裂脑膜瘤术前MR增强T1加权像
二、手术适应证
侧裂区域脑膜瘤,挤压侧裂、额叶、颞叶或岛叶。
三、手术要求
(1)定位准确,一般行额颞皮瓣;(2)暴露硬脑膜区域应大,保证脑膜尾征内硬脑膜均可被切除,以保证低的复发几率;(3)暴露侧裂内及皮层表面的动静脉血管,以充分保护脑组织;(4)沿解剖间隙进行肿瘤切除;(5)根据肿瘤大小,及术中翻起是否困难决定是否分块切除。
四、手术步骤
(1)患者取仰卧位,患侧肩部垫高15°,头偏向对侧60°,保持额颞部朝上,通过侧裂在头部的投影标记侧裂位置。并根据头颅MR增强T1结果,于皮瓣表面标记脑膜尾征范围,此范围比脑膜瘤基底范围更大,为预计的手术切除范围。部分情况下可根据手术中脑膜与肿瘤的接触紧密情况决定是否将肿瘤自硬脑膜中分离出来,并保留基底部分的硬脑膜。此需要根据术中进行确定;(2)常规消毒铺巾,根据肿瘤大小,取额颞问号型切口;(3)全层切开头皮,翻向前下;(4)颅骨钻孔后,铣刀游离骨瓣,并取下;(5)硬脑膜周边悬吊,避免硬膜外血肿形成;(6)硬脑膜局部可触摸到质韧的肿瘤,沿周边剪开硬脑膜,见肿瘤于硬脑膜之间可分层,钝性分离。并充分电凝肿瘤表面滋养小血管;(7)肿瘤体积大,决定分块切除,提起肿瘤,分离侧裂面,并切除约1/2肿瘤组织;(8)继续分离基底部后,再分离侧裂面,切除剩余1/2肿瘤组织,至此肿瘤全切;(9)术腔止血,敷以止血棉。硬脑膜使用自体筋膜进行修补;(10)颅骨钻眼,硬脑膜悬吊于骨瓣上。同时颅骨锁还那骨瓣;(11)逐层缝合颞肌、皮下及头皮。皮下留置引流管,并潜行3 cm后另口穿出。术毕(图2)。
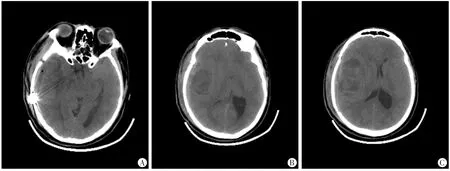
图2 侧裂脑膜瘤全切后术后复查头颅CT
五、注意事项
(1)该手术视频未切除脑膜尾征范围,若切除脑膜尾征范围,需要大面积人工硬脑膜修补。人工硬脑膜修补的弊端在于若发生难治性颅内感染,或者表述为反复发作的慢性颅内感染时,人工硬脑膜需取出。给患者带来不必要的再手术和经济负担。但有文献认为大范围切除及人工硬膜修补可降低复发率;(2)对于侧裂血管的保护,在允许的情况下,或粘连紧密的情况下,应在手术显微镜下进行分离。避免暴力分离。需要看清分离面,有时视角比较低,对显微镜的角度要求高;(3)如果进行保留硬脑膜的切除,则要避免对硬脑膜的过度电凝。
2016-10-19)
(本文编辑:张丽)
10.3877/cma.j.issn.2095-9141.2016.06.013
100700 北京,中国人民解放军陆军总医院附属八一脑科医院
赵春平,Email:13810000416@163.com
张广柱,张洪钿,洪鹏,等.侧裂脑膜瘤切除术[J/CD].中华神经创伤外科电子杂志,2016,2(6):373-374.

