多年生黑麦草对干旱-低温交叉适应的生理响应
梁小红,艾非凡,钟天秀,韩烈保*
(1.北京林业大学草坪研究所,北京 100083;2.华南农业大学林学与风景园林学院草业科学系,广东省草业工程技术研究中心,广东 广州 510642)
多年生黑麦草对干旱-低温交叉适应的生理响应
梁小红1,艾非凡1,钟天秀2,韩烈保1*
(1.北京林业大学草坪研究所,北京 100083;2.华南农业大学林学与风景园林学院草业科学系,广东省草业工程技术研究中心,广东 广州 510642)
摘要:草坪草在冬季的时候常常面临着干旱和低温的双重胁迫,严重影响着春季返青时草坪草的质量。为了探讨多年生黑麦草的干旱-低温胁迫交叉适应的生理机制,以多年生黑麦草“爱神特(Accent)”为植物材料,设置3个水分梯度,土壤相对含水量分别为30%(重度胁迫)、60%(中度胁迫)、100%(良好浇水)。处理5 d后在人工气候箱中进行低温处理(2℃)15 d。低温胁迫使多年生黑麦草的叶片相对含水量、叶绿素含量显著降低,电解质渗漏、脯氨酸、可溶性总糖、抗氧化酶的含量增加。3种水分处理条件下,经过中度干旱处理后的多年生黑麦草的叶片相对含水量、叶绿素含量的降低幅度减小,但脯氨酸、可溶性糖、抗氧化酶的含量增加显著。实验结果表明多年生黑麦草对干旱-低温胁迫具有交叉适应能力。适当地进行干旱处理有利于提高多年生黑麦草对低温胁迫的适应能力。但值得注意的是,严重的干旱处理会造成过度伤害,致使植株更快死亡。
关键词:多年生黑麦草;干旱;低温;交叉适应
多年生黑麦草(Loliumperenne)是禾本科早熟禾亚科黑麦草属的多年生疏丛型草本植物,是世界范围内一种优良的冷季型草种,在我国主要分布于华东、华中和西南等地[1]。因为其分蘖多、株型美观、成坪速度快,所以通常作为先锋草种用作庭院以及风景区的绿化。作为在暖季型草坪上的优秀交播草种之一,可以延长草坪绿期时间[2]。同时,多年生黑麦草茎叶柔嫩,适口性好,叶片产量大等优点,是草食家畜的优质牧草和养鱼的好饲料[3]。
同其他植物一样,多年生黑麦草可能遭受的逆境多种多样[4],目前对单一逆境(如干旱、高温、低温等)抗性生理研究较多[1],但对于多重逆境(如高温和干旱共同胁迫、低温与干旱共同胁迫等)研究较少。实际生产中,植物往往面临着多重胁迫。而且多重逆境对植物的伤害往往是致命的[5-6]。植物在遭受某种非致死性不良环境作用后(持续的或间歇的),不仅会增强抵抗这种特定环境的能力,而且能够产生抵抗其他不良环境的能力,称为植物的交叉适应[7]。动物中也存在交叉适应现象。在草坪管理中,干旱是较容易控制的条件,而干旱锻炼是否诱导多年生黑麦草对低温的交叉适应性是本文要解决的关键问题。本文通过控制土壤中的水分含量,研究低温下多年生黑麦草叶片相对含水量、叶绿素、渗透调节以及抗氧化酶响应情况,旨在讨论干旱-低温交叉适应的生理机制,为草坪管理中低温逆境伤害和节水过冬提供理论依据[8]。
1材料与方法
1.1材料培养
供试多年生黑麦草“爱神特(Accent)”种子购于百绿集团。于2012年2月至5月进行实验,实验前,用清水浸泡草种48 h,取饱满萌动的种子,控干水分后均匀播撒于直径为10 cm,高22 cm的柱形塑料花盆中。土壤配比为草炭∶沙土=1∶1。出苗前用塑料薄膜覆盖。待黑麦草长出2~3片叶时,每周进行一次修剪,定期补充Hoagland营养液和水分。待长至成熟期进行处理。
1.2材料处理
共设3个水分梯度。分别为土壤相对含水量为30%(重度胁迫)、60%(中度胁迫)、100%(良好浇水)。各处理均设4个重复。每日19:00采取称重法测定一次土壤水分含量,并且补充水分,精确控制水分,使其一直保持在设定的3个水分梯度左右。待处理第5 天时,将所有供试材料移至人工气候箱进行低温处理,低温条件为2℃,光照条件为300 μmol/(m2·s),10 h日照,此温度是根据近5年来深秋以及初冬季节华北地区的平均气温所设。各处理样本随机设置,继续控制土壤水分并处理15 d。每隔5 d 取样一次,由于实验时间较短,忽略植株增加对水分控制的影响。取样后立即用液氮冷冻,之后转于-80℃下保存备用。
1.3测定方法及指标
叶片相对含水量(RWC)采用烘干法[9]进行测定。叶绿素含量根据李合生[10]的方法进行测定,用95%的乙醇提取叶绿素。电导率渗漏测定参照Zhang 等[11]的方法。脯氨酸采用酸性茚三酮比色法进行测定[10]。可溶性总糖含量采用蒽酮乙酸乙酯比色法进行测定[10]。提取粗酶液之后,超氧化物歧化酶(superoxide dismutase, SOD)活性采用邻联二茴胺法[12]测定。过氧化氢酶(catalase, CAT)活性采用紫外吸收法进行测定[13]。过氧化物酶(peroxidase, POD)活性采用愈创木酚法[14]进行测定。抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性参考Nakano 和Asada[15]的方法进行测定。
1.4数据处理
所得数据采用SPSS 16.0 进行单因素方差分析(ANOVA),采用事后比较检验分析(post hoc test analysis),使用最小显著差异法(least significant difference, LSD)在0.05显著性水平进行差异显著性检验。图表采用SigmaPlot 10.0 进行绘制。
2结果与分析
2.1干旱处理对低温下多年生黑麦草相对含水量、叶绿素含量、电解质渗漏的影响
RWC的结果如图1所示,干旱处理不会造成RWC的下降,即使是在重度干旱的情况下不会造成多年生黑麦草叶片脱水(0 d)。低温处理15 d后,重度干旱和良好浇水下的多年生黑麦草其RWC降低至原来的55.3%和62.3%,而中度干旱下的RWC降低到0 d的78.1%。重度干旱下多年生黑麦草RWC降低幅度最多(44.7%)。重度干旱胁迫下,多年生黑麦草中RWC含量最低,同良好浇水条件下的多年生黑麦草一致,显著地低于中度干旱条件下的RWC。重度干旱胁迫和良好浇水下的RWC是中度干旱下的72.3%,80.7%。说明在低温胁迫下,土壤中的水分含量是造成多年生黑麦草叶片脱水的关键因素,而且中度干旱胁迫后,黑麦草提高了对低温胁迫的交叉适应能力。
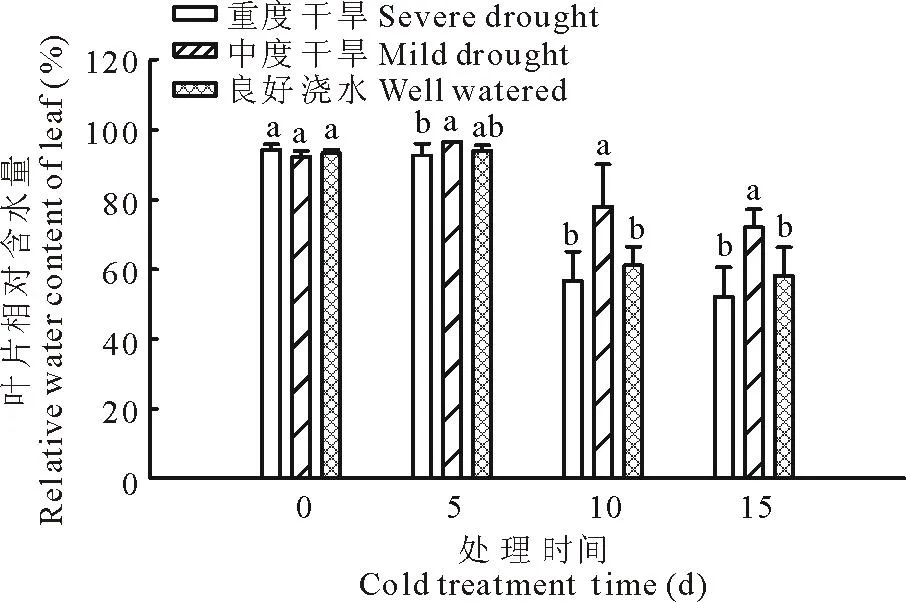
图1 干旱处理对低温下多年生黑麦草相对含水量(RWC)的影响Fig.1 Effect of drought on relative water content of perennialryegrass under low temperature
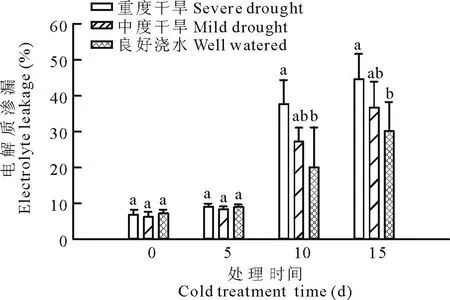
图2 干旱处理对低温下多年生黑麦草电解质渗漏(EL)的影响Fig.2 Effect of drought on electrolyte leakage of perennialryegrass under low temperature
图中数据为4次重复均值,竖线代表标准差。同一天数据间字母不同表示差异显著(P≤0.05)。 下同。The mean values and standard deviation (vertical bars) of four replicates are shown. Different lowercase letters represent significant differences between three treatments in a given day (P≤0.05). The same below.
在0 d,不同水分处理下EL没有显著差异(图2)。随着低温胁迫时间的延长,各个处理条件下的多年生黑麦草EL的含量不断增加。低温处理15 d后,重度干旱下多年生黑麦草EL的含量超过良好浇水下多年生黑麦草的48%;中度干旱下多年生黑麦草EL的含量超过良好浇水下多年生黑麦草的21.7%。与0 d比较,重度干旱下多年生黑麦草EL的含量上升了551.9%,中度干旱下EL含量上升了491.9%,而良好浇水条件下EL含量上升了317.2%。这说明,在低温胁迫下,适当降低土壤含水量能缓解多年生黑麦草的膜质伤害。
叶绿素是高等植物进行光合作用的重要物质,同时也是绿色植物的主要色素,主要有叶绿素A和叶绿素B两种[16]。在0 d时,3种处理情况下,叶绿素A的含量差异不显著,重度干旱下的多年生黑麦草叶绿素A的含量略微上升(图3)。中度干旱下叶绿素A的含量比良好浇水情况下略低。随着低温胁迫的时间延长,重度干旱条件下多年生黑麦草叶绿素A含量快速降低,而良好浇水和中度干旱叶绿素A含量降低相对缓慢。胁迫15 d后,重度干旱下多年生黑麦草叶绿素A降低了56.2%,而中度干旱和良好浇水分别降低了46.3%和40.3%(图 3A)。中度干旱下,多年生黑麦草中叶绿素A的含量显著低于良好浇水条件。叶绿素B含量变化趋势与叶绿素A相似,低温处理前也没有明显差异,但随着低温胁迫时间的延长而降低,低温胁迫15 d后,中度干旱条件下叶绿素B含量相对于中度干旱和良好浇水条件显著降低(图 3B)。叶绿素A与叶绿素B的含量之比约为3∶1[17]。总叶绿素含量也呈现出相似的规律,低温胁迫15 d时,重度干旱处理总叶绿素含量下降了59.0%,中度干旱处理总叶绿素含量下降了45.3%,良好浇水处理总叶绿素含量下降了42.1%。重度干旱下总叶绿素含量显著地低于中度干旱和良好浇水。这说明低温是导致光合减弱的主要因素,而重度干旱会加剧低温胁迫下叶绿素含量的降低。
2.2干旱处理对低温下多年生黑麦草渗透调节物质的影响
低温胁迫15 d,在各处理间脯氨酸含量呈上升趋势,脯氨酸含量从高到低依次是中度干旱、良好浇水、重度干旱(图4)。其中中度干旱处理下脯氨酸含量是第0天的1.71倍,而良好浇水和重度干旱处理,脯氨酸含量是第0天的1.25和1.09倍。中度干旱处理下脯氨酸含量显著高于重度干旱和良好浇水处理,分别是中度干旱的155.7%,是良好浇水条件下的136.2%。这说明中度干旱提高了多年生黑麦草在低温胁迫下积累渗透调节物质脯氨酸的能力。
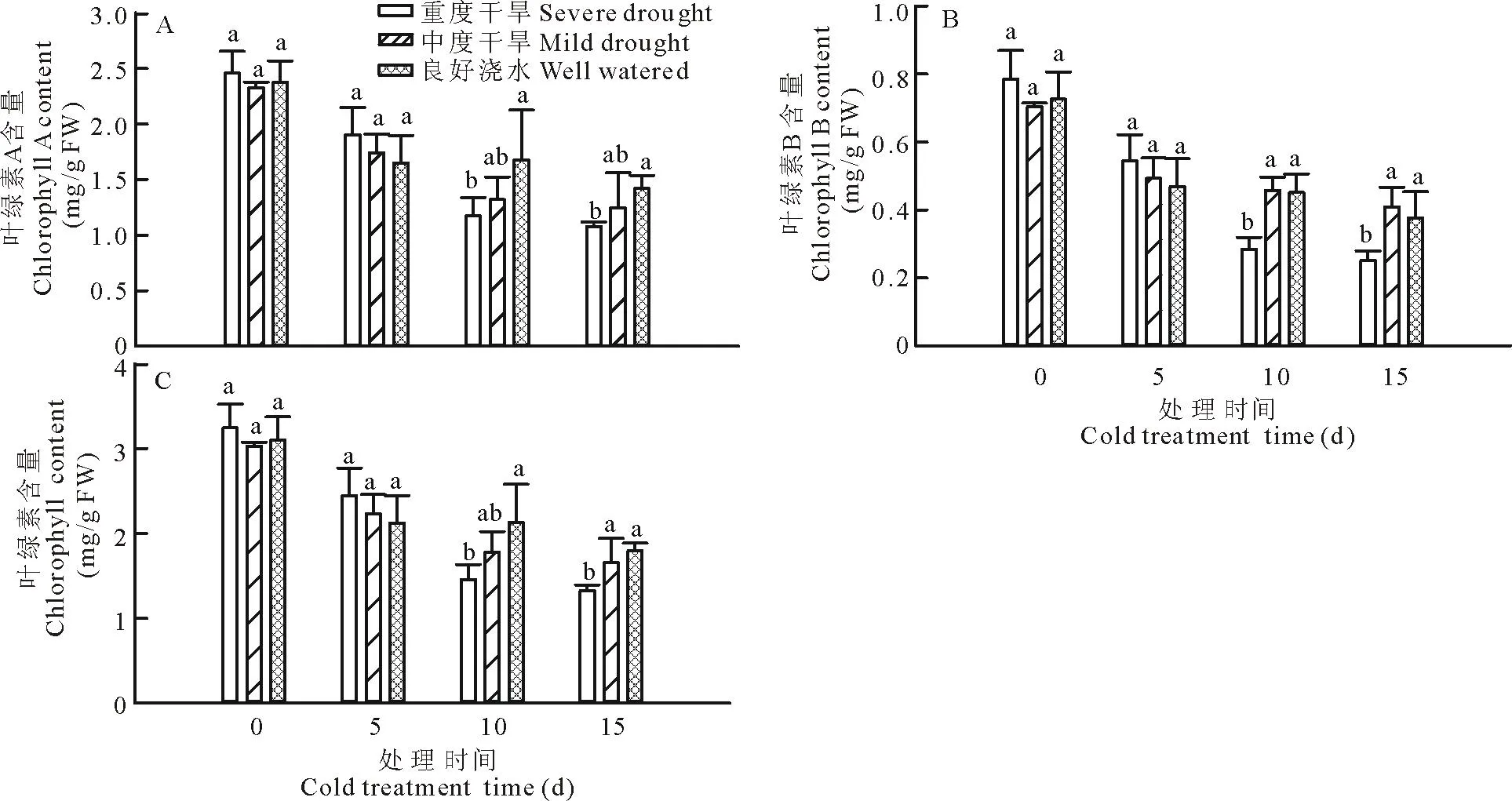
图3 干旱处理对低温下多年生黑麦草叶绿素含量的影响
水分处理未影响到可溶性总糖含量的变化。但是低温胁迫10 d后,可溶性总糖含量大量上升(图5)。重度干旱处理下、中度干旱处理下和良好浇水处理下,可溶性总糖含量分别比第0天的提高了215.66%,181.02%,196.03%。当低温胁迫15 d后,各水分处理之间差异显著,其中中度干旱处理可溶性总糖含量相比第0天提高了336.54%;而重度干旱和良好浇水相比之下分别提高了317.15%,298.25%。中度干旱条件下,可溶性糖含量最高,是重度干旱条件下的127%,是良好浇水条件下的116.7%。这说明低温胁迫是导致可溶性总糖含量大量升高的主要原因。
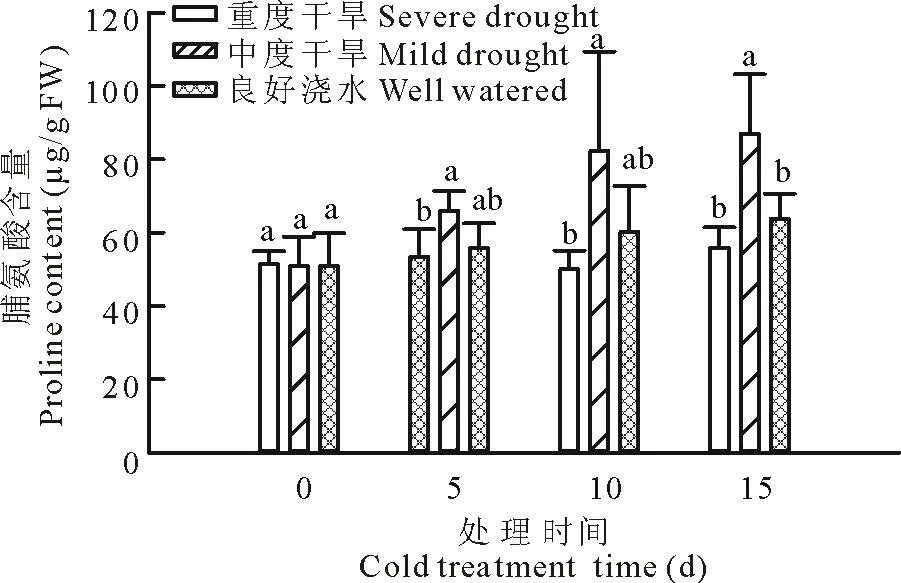
图4 干旱处理对低温下多年生黑麦草脯氨酸的影响Fig.4 Effect of drought on proline content of perennialryegrass under low temperature

图5 干旱处理对低温下多年生黑麦草可溶性总糖的影响Fig.5 Effect of drought on total soluble sugar content ofperennial ryegrass under low temperature
2.3干旱处理对低温下多年生黑麦草抗氧化酶的影响
APX、CAT、POD和SOD是抗氧化保护系统的重要酶,具有清除ROS,减缓氧化伤害的功能。低温胁迫5 d后,APX活性表现出下降的趋势,重度干旱处理下,APX较第0天下降了32.60%,而中度干旱和良好浇水情况下分别下降了23.96%和44.95%(图6A)。随着低温胁迫时间地延长,APX的活性随之上升。在低温胁迫15 d后,重度干旱处理下,APX活性是第0天的144.20%;中度干旱处理下,APX活性提高了82.29%;良好浇水处理下的APX活性提高了16.05%。中度干旱处理下的APX活性显著高于其他两种处理,分别是重度干旱下的128.4%,是良好浇水条件下的132.4%。这说明APX活性对低温胁迫非常敏感,在第5天,APX由于低温胁迫的剧烈刺激而下降,在逐渐适应低温胁迫后,APX的活性上升以抵御低温胁迫。

图6 干旱处理对低温下多年生黑麦草抗氧化酶的影响Fig.6 Effect of drought on antioxidant enzyme of perennial ryegrass under low temperature A:APX活性变化APX activity changes; B: CAT活性变化CAT activity changes; C: POD活性变化POD activity changes;D: SOD活性变化SOD activity changes.
CAT、POD和SOD的变化趋势比较一致,随着低温胁迫时间的延长活性逐渐上升。其中,低温胁迫15 d后,重度干旱和良好浇水处理下CAT活性差异不显著(图6B)。但是,都显著地低于中度干旱下CAT活性。中度干旱下CAT的活性比重度干旱下提高了52.09%,比在良好浇水处理下提高了23.08%。这说明在低温胁迫进行中度干旱处理有利于CAT的积累。低温胁迫15 d后,重度干旱处理下的POD活性是第0天的214.23%;中度干旱处理下的POD是第0天的244.43%;良好浇水处理下POD活性是第0天的168.31%(图6C)。中度干旱处理下的POD活性显著高于重度干旱处理和良好浇水处理。这表明低温下进行中度干旱处理更有利于提高多年生黑麦草的抗逆性。SOD的活性在低温胁迫15 d后,达到最高(图6D)。中度干旱处理下SOD活性最高,是重度干旱处理的142.32%,是良好浇水处理的154.67%。这说明低温胁迫能诱导SOD活性的增加,而中度干旱处理大大加强了这种诱导作用,中度干旱有利于多年生黑麦草叶片细胞来启动抗氧化酶保护机制来保护植物细胞免受氧化伤害。
3讨论
目前,关于干旱-低温交叉适应机理的报道不多。但是已有研究证明聚乙二醇(polyethylene glycol,PEG)预处理后的黄瓜(Cucumissativus)幼苗,对于低温胁迫有更强的抵御能力[8]。干旱处理后的小麦(Triticumaestivum)活性氧清除酶系统的活性明显增高[18],渗透调节能力也增强[19]。低温胁迫是一种特殊的水分胁迫[20],因为低温不但影响根系的吸水能力[21],而且使气孔失去控制导致蒸腾失常[22-23]。在低温胁迫下,多年生黑麦草出现明显的脱水症状,叶片相对含水量大幅下降,其中重度干旱下RWC降低幅度最多(44.7%),中度干旱处理下相对含水量最高。可见,适当的干旱处理可以诱导多年生黑麦草对低温的交叉适应性。
电解质渗漏常用于间接的评价草坪草的抗逆性[24-25]。低温处理15 d后,重度干旱下多年生黑麦草EL的含量超过良好浇水下多年生黑麦草的48%;而中度干旱下多年生黑麦草EL的含量超过良好浇水下多年生黑麦草的21.7%。说明,中度干旱胁迫能够缓解植物细胞的电解质渗透。为了防止电解质过多渗透,植物细胞会主动积累渗透调节物质来提高细胞内的渗透压, 提高细胞的保水能力[26]。在中度干旱胁迫处理下,多年生黑麦草比重度干旱处理和良好浇水处理下的多年生黑麦草能够积累更多的渗透调节物质,包括脯氨酸和可溶性总糖。其中,重度干旱下多年生黑麦草叶片积累的渗透调节物质最少,电解质渗透最高,从而导致叶片相对含水量最低。而中度干旱处理下的多年生黑麦草由于积累最多的脯氨酸和可溶性总糖,使得叶片含水量是3种处理中最高的。
逆境下,活性氧的增加会造成膜系统的伤害、细胞内结构和功能物质的破坏[27]。膜系统一旦崩溃,会造成细胞不可逆转的损伤,阻碍细胞内各种生命代谢活动的正常进行。植物细胞为了免受活性氧的伤害,进化出一套非常复杂的抗氧化酶系统来清除细胞内的活性氧,保护蛋白质。所有处理中,抗氧化酶系统中的CAT、APX、SOD、POD活性都随着胁迫时间的延长而增加,说明低温胁迫造成了O2-和H2O2的积累,因为SOD消耗O2-以减轻逆境的氧化胁迫[28-30],而APX、CAT、POD则是通过消耗H2O2来达到缓解氧化胁迫的目的[28-30]。中度干旱预处理使得低温胁迫下的多年生黑麦草CAT、APX、SOD、POD的活性都显著地高于重度干旱处理和良好浇水处理。这说明中度干旱胁迫能提高多年生黑麦草对低温胁迫的抵抗能力,从而减低低温造成的活性氧伤害,达到耐冷性增强的目的。植物细胞渗透调节物质和抗氧化酶的合成都依赖于细胞内的光合作用,而叶绿素是重要的光合色素,与植物细胞内碳水化合物的合成密切相关。叶绿素主要包括叶绿素A和叶绿素B两种,叶绿素A与叶绿素B的含量之比约为3∶1。中度干旱胁迫下多年生黑麦草总叶绿素含量下降了45.3%;重度干旱处理总叶绿素含量下降了59.0%,良好浇水处理总叶绿素含量下降了42.1%。这说明低温是导致光合减弱的主要因素,而中度干旱处理能部分缓解总叶绿素含量下降。
总的来说,多年生黑麦草对干旱-低温胁迫具有交叉适应能力。适当地进行干旱处理有利于提高多年生黑麦草对低温胁迫的适应能力。但是严重的干旱处理会造成过度伤害,致使植株更快死亡。因此,在北方地区,越冬前对多年生黑麦草进行适度干旱,不仅能够节约灌溉费用,而且还能增强多年生黑麦草对于低温的适应性,提高其越冬成活率。
References:
[1]Ma B Y. Research advances in stress physiological adaptation of perennial ryegrass. Journal of Biology, 2010, (2): 58-61.
[2]Wang W E, Bao M Z. Some problems about selecting overseeding ryegrass on bermudagrass turf as the method of establishing evergreen turf in transitional climatic zone. Pratacultural Science, 2005, (11): 110-113.
[3]Zhang L, Liu D Y, Shao T. The feeding value and utilization prospect ofLoliummultiflorum. Pratacultural Science, 2008, (4): 64-69.
[4]Li D Q, Tan R, Zhang J,etal. Construction and analysis of EST library in maize under co-stress of dought and salt and alkali. Jiangsu Journal of Agricultural Sciences, 2014, (1): 27-30.
[5]Mittler R, Merquiol E, Hallak-Herr E,etal. Living under a “dormant” canopy: a molecular acclimation mechanism of the desert plantRetamaraetam. The Plant Journal, 2001, 25(4): 407-416.
[6]Moffat A S. Plant genetics. Finding new ways to protect drought-stricken plants. Science, 2002, 296(5571): 1226-1229.
[7]Horowitz M, Assadi H. Heat acclimation-mediated cross-tolerance in cardioprotection: do HSP70 and HIF-1alpha play a role. Annals of the New York Academy of Sciences, 2010, 1188: 199-206.
[8]Dong X B, Bi H G, Liu Y X,etal. Relationship between cross adaptation to drought-low temperature and osmoregulation in cucumber seedlings. Scientia Agricultura Scinic, 2011, (2): 335-340.
[9]Dacosta M, Huang B. Changes in antioxidant enzyme activities and lipid peroxidation for bentgrass species in response to drought stress. Journal of the American Society for Horticultural Science, 2007, 132(3): 319-326.
[10]Li H S. Principle and Technology of Plant Physiological and Biochemical Experiments[M]. Beijing: Higher Education Press, 2000.
[11]Zhang X, Wang K, Ervin E H. Bermudagrass freezing tolerance associated with abscisic acid metabolism and dehydrin expression during cold acclimation. Journal of the American Society for Horticultural Science, 2008, 133(4): 542-550.
[12]Banowetz G M, Dierksen K P, Azevedo M D,etal. Microplate quantification of plant leaf superoxide dismutases. Analytical Biochemistry, 2004, 332(2): 314-320.
[13]Aebi H. Catalase in vitro. Methods in Enzymology, 1984, (105): 121-126.
[14]Kochhar S, Kochhar V K, Khanduja S D. Changes in the pattern of isoperoxidases during maturation of grape berries CV gulabi as affected by ethephon (2-Chloroethyl) phosphonic acid. American Journal of Enology and Viticulture, 1979, 3(4): 275-277.
[15]Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts. Plant Cell Physiology, 1981, 22(5): 867-880.
[16]Liu M J. Research on the Pigment Variety and the Molecule Mechanism in the Leaf Color Mutant in Mulberry (MorusalbaL.)[D]. Suzhou: Suzhou University, 2004.
[17]Wang X F. Study on Chlorophyll Content Determination and Application in Rapeseed[D]. Wuhan: Huazhong Agricultural University, 2008.
[18]Wu H J, Hu J J, Yang F,etal. Relationships between changes of active oxygen scavening system of wheat under drought and chilling cross-stress and cross-adaptation.Agricultural Research in the Arid Areas, 2007, (4): 207-211.
[19]Li J, Wu H J, Hu J J,etal. Relationship between changes of osmotic adjustment ability of wheat under drought and cold cross-stress and cross-adaptation. Agricultural Research in the Arid Areas, 2009, (6): 149-153.
[20]Zou G Y, Yang Z F, Li X L. Effect of potassium application on water regulation of maize plant under low temperature. Journal of China Agricultural University, 1999, (1): 21-25.
[21]Lambers H, Chapin F S I, Pons T. Plant Water Relations, Plant Physiological Ecology[M]. New York: Springer, 2008: 163-223.
[22]Eamus D. Further evidence in support of an interactive model in stomatal control. Journal of Experimental Botany, 1986, 37(5): 657-665.
[23]Guye M G, Wilson J M. The effects of chilling and chill-hardening temperatures on stomatal behaviour in a range of chill-sensitive species and cultivars. Plant Physiology and Biochemistry, 1987, 25(6): 717-721.
[24]Gusta L V, Butler J D, Rajashekar C,etal. Freezing resistance of perennial turfgrasses. HortScience, 1980, 15(4): 494-496.
[25]Rajashekar C, Tao D, Li P H. Freezing resistance and cold acclimation in turfgrasses. HortScience, 1983, 18(1): 91-93.
[26]Krapp A, Stitt M. An evaluation of direct and indirect mechanisms for the “sink-regulation” of photosynthesis in spinach: Changes in gas exchange, carbohydrates, metabolites, enzyme activities and steady-state transcript levels after cold-girdling source leaves. Planta, 1995, 195(3): 313-323.
[27]Li Z G, Li J H, Du C K,etal. Simultaneous measurement of five antioxidant enzyme activities using a single extraction system.Journal of Yunan Normal University, 2002, (6): 44-48.
[28]Apel K, Hirt H. Reactive oxygen species: Metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, 2004, 55: 373-399.
[29]An M Y, Sun S S, Puyang X H,etal. Effect of exogenous spermidine on salt tolerance in kentucky bluegrass seedlings under salinity stress. Acta Prataculturae Sinica, 2014, 23(6): 207-216.
[30]Huang Y M, Zhang Y X, Liu Q L,etal. Effects of salicylic acid on seed germination and seedling physiological characteristics ofZinniaelegansunder salt stress. Acta Prataculturae Sinica, 2015, 24(7): 97-105.
参考文献:
[1]马博英. 多年生黑麦草的逆境生理研究进展. 生物学杂志, 2010, (2): 58-61.
[2]王文恩,包满珠. 过渡地区采用狗牙根秋季交播黑麦草建植四季常绿草坪时应注意的几个问题. 草业科学, 2005, (11): 110-113.
[3]张磊, 刘东燕, 邵涛. 黑麦草的饲用价值及其应用前景. 草业科学, 2008, (4): 64-69.
[4]李德全, 谈蓉, 张洁, 等. 干旱和盐碱共胁迫下玉米EST文库的构建与分析. 江苏农业学报, 2014, (1): 27-30.
[8]董绪兵, 毕焕改, 刘业霞, 等. 黄瓜幼苗干旱-低温交叉适应与渗透调节的关系. 中国农业科学,2011, (2): 335-340.
[10]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[16]刘美娟. 桑树叶色突变体色素变化及其分子机理的研究[D]. 苏州: 苏州大学, 2004.
[17]汪雪芳. 油菜籽叶绿素测定方法研究及应用[D]. 武汉: 华中农业大学, 2008.
[18]武杭菊, 胡景江, 杨峰, 等. 干旱-低温交叉逆境下小麦活性氧清除系统的变化与交叉适应的关系. 干旱地区农业研究, 2007, (4): 207-211.
[19]李洁, 武杭菊, 胡景江, 等. 干旱-低温交叉逆境下小麦渗透调节能力的变化与交叉适应的关系. 干旱地区农业研究, 2009, (6): 149-153.
[20]邹国元, 杨志福, 李晓林. 低温下钾在植物水分调节中的作用. 中国农业大学学报, 1999, (1): 21-25.
[27]李忠光, 李江鸿, 杜朝昆, 等. 在单一提取系统中同时测定五种植物抗氧化酶. 云南师范大学学报(自然科学版), 2002, (6): 44-48.
[29]安勐颍, 孙珊珊, 濮阳雪华, 等. 外源亚精胺调控草地早熟禾幼苗耐盐性的研究. 草业学报, 2014, 23(6): 207-216.
[30]黄玉梅, 张杨雪, 刘庆林, 等. 水杨酸对盐胁迫下百日草种子萌发及幼苗生理特性的影响. 草业学报, 2015, 24(7): 97-105.
《草业学报》2015年承蒙以下专家审稿,特此表示感谢
(以姓氏拼音为序)
安渊包爱科毕玉芬曹成有查同刚柴琦陈兵林陈长青陈惠陈文俐
陈秀蓉陈远学陈智忠程积民程金花仇焕广邓祥征邓自发丁成龙丁国华
董宽虎董全民段廷玉多立安樊江文傅华高峰高洪文高灵旺高清竹
高学文郭继勋郭建斌郭旭生郭彦军郭振飞郭正刚海棠韩国栋韩红兵
韩烈保韩清芳杭苏琴郝敦元郝明德郝正里侯扶江侯向阳呼天明胡小文
胡自治黄季焜黄琳凯黄晓东江海东金樑孔垂华乐祥鹏李春杰李飞
李国旗李鸿雁李辉信李建龙李廷轩李彦忠李召虎李镇清李正国李志华
梁沛梁天刚林慧龙林晓飞刘公社刘建秀刘世亮刘文献刘星月刘玉民
刘志龙刘志鹏龙瑞军吕晓涛马啸马永清毛培胜毛胜勇孟林孟庆翔
慕平穆春生南志标牛建明潘远智庞保平彭燕蒲训强胜饶良懿
上官铁梁上官周平尚占环邵涛邵小明沈禹颖沈振西时磊史娟史莹华
司怀军宋小玲苏永中苏勇孙学刚孙彦孙志高唐祈林唐延林田江
田沛汪诗平王百群王成章王刚王虎成王静王俊王堃王三根
王锁民王晓娟王新宇王彦荣王赟文王正文王州飞吴鹏飞武菊英谢文刚
谢应忠辛国荣辛晓平邢福徐秉良徐世健薛立闫贵龙杨成德杨德龙
杨富裕杨惠敏杨永杨允菲杨志民杨中艺姚青姚拓姚霞姚艳敏
于应文于卓袁明龙袁庆华袁学军翟保平张吉宇张金林张金屯张巨明
张克云张万军张卫建张新全张堰铭张英俊赵哈林赵团结赵祥赵新全
赵志刚周道玮周洪旭朱清科庄 苏
*Cross adaptation under drought and low temperature stress in perennial ryegrass
LIANG Xiao-Hong1, AI Fei-Fan1, ZHONG Tian-Xiu2, HAN Lie-Bao1*
1.InstituteofTurfgrassScience,BeijingForestryUniversity,Beijing100083,China; 2.CollegeofForestryandLandscapeArchitecture,SouthChinaAgriculturalUniversity,GuangdongEngineeringResearchCenterofGrasslandSciences,Guangzhou510642,China
Abstract:Turfgrass suffers from both drought and cold stress in winter which degrades turf quality in the following spring. In order to investigate the physiological mechanism of cross adaptation to drought and low temperature stress in perennial ryegrass “Accent” turf ryegrass was subjected to three watering regimes (30%, 60% and 100% of requirements) for 5 days and then exposed to 2℃ temperatures day and night for 15 days. The results showed that low temperature stress decreased the relative water content (RWC) and chlorophyll (Chl) content but increased electrolyte leakage (EL), proline, soluble sugar and antioxidant enzymes. Mild drought stress before exposure to cold stress produced a significantly lower reduction in RWC and Chl content but increased osmotic adjustment and antioxidant enzymes. It was concluded that moderate drought prior to exposure to low temperatures helped perennial ryegrass adapt to low winter temperatures but severe drought caused considerable damage to plants.
Key words:perennial ryegrass; drought; low temperature; cross adaption
*通信作者Corresponding author. E-mail:hanliebao@163.com
作者简介:梁小红(1979-),女,满族,辽宁本溪人,实验师,硕士。E-mail:liang81511@163.com
基金项目:国家林业局“948”项目(2011-4-50),国家自然科学基金面上项目(31172255)和国家863计划(2013AA102607)资助。
*收稿日期:2015-05-04;改回日期:2015-09-30
DOI:10.11686/cyxb2015230
http://cyxb.lzu.edu.cn
梁小红, 艾非凡, 钟天秀, 韩烈保. 多年生黑麦草对干旱-低温交叉适应的生理响应. 草业学报, 2016, 25(1): 163-170.
LIANG Xiao-Hong, AI Fei-Fan, ZHONG Tian-Xiu, HAN Lie-Bao. Cross adaptation under drought and low temperature stress in perennial ryegrass. Acta Prataculturae Sinica, 2016, 25(1): 163-170.

