大孔树脂富集酸枣仁总黄酮工艺及其体外抗氧化性研究
赵 旭,张斯桐,刘春梅,颜廷旭,肖 锋,贾 英,*
(1.沈阳药科大学功能食品与葡萄酒学院,辽宁沈阳 110016;2.沈阳药科大学中药学院,辽宁沈阳 110016)
大孔树脂富集酸枣仁总黄酮工艺及其体外抗氧化性研究
赵 旭1,张斯桐1,刘春梅2,颜廷旭2,肖 锋1,贾 英1,*
(1.沈阳药科大学功能食品与葡萄酒学院,辽宁沈阳 110016;2.沈阳药科大学中药学院,辽宁沈阳 110016)
研究大孔吸附树脂富集纯化酸枣仁总黄酮的最佳条件,并进行了总黄酮体外抗氧化能力的测定。利用静态吸附和动态吸附实验对5种不同极性的大孔吸附树脂进行筛选,并对上样液质量浓度、上样量、洗脱剂体积分数、洗脱剂体积以及洗脱剂流速等条件分别进行考察。采用DPPH自由基和ABTS自由基的清除率以及铁氰化钾的还原能力作为指标考察纯化后总黄酮的体外抗氧化能力。结果表明AB-8大孔吸附树脂为纯化酸枣仁总黄酮的最佳树脂,纯化工艺为上样液质量浓度1.99 mg/mL,上样量50 mL,洗脱剂体积分数50%乙醇,洗脱剂体积50 mL,洗脱剂流速1 mL/min,纯化后总黄酮的回收率为77.0%,纯度为51.4%。抗氧化结果显示总黄酮对DPPH和ABTS自由基具有明显的清除能力(IC50值为0.70 mg/mL和0.15 mg/mL),并对铁氰化钾表现出了较强的还原能力。
酸枣仁,总黄酮,大孔吸附树脂,体外抗氧化能力
酸枣仁为鼠李科植物酸枣[ZiziphusjujubaMill.var. spinosa(Bunge)Hu ex H. F. Chou]的干燥成熟种子,味甘、酸,性平,归肝、胆、心经。具有养心补肝、宁心安神、敛汗、生津之功效,用于虚烦不眠、惊悸多梦、体虚多汗和津伤口渴等症状[1]。现代药理学发现,酸枣仁在镇静催眠、改善学习记忆、抗抑郁、抗焦虑以及抗炎等方面都有较多的应用[2]。酸枣仁富含脂肪油,其他成分有酸枣仁皂苷、黄酮、维生素C、氨基酸和微量元素,其中药用的物质基础研究较广的是皂苷类和黄酮类成分[3]。
黄酮类化合物分布广泛,具有多种生物活性:如心血管系统活性、抗氧化自由基、抗衰老、提高机体免疫力等。黄酮类物质的纯化主要有大孔树脂[4-5]、聚酰胺柱色谱法[6]、超声辅助[7]以及高效液相色谱法。其中大孔吸附树脂因其选择性好、吸附速度快、吸附量大、机械强度高、稳定性强、再生处理简便等特点,在天然产物活性成分的分离纯化中应用较多[8-9],适合于中药材中总黄酮的富集。关于酸枣仁中总黄酮的纯化方法,王勇[10]等报道了采用6种大孔树脂进行富集的工艺,然而,有关酸枣仁高纯度总黄酮的抗氧化活性鲜有报道。本研究拟采用与先前报道不同的5种大孔吸附树脂对酸枣仁总黄酮进行富集纯化,利用静态吸附和动态吸附相结合的方法[11],筛选最佳大孔吸附树脂,优化纯化条件并进行验证,得到的高纯度总黄酮采用·DPPH、ABTS+·和Fe3+三种模型对其进行体外抗氧化评价,为酸枣仁体内外活性的深入研究提供理论依据。
1 材料与方法
1.1 材料与仪器
酸枣仁药材 沈阳市同仁堂药房,批号:1401001,经沈阳药科大学贾英教授鉴定,均为正品,密封存放于阴凉干燥处;DPPH、ABTS、芦丁对照品 大连美仑科技有限公司,纯度98%;5种大孔吸附树脂(HPD100、NKA、DM130、AB-8、HP20) 河北省沧州宝恩吸附材料科技有限公司;亚硝酸钠(NaNO2)、氢氧化钠(NaOH)、硝酸铝[Al(NO3)3]、抗坏血酸(VC)、硫酸亚铁(FeSO4)、过硫酸钾(K2S2O8)、铁氰化钾[K3Fe(CN)6]山东禹王化学试剂有限公司。
HH-4型数显电热恒温水浴锅 国华电器有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;SHA-CA型水浴恒温振荡器 金坛市宏华仪器厂;Varioskan Flash酶标仪 赛默飞世尔科技公司;UV-1700紫外可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 总黄酮含量测定 取经120 ℃恒温干燥至恒重的芦丁对照品约10.0 mg,精密称定,置于50 mL量瓶中,加入适量的无水乙醇,超声至溶解后放冷,以无水乙醇稀释定容,摇匀,即得0.200 mg/mL芦丁对照品溶液。精密量取对照品溶液0、1、2、3、4、5、6 mL分别置于25 mL量瓶中,不足6 mL的加蒸馏水补足,加5%亚硝酸钠溶液1 mL,摇匀,放置6 min,加氢氧化钠试液10 mL,加水至刻度,摇匀,放置15 min。以空白试剂作为参比试液,在510 nm波长处测定吸光度A,以芦丁浓度为横坐标,吸光度为纵坐标,绘制标准曲线。其线性回归方程为A=7.860C+0.014(r=0.9994)。
1.2.2 供试品的制备 酸枣仁干燥果实1.6 kg,粉碎,60%乙醇作为提取溶剂,液料比为10∶1,加热回流提取3次,每次2 h,合并滤液并减压浓缩,得酸枣仁总提物浸膏共330.2 g。称取浸膏225 g用3000 mL蒸馏水溶解,5000 r/min离心,取上清得供试品溶液。量取定量供试品溶液于25 mL量瓶中,按照1.2.1方法处理样品并在510 nm波长处测定吸光度,由线性回归方程求得供试品中总黄酮浓度。
1.2.3 大孔吸附树脂的筛选
1.2.3.1 大孔吸附树脂的预处理 称取适量吸附树脂HPD100、NKA、DM130、AB-8、HP20,用95%乙醇浸泡24 h,充分溶胀后,用95%乙醇淋洗至洗出液加适量蒸馏水无白色浑浊为止,用大量蒸馏水淋洗至无醇味,用滤纸吸去树脂表面水分,备用。
1.2.3.2 静态吸附实验 分别取预处理过的5种吸附树脂各2 g于100 mL具塞锥形瓶中,分别加入供试品溶液50 mL,密封后置于恒速振荡器振荡吸附24 h。取吸附后的上清液,测其吸光度并根据线性回归方程计算总黄酮浓度,并按式(1)计算5种吸附树脂的静态吸附率。将吸附后的树脂用滤纸吸干表面残留液,置于100 mL具塞锥形瓶中,各加入50%乙醇30 mL,密封后置于恒速振荡器振荡6 h,取解吸后上清液,测其吸光度并计算总黄酮浓度,并按式(2)计算5种吸附树脂的静态解吸率。最后按式(3)计算总黄酮的回收率。
吸附率(%)=(吸附前总黄酮质量浓度-吸附后总黄酮质量浓度)/吸附前总黄酮质量浓度×100
式(1)
解吸率(%)=解吸附后总黄酮质量浓度/(吸附前总黄酮质量浓度-吸附后总黄酮质量浓度)×100
式(2)
富集总黄酮回收率(%)=吸附率×解吸率×100
式(3)
1.2.3.3 动态吸附实验 分别取预处理过的5种吸附树脂各5 g,湿法装柱,量取供试品溶液50 mL于柱顶加入,以1 mL/min的加入流速进行动态吸附,预吸附50 min,过柱液重吸附1次后加到柱里放置过夜后,加5 BV蒸馏水以2 BV/h的流速进行洗脱,与过柱液混合定容,作为吸附后溶液。用50 mL 50%乙醇以2 BV/h的流速洗并定容,测定吸光度并计算黄酮含量,同时按式(1)~式(3)计算5种吸附树脂的吸附率及解吸率。
1.2.4 黄酮纯化工艺的优选
1.2.4.1 上样液质量浓度的考察 称取预处理的AB-8大孔吸附树脂5份,每份5 g,湿法装柱。将总黄酮浓度为0.249、0.498、0.995、1.99、2.388 mg/mL的上样液各50 mL于柱顶加入,以1 mg/mL的加入流速通过柱体,充分饱和后测定过柱液中总黄酮含量并计算该大孔吸附树脂的吸附率。
1.2.4.2 上样量的考察 称取预处理的AB-8大孔吸附树脂5 g,湿法装柱。量取100 mL总黄酮浓度为1.99 mg/mL的供试品溶液,以1 mg/mL的加入流速进行动态吸附,收集流出液,每5 mL收集一份,共收集20份,标号1~20,测定20份流出液的总黄酮含量。
1.2.4.3 洗脱剂体积分数的考察 称取预处理的AB-8大孔吸附树脂4份,每份5 g,湿法装柱。分别量取50 mL总黄酮浓度为1.99 mg/mL的供试品溶液进行动态吸附,吸附完全后,用适量蒸馏水冲洗,再分别用30%、50%、70%、95%的乙醇洗脱,收集各洗脱液至50 mL,测定总黄酮含量。
1.2.4.4 洗脱剂用量的考察 称取预处理的AB-8大孔吸附树脂5 g,湿法装柱。量取50 mL总黄酮浓度为1.99 mg/mL的供试品溶液进行动态吸附,吸附完全后,用适量蒸馏水冲洗,用100 mL 50%乙醇以1 mL/min的流速进行洗脱,每7 mL(1 BV)洗脱液收集一份,共10份,标号1~10,测定10份洗脱液的总黄酮含量。
1.2.4.5 洗脱流速的考察 称取预处理的AB-8大孔吸附树脂4份,每份5 g,湿法装柱。量取50 mL总黄酮浓度为1.99 mg/mL的供试品溶液进行动态吸附,吸附完全后,用适量蒸馏水冲洗,用50 mL 50%乙醇分别以0.5、1、2、4 mL/min的流速进行洗脱,测定洗脱液总黄酮的含量。
1.2.4.6 验证实验 称取预处理的AB-8大孔吸附树脂3份,每份5 g,湿法装柱。量取50 mL总黄酮浓度为1.99 mg/mL的供试品溶液进行动态吸附,吸附完全后,用适量蒸馏水冲洗,按照上述优选条件进行洗脱,收集洗脱液,蒸干后测定浸膏质量,计算总黄酮回收率及纯度。
1.2.5 酸枣仁总黄酮体外抗氧化活性考察
1.2.5.1 供试品溶液和对照品溶液的制备 将大孔吸附树脂所得的酸枣仁总黄酮样品无水乙醇溶解后配制成0.05、0.1、0.2、0.5、1、2、2.5 mg/mL的系列浓度溶液,作为供试品溶液。以VC为阳性对照,以相同的方法配制成0.05~2.5 mg/mL的系列浓度溶液,作为对照品溶液,4 ℃储存备用。
1.2.5.2 清除DPPH自由基能力 取DPPH约8.0 mg,精密称定,无水乙醇溶解后于100 mL量瓶中定容,得到浓度为2×10-4mol/L的DPPH乙醇溶液。向2.5 mL DPPH溶液中加入0.4 mL供试品溶液,摇匀于室温下放置30 min,于酶标仪中测定其在517 nm下吸光值Ai;以0.4 mL无水乙醇代替供试品溶液测得空白吸光度A0;以2.5 mL无水乙醇代替DPPH溶液测得样品本底吸光度Aj;每个浓度做3个平行样品,取其平均值,以VC做阳性对照,按式(4)计算供试品溶液对DPPH的抑制率清除率,并计算出IC50值[12]。
自由基抑制率SA(%)=[1-(Ai-Aj)/A0]×100
式(4)
1.2.5.3 清除ABTS自由基能力 ABTS与过硫酸钾反应生成稳定的蓝绿色阳离子自由基ABTS+·,在734 nm处具有最大吸收峰。精密移取7 mmol/L的ABTS水溶液10 mL和2.45 mmol/L的过硫酸钾10 mL,混合,在室温、避光的条件下静置过夜(12~16 h),形成ABTS自由基储备液,测定前用95%乙醇稀释,使吸光度在0.70±0.02内。反应体系中加入0.1 mL的样品溶液和5 mL ABTS溶液,充分混合后室温放置6 min,在734 nm下测其吸光度Ai;以0.1 mL无水乙醇代替样品溶液测得空白吸光度A0;以5 mL无水乙醇代替ABTS溶液测得样品本底吸光度Aj;每个浓度做3个平行样品,取其平均值,以VC做阳性对照,按式(4)计算样品对ABTS自由基的抑制率,并计算出IC50值[13]。
1.2.5.4 铁氰化钾还原能力 反应体系中依次加入1.0 mL不同浓度的样品溶液,1.0 mL的磷酸盐缓冲液(0.2 mol/L,pH=6.6)和1.0 mL 1%的K3Fe(CN)6溶液,在45℃下水浴反应20 min后迅速冷却,然后加入1.0 mL 10%的CCl3COOH溶液。取上述反应液2 mL,加入2 mL蒸馏水和0.1%的FeCl3溶液0.5 mL,摇匀,10 min后在695 nm下测定其吸光值,以VC做阳性对照,每个浓度做3个平行样品,取其平均值[14]。
1.3 数据处理
2 结果与分析
2.1 静态吸附实验
5种大孔树脂对酸枣仁总黄酮的静态吸附和解吸能力有所不同,这与大孔树脂的极性、平均孔径和比表面积有关。结果见表1,其中弱极性的AB-8型树脂对总黄酮的吸附率与解吸率都更具优势,说明酸枣仁总黄酮极性较小。进一步将通过动态吸附实验进行验证并确定最佳大孔树脂进行酸枣仁总黄酮的富集。
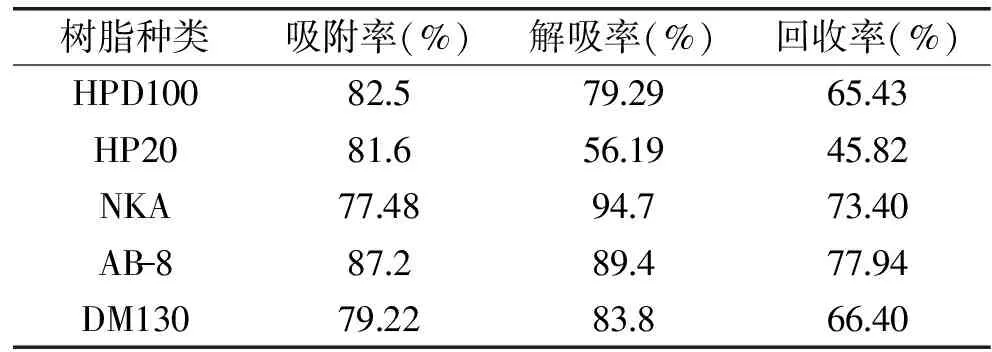
表1 大孔树脂对酸枣仁总黄酮的静态吸附与解吸附性能
2.2 动态吸附实验
结果如表2所示,AB-8大孔树脂在动态吸附实验中吸附率与解吸率均更优。综合静态和动态吸附实验结果,确定AB-8作为酸枣仁总黄酮的最佳吸附树脂。
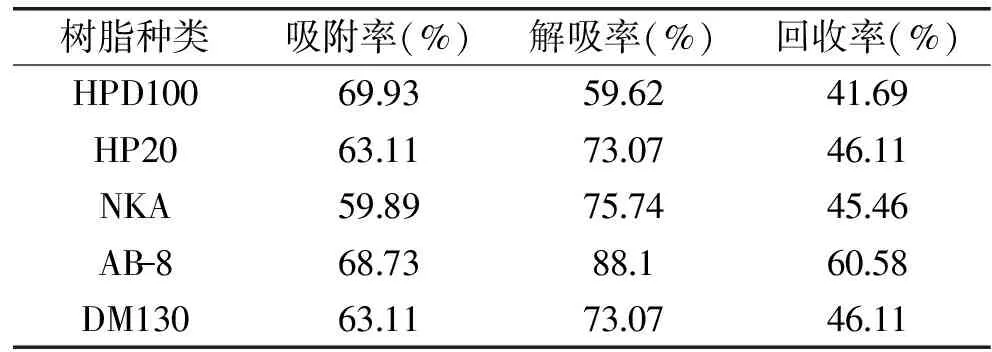
表2 大孔树脂对酸枣仁总黄酮的动态吸附与解吸附性能
2.3 黄酮纯化工艺的优选
2.3.1 上样液质量浓度的考察 结果如图1所示,上样液质量浓度在0.249~1.99 mg/mL时,吸附率迅速增加,质量浓度在1.99 mg/mL时吸附率达最大值,并随着浓度的进一步增加而略有降低。考虑到上样质量浓度过高时,容易发生絮凝和沉淀,堵塞树脂柱。故确定1.99 mg/mL为该树脂的最佳上样质量浓度。
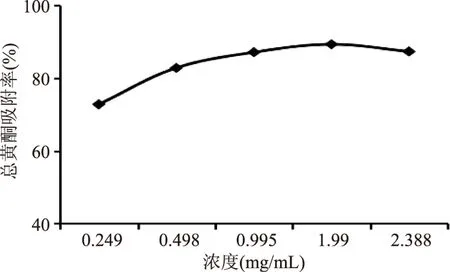
图1 上样液浓度的考察Fig.1 Study on the sample concentration
2.3.2 上样量的考察 结果如图2所示,当收集到第10份流出液时,流出液中总黄酮开始出现大量的泄漏,由此可以看出,当上样量为50 mL时,树脂吸附达到饱和。

图2 泄漏曲线Fig.2 Leak curve
2.3.3 洗脱剂体积分数的考察 总黄酮洗脱率分别为49.65%、70.57%、71.36%、73.28%,表明当乙醇体积分数为90%时,洗脱效果最好,但与用50%和70%的乙醇洗脱,解吸率相差不大,且乙醇体积分数高易挥发,从经济、节约成本方面考虑,采用50%乙醇洗脱。
2.3.4 洗脱剂用量的考察 结果如图3所示,在洗脱剂体积为7个保留体积时,总黄酮基本洗脱完全,因此,选择50 mL作为洗脱剂体积。

图3 洗脱剂用量的考察Fig.3 Study on the volume of eluant
2.3.5 洗脱流速的考察 随着洗脱流速的增加,总黄酮洗脱率分别为75.27%、74.66%、69.27%、68.29%。由此可以看出,洗脱流速越大,洗脱率越低,但是流速为1 mL/min和0.5 mL/min相差甚少,而且0.5 mL/min的流速耗时太长,因此选择1 mL/min作为洗脱流速。
2.3.6 验证实验 经纯化后总黄酮回收率为76.37%±0.79%,纯度为51.40%±0.86%,纯度较纯化前(3.814%)提高了10倍以上,表明经AB-8型大孔树脂处理后,总黄酮纯度大大提高,且该工艺具有良好的重复性。
2.4 酸枣仁总黄酮体外抗氧化活性研究
2.4.1 清除DPPH自由基能力 DPPH自由基有单电子,在517 nm处有一强吸收,当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,从而可用吸光度进行快速的定量分析。结果如图4所示,酸枣仁总黄酮浓度在0.05~2.5 mg/mL范围内DPPH自由基抑制率随着浓度的升高而升高,在2 mg/mL时达到91.3%,接近VC水平。酸枣仁总黄酮的IC50值为0.70 mg/mL。
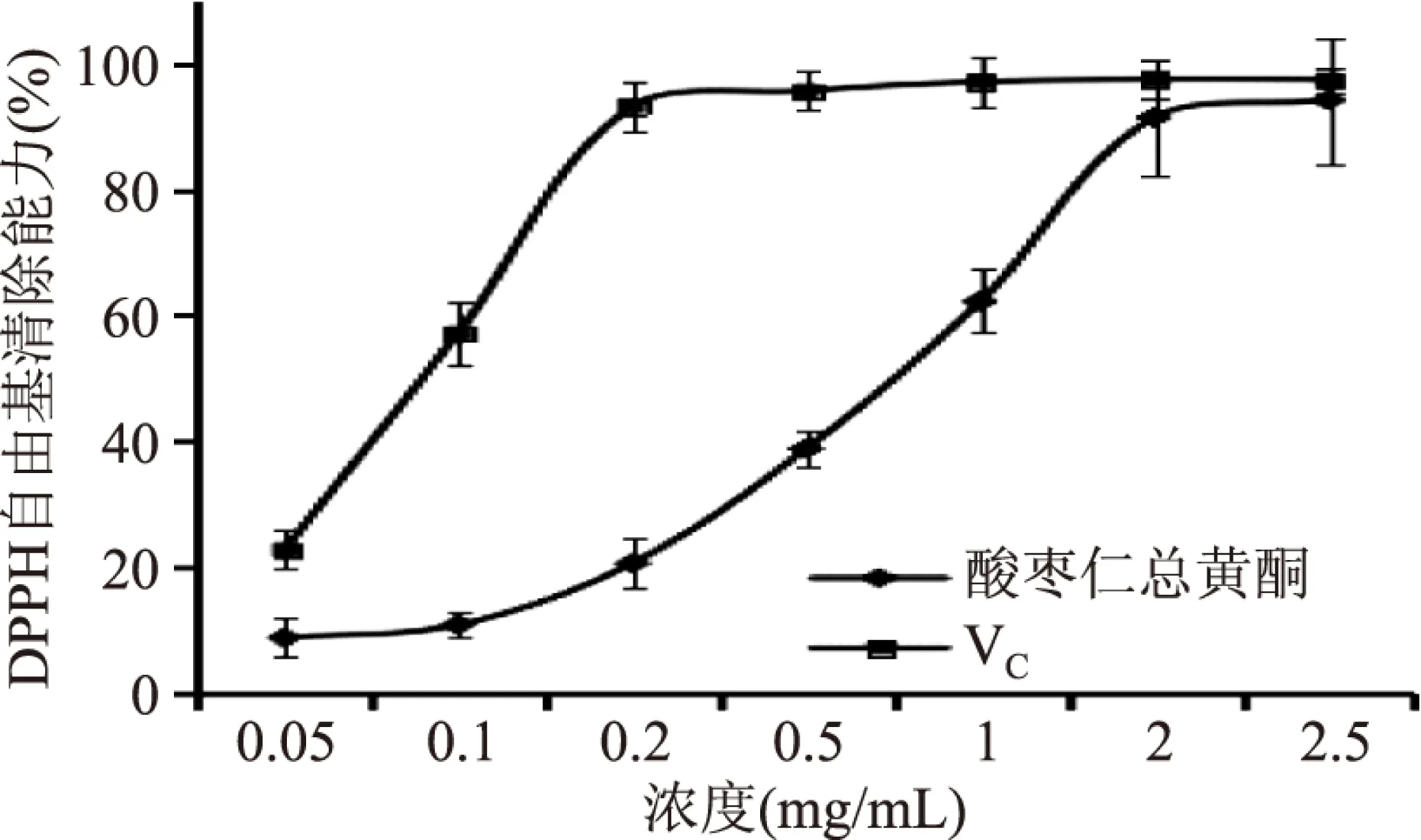
图4 DPPH自由基清除率测定Fig.4 Determination of DPPH radical scavenging capacity
2.4.2 清除ABTS自由基能力 ABTS在适当的氧化剂作用下氧化成绿色的ABTS自由基,抗氧化剂存在时自由基的产生会被抑制,在734 nm处测定吸光度可计算供试品的抗氧化能力。结果如图5所示,酸枣仁总黄酮浓度在0.05~2.5 mg/mL范围内ABTS自由基抑制率随着浓度的升高而升高,在0.5 mg/mL时达到91.3%,接近VC水平。酸枣仁总黄酮的IC50值为0.15 mg/mL。
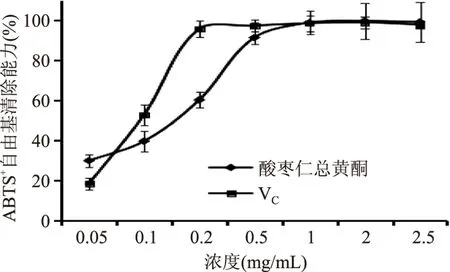
图5 ABTS自由基清除率测定Fig.5 Determination of ABTS radical scavenging capacity
2.4.3 铁氰化钾还原能力 良好的抗氧化剂通常还原能力较好,因此通过测定还原能力可间接的评价抗氧化剂的抗氧化活性,还原Fe3+是应用较广泛的评价方法。结果如图6所示,酸枣仁总黄酮浓度在0.05~2.5 mg/mL范围内铁氰化钾还原能力随着浓度的升高而升高,在2 mg/mL时吸光度达到3.60,接近VC水平。
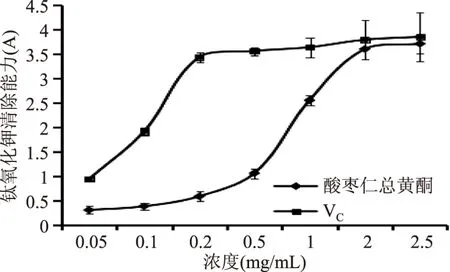
图6 铁氰化钾还原能力测定Fig.6 Determination of Fe3+ reduction capacity
3 结论
本研究选取5种不同极性的大孔吸附树脂对酸枣仁总黄酮进行富集纯化。静态吸附和动态吸附实验结果显示,弱极性的AB-8型号大孔吸附树脂富集回收率分别为77.94%和60.58%,效果显著。进而对纯化工艺中五个条件进行单因素考察,确定总黄酮浓度1.99 mg·mL-1、上样量50 mL、洗脱剂体积分数50%、洗脱剂用量50 mL和洗脱流速1 mL/min为最佳条件,最终通过验证实验,表明该纯化工艺富集效率较高,重现性良好。通过测定DPPH、ABTS自由基清除力以及铁氰化钾还原能力三种经典的体外抗氧化评价实验,发现酸枣仁总黄酮对DPPH和ABTS自由基具有明显的清除能力(IC50值为0.70 mg/mL和0.15 mg/mL),并对铁氰化钾表现出了较强的还原能力。酸枣仁总黄酮在浓度分别为2、0.5、2 mg/mL时达到与VC相近的抗氧化能力,说明其体外抗氧化能力较强。
近几年随着研究的不断深入,植物性抗氧化活性成分在食品、化妆品和药品等领域的开发与应用日益增多。酸枣仁作为传统中药材,在安神、镇静催眠等方面具有良好的治疗效果。随着药材中抗氧化成分的不断研究与开发,酸枣仁作为一种功能性药食同源品种,在治疗失眠、抑郁症等神经退行性疾病方面将具有更广阔的应用前景。
[1]中国药典2015版第一部[S]. 2015:366.
[2]王茜,张艳强,杨艳婷,等. 酸枣仁的化学成分及应用研究进展[J]. 黑龙江医学,2015(2):259-261.
[3]陈雯,黄世敬. 酸枣仁化学成分及药理作用研究进展[J].时珍国医国药,2011,22(7):1726-1728.
[4]陈况况,章宏慧,刘东红,等. 大孔吸附树脂纯化水芹总黄酮的研究[J]. 食品工业科技,2013,34(20):246-250.
[5]张华潭,郑文丽,魏艳婷,等. 大孔树脂纯化黄蜀葵花总黄酮的工艺优选[J]. 中国实验方剂学杂志,2015,21(1):28-31.
[6]司建志,王硕,周小雷,等. 聚酰胺纯化八角残渣黄酮的工艺研究[J]. 食品工业科技,2015,36(8):245-249.
[7]易阳,艾有伟,王宏勋. 莲藕总黄酮的超声波提取工艺优化[J]. 食品工业科技,2014,35(13):207-212.
[8]智秀娟,马挺军,丁轲,等. 大孔吸附树脂分离纯化苦荞总皂苷的研究[J]. 食品工业科技, 2015,36(12):226-230.
[9]刘安军,刘慧慧,郭丹霄,等. 大孔吸附树脂分离纯化枸杞叶总黄酮的研究[J]. 现代食品科技,2012,28(3):292-296.
[10]王勇,李洪福,魏娜,等. 大孔树脂分离纯化酸枣仁总黄酮的工艺优选[J]. 中国实验方剂学杂志,2013,19(23):4-6.
[11]吴博,刘春梅,刘冰,等. 益智总黄酮大孔树脂纯化工艺研究[J]. 中草药,2015,46(9):1321-1325.
[12]郑德勇,安鑫南. 竹叶提取物清除DPPH自由基的测定方法[J]. 福建农林大学学报:自然科学版,2005,34(1):59-62.
[13]Yizhong Cai,Qiong Luo,Mei Sun,et al. Antioxidant activity and phenolic compounds of 112 Chinese medicinal plants associated with anticancer[J]. Life Sciences,2004,74(17):2157-2184.
[14]刘爱敬,廖争争,郭琳,等. 大孔树脂纯化黄秋葵及其体外抗氧化活性研究[J]. 食品工业科技,2015,36(16):284-288.
Study on purification technology for total flavonoids from the seeds ofiziphusjujubaMill. with macroporous resins andinvitroantioxidant ability
ZHAO Xu1,ZHANG Si-tong1,LIU Chun-mei2,YAN Ting-xu2,XIAO Feng1,JIA Ying1,*
(1.School of Functional Food and Wine,Shenyang Pharmaceutical University,Shengyang 110016,China; 2.School of Traditional Chinese Materia Medica,Shenyang Pharmaceutical University,Shengyang 110016,China)
Study on optimum conditions of the purification of total flavonoids from the seeds ofZiziphusjujubaMill. with macroporous adsorption resin. Meanwhile,to analyze theinvitroantioxidant capacities of the flavonoids. Five different polarity macroporous adsorption resin were selected by using static adsorption and dynamic adsorption tests,and the total flavonoids concentration of sample,sample volume,the volume fraction of the elution,the volume of elution and the flow rate were investigated,respectively. The flavonoids were evaluated by three models of antioxidant activity:·DPPH,ABTS+· and K3Fe(CN)6with VCas the positive control. The results indicated that AB-8 macroporous adsorption resin was selected as the purification of the total flavonoids ofZiziphusjujubaMill. The optimum technology conditions were as follows:the total flavonoids concentration of sample was 1.99 mg/mL,sample volume was 50 mL,the volume fraction of the elution was 50% ethanol,the volume of elution was 50 mL,and the flow rate was 1 mL/min after purification. Compared with VC,the flavonoids fromZiziphusjujubaMill. had stronger capacity of scavenging on ·DPPH,ABTS+·(IC500.70 mg/mL,0.15 mg/mL)and showed a high reduction capacity.
ZiziphusjujubaMill.;total flavonoids;macroporous adsorption resin;invitroantioxidant capacities
2016-06-15
赵旭(1983-),男,博士,讲师,研究方向:中药药效物质基础、体内药物分析,E-mail:zhaoxu_1010@163.com。
*通讯作者:贾英(1969-),女,博士,教授,主要从事中药药效物质基础、神经退行性疾病活性成分筛选及中药干预的研究,E-mail:jiayingsyphu@126.com。
国家自然科学基金(81403065,81573580);辽宁省教育厅科研项目(L2015533);辽宁省大学生创新创业训练计划项目(201610163050)。
TS201
A
1002-0306(2016)24-0000-00
10.13386/j.issn1002-0306.2016.24.000

