诱导干细胞技术制备软骨细胞治疗关节软骨损伤的动物实验研究
赵 辉 曹 素 刘志刚
(湖北医药学院附属东风医院1 骨关节外科,2 手术室,3 骨科研究所,十堰市 442000,E-mail:zhaohui719@163.com)
论著·基础研究
诱导干细胞技术制备软骨细胞治疗关节软骨损伤的动物实验研究
赵 辉1曹 素2刘志刚3
(湖北医药学院附属东风医院1 骨关节外科,2 手术室,3 骨科研究所,十堰市 442000,E-mail:zhaohui719@163.com)
目的 探讨利用诱导干细胞技术制备软骨细胞治疗关节软骨损伤的价值。方法 选择健康新西兰大白兔12只,其中3只用于分离培养骨髓间充质干细胞(BMMSC),将其余白兔均分为诱导组、空白对照组及支架组(每组3只)。建立软骨缺损动物模型后,空白对照组关节软骨缺损区不作任何处理,支架组只将25%可注射型支架材料Pluronic F-127注入软骨缺损区,诱导组将25%可注射型支架材料Pluronic F-127注射到最佳诱导分化的BMMSC中,再将细胞注入软骨缺损区。干预后15 d,对各组动物关节软骨缺损部位进行大体观察与显微镜下观察,并进行组织学评分。结果 定向诱导14 d后,BMMSC由梭形变为多边形,形成软骨样结节。建模后3组实验动物膝关节活动正常,诱导组术后8周关节缺损处完全填充,修复组织表面平整,软骨下区形成新骨;其他两组缺损持续存在,粉红色组织填充底部。诱导组术后4周、8周的组织学评分分别为(6.44±1.11)分和(6.27±1.09)分,均明显低于支架组的(10.41±1.34)分和(9.87±1.23)分(P<0.05),也明显低于空白对照组的(11.09±1.34)分和(9.89±1.33)分(P<0.05)。结论 诱导干细胞技术制备的软骨细胞在体外增生分化效果好,而应用于治疗关节软骨损伤可以最大限度地减少创伤。
关节软骨损伤;骨髓间充质干细胞;软骨细胞;组织工程学;实验研究
关节软骨是机体可动关节进行光滑无摩擦运动的特殊狭窄层连组织,主要由软骨细胞组成,包含Ⅱ型胶原、非胶原蛋白、蛋白聚糖、水以及胶原等[1-2]。关节软骨在多种情况下都会造成伤害,如关节软骨病、骨性关节炎以及创伤等,使患者的生活质量明显降低[3-4]。现代研究表明关节软骨损伤多发生在髋关节和膝关节,且可呈渐进性加重,导致关节软骨下骨的囊性变、纤维化、硬化、关节囊增厚等,最终致关节变形而不能发挥原来的功能[5]。治疗关节软骨损伤的主要方法是关节置换手术,但是其对于患者有一定的创伤,并且术后容易复发,形成关节软骨蜕变[6]。随着医疗技术的发展,组织工程备受学者青睐。组织工程发展中4个因素最为重要,分别是干细胞、外部环境、细胞生长调节因子、能够降解的支架材料[7-8]。有实验研究将非软骨来源细胞诱导成为软骨细胞,其能有效修复病损关节软骨[9]。本研究利用软骨组织工程技术,对骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSC)进行分离而获得干细胞,通过诱导后对关节软骨损伤模型进行修复,以期能够找到软骨组织工程理想的干细胞、支架材料与培养条件。现报告如下。
1 材料与方法
1.1 实验动物及材料 选择健康新西兰大白兔12只,月龄2个月,雌雄不限,体重2.5~3.5 kg,由湖北医药学院附属东风医院实验动物中心提供,动物质量合格证号:动字第H209441号,严格按照洁净级水平进行饲养。可注射型支架材料Pluronic F-127购自Sigma公司;细胞分离液、胰岛素、低黏度藻酸钠、转化生长因子β1均购自Sigma公司(生产批号分别为20142242、20138553、20149955、20153335);抗兔Ⅰ、Ⅱ型胶原抗体购自武汉三鹰公司(生产批号分别为201503092、20145553)。
1.2 实验方法
1.2.1 分组方法:选择3只大白兔用于分离BMMSC,其余大白兔采用随机数字表法分为诱导组、空白对照组以及支架组,每组3只。
1.2.2 BMMSC的分离、常规培养及诱导培养:采用30 g/L戊巴比妥钠5 ml静脉麻醉大白兔,待完全麻醉后抽取大白兔的胫骨骨髓。随后通过Percoll细胞分离液实现梯度密度,1倍磷酸缓冲盐溶液洗涤后选择细胞进行常规
培养(5% CO2和37℃)。细胞生长密度达90.0%后收集细胞,使用10 g/L藻酸钠溶液进行洗涤;滴入200 mmol/L氯化钙溶液,待出现了藻酸钙凝胶微球,将藻酸钙凝胶微球在旋转式细胞培养系统(上海生物工程公司)中放置;通过诱导形成悬浮细胞,在平面培养瓶中接下悬浮细胞,使其处于静态中培养。其中培养基成分由转化生长因子β 110 μg/L、胰岛素6.25 mg/L、维生素C 50 mg/L构成,诱导培养2周。
1.2.3 建立软骨缺损动物模型:使用3%戊巴比妥钠(30 mg/kg)对实验动物实施静脉麻醉,大白兔取仰卧的姿势,常规消毒,铺无菌巾。取膝关节内侧切口,经髌骨内侧缘将膝关节切开,将髌腱和股四头肌肌腱拉开;使膝关节充分暴露出来,进行直径、深度均为5 cm的圆柱形软骨损坏区的制作,位置是在膝关节股骨滑车处。1.2.4 干预方法:空白对照组无特殊处理;支架组只将25%可注射型支架材料Pluronic F-127注入软骨缺损区,然后逐层缝合;诱导组先将25%可注射型支架材料Pluronic F-127注射到最佳诱导分化的BMMSC中,注射环境为 4℃,使重悬细胞终浓度为5×1010/L,后采用预冷注射器将重悬细胞注入软骨缺损,然后逐层缝合。干预后各组也严格按照洁净级水平进行饲养。
1.3 观察指标 (1)观察并详细记录BMMSC的鉴定以及体外诱导培养情况;(2)在干预后15 d,对动物关节软骨缺损修复部位进行大体观察与显微镜下观察;(3)在干预后15 d,参照文献[3]的方法,对关节软骨缺损修复情况进行组织学评分。
1.4 统计学分析 应用SPSS 13.0软件进行统计学分析,计量资料以(x±s)表示,比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 BMMSC诱导培养情况 BMMSC常规培养24 h后出现细胞贴壁,5 d后可见多角细胞细胞以及梭形细胞呈团簇状生长,见图1a。向软骨方向定向诱导后,诱导第2天可见少量的单个梭形细胞变为多边形,均可以看到形状细长的伪足,见图1b,随诱导时间延长,越来越多的细胞的形状有所改变,见图1c;在15 d左右细胞形状变为圆形,出现团装的细胞集聚,形成软骨样结节,见图1d。

图1 BMMSC诱导培养情况(×200)
2.2 关节软骨缺损修复情况 手术后各组动物膝关节均能正常活动,创口愈合良好。诱导组术后8周关节处不再出现缺损的地方,与周围正常关节软骨分界不明显;其他两组出现凹陷,底部由粉红色组织填充。显微镜下观察诱导组术后8周的修复组织表面平整,细胞核清晰,软骨下区形成新骨;其他两组缺损持续存在,底部由粉红色组织填充。
2.3 关节软骨组织学评分 诱导组术后4周、8周的组织学评分均明显低于支架组及空白对照组(P<0.05)。见表1。
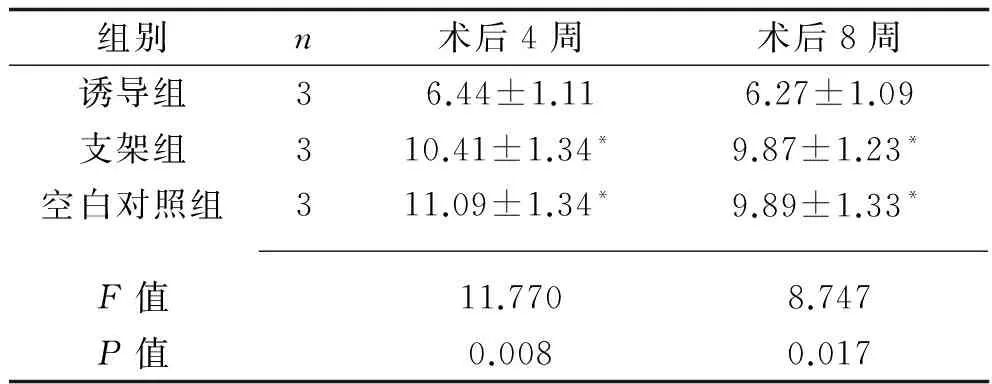
表1 3组术后不同时间点的关节软骨修复组织学评分比较(x±s,分)
注:与诱导组比较,*P<0.05。
3 讨 论
身体的多个关节处都可能引发软骨组织的损伤,以膝关节和髋关节最为常见。目前软骨关节炎在骨科临床上越来越常见,其往往由运动损伤、软骨磨损以及关节退行性变等引起[10]。许多晚期骨关节炎患者在关节置换术后症状得以缓解,然而很多患者的病情没有达到晚期,因此没有获得良好的治疗效果,而病情仍对其生活造成极大影响。虽然关节软骨是关节组织中代谢能力较强的组织,然而基质中软骨细胞的更新换代率较低,因此软骨损伤后很难进行自我修复[11]。关节面过度损伤通常容易发展为骨性关节炎,轻度关节软骨损伤会使损伤发展甚至退变,造成严重的后果[12]。
目前关节软骨损伤的治疗方法包括移植技术、关节镜下关节腔灌洗和清理术、降低关节面应力及保持关节活动、关节面钻孔及微骨折术、药物治疗等,但每种方法都因其自身的缺点而不能很好地应用于临床[13]。组织工程学技术是一种全新的关节软骨修复技术,该技术需细胞生长因子、干细胞、组织结构以及可降解的支架材料的支持[14]。在干细胞的诱导分化中,转化生长因子β1能够调节软骨细胞的分化,加速合成、分化以及增殖软骨细胞DNA。维生素C是一种抗氧化剂,可抑制或减少凋亡的产生。特别是BMMSC再生性能较强,同时衰老性能较低,因此能够使软骨细胞进行修复且不改变其形状[15]。本研究显示14 h的定向诱导完成后,BMMSC有一个形状的改变过程,改变的顺序是梭形、多边形、类圆形,最后细胞集聚构成软骨样结节,表明诱导效果良好,使利用组织工程技术进行组织工程软骨的构建有了干细胞的物质保障。
程艳伟等[16]将BMMSC通过软骨组织工程技术分离成干细胞,然后采用成骨细胞对生长因子进行诱导,最后与支架材料复合置于三维培养条件,在关节骨软骨缺损深层置入构建的骨软骨复合体,观察其修复的情况;而新近有研究表明成软骨分化的重要因素是在微重力环境下动态培养方式[17];因此,为了对微重力环境进行模拟,尽可能达到最理想的状态,本研究使用了旋转式细胞培养系统,同时使得细胞间物质传递效率得以提升,使细胞承受较低的剪切力,从而使得细胞分化质量得以提升。本研究中各组均未发现炎细胞浸润,说明其生物相容性较好,不存在抗原性;诱导组术后4周与8周的组织学评分均明显低于支架组及空白对照组(P<0.05),说明诱导干细胞技术制备软骨细胞能促进关节软骨修复,这为应用新型干细胞构建组织工程软骨提供了新思路。
总之,诱导干细胞技术制备的软骨细胞在体外增生活跃,生物学性状稳定,而应用于治疗关节软骨损伤可以最大限度地减少创伤,为组织工程方法修复关节软骨损伤提供了实验参考。
[1] 何瑞轩,赵 亮.诱导多能干细胞在骨外科组织再生修复中:如何尽快实现临床应用?[J].中国组织工程研究,2015,19(23):3 761-3 767.
[2] 陈祁青,金红婷,吴承亮,等.右归饮含药血清对TGF-β1诱导骨髓间充质干细胞向软骨细胞分化的影响[J].浙江中医药大学学报,2015,39(4):304-311.
[3] Winkler S,Hempel M,Brueckner S,et al.Mouse white adipose tissue-derived mesenchymal stem cells gain pericentral and periportal hepatocyte features after differentiation in vitro,which are preserved in vivo after hepatic transplantation[J].Acta Physiologica,2015,215(2):89-104.
[4] 陈 伟,王丽娜,郝云甲,等.不同来源软骨细胞共培养对骨髓间充质干细胞早期分化的影响[J].中华老年医学杂志,2015,34(5):557-560.
[5] 崔小明,吴佳奇.骨髓间充质干细胞与软骨细胞共培养研究进展[J].中国综合临床,2015,31(4):366-368.
[6] Zablotni A,Dakischew O,Trinkaus K,et al.Regulation of acetylcholine receptors during differentiation of bone mesenchymal stem cells harvested from human reaming debris[J].Int Immunopharmacol,2015,29(1,SI):119-126.
[7] 邢 超,张志光.间充质干细胞治疗颞下颌骨关节病的研究展望[J].中华老年口腔医学杂志,2015,13(2):105-108.
[8] 李新江,方艳伟,张爱民,等.骨髓间充质干细胞-生物蛋白胶复合物修复兔膝关节软骨缺损[J].中华创伤杂志,2015,31(6):563-567.
[9] Choi WH,Kim HR,Lee SJ,et al.Fetal cartilage-derived cells have stem cell properties and are a highly potent cell source for cartilage regeneration[J].Cell Transplant,2015,25(3):114-116
[10]梁红锁,黄 克,李 林,等.关节镜下微骨折术联合自体骨髓间充质干细胞移植治疗膝关节软骨缺损[J].中国现代药物应用,2015,9(9):1-3.
[11]王 震,梁大川,白洁玉,等.慢病毒介导的Sox9基因在兔骨髓间充质干细胞的过表达促进软骨损伤修复[J].中国骨伤,2015,28(5):433-440.
[12]Jung YJ,Kim KC,Heo JY,et al.Induction of angiogenesis by matrigel coating of VEGF-loaded PEG/PCL-based hydrogel scaffolds for hBMSC transplantation[J].Mol Cells,2015,38(7):663-668.
[13]丁文斌,黄江鸿,徐伟力,等.骨髓间充质干细胞向软骨细胞诱导分化的研究进展[J].医学综述,2015,21(12):2 148-2 151.
[14]Ham O,Lee CY,Kim R,et al.Therapeutic potential of differentiated mesenchymal stem cells for treatment of osteoarthritis[J].Int J Mol Sci,2015,16(7):14 961-14 978.
[15]张丽梅,李高权,姚新苗,等.骨关节炎软骨细胞凋亡主要调控因子的研究新进展[J].浙江临床医学,2015,17(3):482-484.
[16]程艳伟,李清山,杨 坤,等.诱导性多潜能干细胞治疗骨关节炎的研究进展[J].中华医学杂志,2015,95(17):1 354-1 357.
[17]Potdar PD,Jethmalani YD.Human dental pulp stem cells:Applications in future regenerative medicine[J].World J Stem Cells,2015,7(5):839-851.
Experimental research on chondrocytes prepared by induced stem cells technology for treating articular cartilage injury in animal
ZHAOHui1,CAOSu2,LIUZhi-gang3
(1DepartmentofOrthopedics,2OperationRoom,3OrthopedicsInstitute,DongfengHospital,HubeiUniversityofMedicine,Shiyan442000,China)
Objective To investigate the value of chondrocytes prepared by induced stem cells technology for treating articular cartilage injury.Methods Of 12 healthy New Zealand rabbits selected,3 rabbits were used to isolate the bone marrow mesenchymal stem cells(BMMSC),the remaining rabbits were equally divided into the induction group,blank control group and stent group,with 3 rabbits in each group.After the establishment of the cartilage defect animal model,no treatment was performed in the articular cartilage defect in the blank control group,25% injectable scaffold Pluronic F-127 was injected into cartilage defect in the stent group.And in the induction group,25% injectable scaffold Pluronic F-127 was injected into BMMSC with optimum induce differentiation,then the cells were injected into cartilage defect.After 15 days of intervention,gross and under-microscope observation on articular cartilage defects was conducted in each group,and the histological scoring was also performed.Results In BMMSC,spindle-shape turned into polygon-shape,and cartilage-like nodules was formed after 14 days of directional induction.After modeling,the movement of knee joints was normal in the rabbits of the three groups.At postoperative 8 weeks,the cartilage defect of induction group was completely filled,the surface of repaired tissues was smooth,and the formation of new bone was found in the subchondral region.But the defects remained existing,and the pink tissues were filled into the bottom in the other two groups.The histological scores of postoperative 4 and 8 weeks were 6.44±1.11 and 6.27±1.09 in the induction group respectively,and were significantly lower than those in either the stent group(10.41±1.34 and 9.87±1.23 respectively,P<0.05) or the blank control group(11.09±1.34 and 9.89±1.33 respectively,P<0.05).Conclusion The chondrocytes prepared by induced stem cells has a good effect on differentiation and proliferation in vitro,and can alleviate the trauma when being applied to the treatment of articular cartilage injury.
Articular cartilage injury,Bone marrow mesenchymal stem cells,Chondrocytes,Tissue engineering,Experimental study
赵辉(1975~),男,本科,主治医师,研究方向:骨关节。
曹素(1981~),女,本科,主管护师,研究方向:骨科,E-mail:caosu615@163.com。
R 684.76
A
0253-4304(2016)06-0762-04
10.11675/j.issn.0253-4304.2016.06.03
2016-01-04
2016-04-07)

