磁共氢质子振波普及扩散加权成像早期诊断放射性脑损伤的价值
罗考业 黄筠洋 姚秀华 王儒发 曾 凡
(广西百色市人民医院放射科,百色市 533000,E-mail:425647874@qq.com)
临床创新
磁共氢质子振波普及扩散加权成像早期诊断放射性脑损伤的价值
罗考业 黄筠洋 姚秀华 王儒发 曾 凡
(广西百色市人民医院放射科,百色市 533000,E-mail:425647874@qq.com)
目的 探讨磁共氢质子振波普(1H-MRS)及扩散加权成像(DWI)早期诊断鼻咽癌放射性脑损伤价值。方法 30例鼻咽癌患者,分别于放疗前、放疗结束时及放疗后3、6个月时进行颅脑常规MRI平扫、1H-MRS及DWI检查,获取患者双侧颞叶在放疗不同时期的N-乙酰天冬门氨酸/肌酸(NAA/Cr)、N-乙酰天冬门氨酸/胆碱(NAA/Cho)、胆碱/肌酸(Cho/Cr)比值及DWI表观扩散系数(ADC)值,并进行统计分析。结果 不同时间点的NAA/Cr、NAA/Cho比值及ADC值比较,差异有统计学意义(P<0.05),放疗后各时间点NAA/Cr、NAA/Cho比值均低于放疗前,且于放疗后3个月时降至最低,放疗后6个月较前有所升高。各时间点Cho/Cr比值比较,差异无统计学意义(P>0.05)。结论1H-MRS及DWI技术分别能监测脑组织细胞代谢产物浓度和脑组织细胞水分子的交换功能,反映脑组织细胞的微观病理生理改变,对早期诊断放射性脑损伤有一定临床价值。
磁共振波普成像;磁共振扩散加权成像;鼻咽癌;放射性脑损伤
鼻咽癌高发于我国南方地区,发病率可达10/10万。放射治疗是鼻咽癌主要的治疗手段之一,虽然放射治疗已经进入了以调强放射治疗为代表的精确放疗时代,但是放射性脑病依然是鼻咽癌放射治疗后的主要并发症之一,发病率为5%~24%[1]。放射性脑病诊断主要依靠病史、临床表现以及影像学检查,但常规影像学检查缺乏特异性,极易误诊[2],并且当常规影像学检查发现可见病变时,放射性脑损伤已进入了不可逆的中晚期阶段。本研究应用磁共氢质子振波普(1H-magnetic resonance spectroscopy,1H-MRS)成像技术及扩散加权成像(diffusion weighted imaging,DWI)技术对放射性脑损伤进行检查,旨在探讨该两种技术对诊断早期放射性脑损伤应用价值,现报告如下。
1 资料与方法
1.1 临床资料 收集2013年6月至2014年6月在我科行调强放射治疗的鼻咽癌患者30例,均经病理检查确诊,按1992年福州临床分期[3]为:T1、T2、T3、T4期,分别为4例、7例、13例、6例;N0、N1、N2、N3期分别为1例、8例、12例、9例;Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别为3例、8例、14例、5例。30例患者均有完整的临床及影像学资料,且均为首次接受放射治疗,放疗前颅脑常规MRI检查均未见异常。男23例,女7例,年龄22~68(43±6)岁。均进行调强放疗,方案均为9~11个照射野静态调强放射治疗,照射野等角度分布,放疗总剂量为66~76 Gy,分割次数为33次、5次/周完成治疗。
1.2 方法 30例患者均于放疗前、放疗结束时、放疗后3、6个月时分别进行颅脑常规MRI平扫及1H-MRS、DWI检查,获取不同时期的N-乙酰天冬门氨酸/肌酸(N-acetyl aspartate/creatine,NAA/Cr)、N-乙酰天冬门氨酸/胆碱(N-acetyl aspartate/choline,NAA/Cho)、胆碱/肌酸(choline/creatine,Cho/Cr)比值及DWI表观扩散系数(apparent diffusion coefficient,ADC)值。MRI成像系统应用飞利浦Achieva 3.0T TX 多源超高场强磁共振成像系统,8通道头部线圈。常规MRI序列包括横轴面T1WI、T2WI、DWI序列扫描。T1WI扫描参数:重复时间(time of repetition,TR)=2 000 ms,回波时间(echo time,TE)=9.2 ms,扫描野(field of view,FOV)=230 mm×230 mm,Flip angle=130°,层厚为5 mm,层数为20;T2WI扫描参数:TR=3 500 ms,TE=98 ms,FOV=230 mm×230 mm,Flip angle=130°,层厚为5 mm,层数为20。DWI扫描参数:TR=5 100 ms,TE=90 ms,FOV=230 mm×230 mm,Flip angle=130°,层厚为5 mm,层数为20。1H-MRS波谱定位选用三维T2WI序列图像于双侧颞叶上照射野范围内选定感兴趣区域,采用点波谱分辨技术采集,在感兴趣区域施加预饱和带,进行手工匀场、压水压脂,在满足半高全宽<15 Hz、水抑制率>95%条件下采集,TR=2 000 ms,TE=30 ms,Flip angle=90°,体素大小=12 mm×12 mm×12 mm,矩阵1 024×1 024。
1.3 图像处理和数据分析 使用Siemens Trio Tim 3.0T MRI工作站进行数据分析处理,生成双侧颞叶各代谢物谱线,计算放疗不同时期的NAA/Cr、NAA/Cho、Cho/Cr比值及ADC比值。各参数值均取3个小体素的平均值,最终结果取平均值,示例图见图1。

① ② ③
图1 感兴趣体素定位示例图及放疗前后波谱曲线
注:① 需测量3个感兴趣体素的定位示例图;② 放疗前MRS显示的正常波谱曲线示例图;③ 放疗结束时的波谱曲线示例图。可见放疗前NAA峰值高于Cho,放疗结束时则相反。
1.4 统计学分析 采用SPSS 17.0统计软件对数据进行分析,正态分布的计量资料以(x±s)表示,单因素重复测量资料比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结 果
不同时间点的NAA/Cr、NAA/Cho比值及ADC值比较,差异有统计学意义(P<0.05),放疗后各时间点NAA/Cr、NAA/Cho比值均低于放疗前,且于放疗后3个月时降至最低,放疗后6个月较前有所升高。各时间点Cho/Cr比值比较,差异无统计学意义(P>0.05)。见表1。
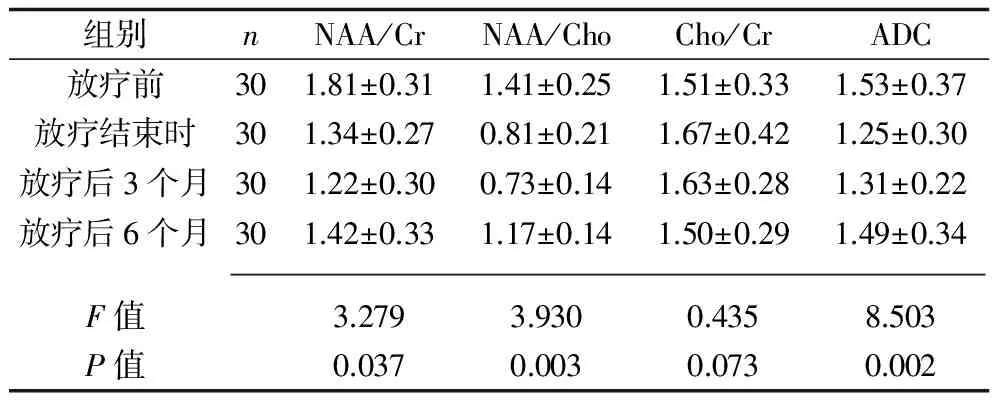
表1 放疗前后NAA/Cr、NAA/Cho、Cho/Cr比值及ADC值比较(x±s)
3 讨 论
放射性脑损伤是一种行头颈部放射性治疗后并发的神经系统损害[4],发病率为0.9%[5]。放射性脑损伤的发病机制还存在较多争议,目前主要有4种学说[2]:(1)神经元及神经胶质细胞损伤学说;(2)血管内皮损伤学说;(3)免疫损伤学说;(4)自由基损伤学说。临床上放射性脑损伤可分为:(1)急性损伤:发生在放疗期间或放疗后1个月内;(2)早期迟发损伤:一般发生在放疗结束后数周至3个月内;(3)晚期迟发损伤:发生于放疗结束后6个月至数年。急性损伤和早期迟发损伤临床症状较轻,一般经积极有效的治疗可恢复,晚期迟发损伤是不可逆的、进行性的脑损伤,主要导致神经功能障碍。因此早期诊断早期治疗,对制订放射性脑损伤治疗计划、阻止早期损伤向晚期迟发损伤进展有重要意义。
1H-MRS成像技术及DWI技术分别能监测脑组织细胞代谢产物浓度和监测脑组织细胞水分子的交换功能,能反映脑组织细胞的微观病理生理改变。本研究发现放疗结束时鼻咽癌患者的NAA/Cr、NAA/Cho较放疗前明显下降,放疗后3个月NAA/Cr、NAA/Cho进一步下降,而放疗后6个月NAA/Cr、NAA/Cho比值有所恢复,但仍未恢复至放疗前水平。笔者认为,由于Cr值较稳定[6],故NAA/Cr、NAA/Cho下降可能是由于NAA下降或Cho升高导致的。NAA主要存在于神经元胞体的线粒体中,电离辐射直接损伤神经元细胞膜和DNA,致神经元内的线粒体功能障碍,使NAA下降[7]。Cho主要存在于胶质细胞的细胞膜上,放疗可能导致脑胶质细胞损伤使胞膜崩解,Cho升高[8]。有学者报告[9]NAA/Cr在放疗后3个月最低,之后逐渐升高,与本研究结果相近。本研究发现放疗后6个月NAA/Cr、NAA/Cho比值尚未完全恢复,可能由于神经元细胞为永久性细胞,凋亡后无法再生,使脑组织细胞代谢产物浓度降低所致。
脑组织在接受放射后组织微观结构会发生改变,如血管内皮损伤、神经元细胞损伤等各种因素的改变不同程度的影响水分子扩散范围及扩散方向,从而引起ADC值发生改变。本研究发现放疗结束时ADC值较放疗前明显下降,可能与放疗后血管内皮细胞的早期损伤、炎性细胞浸润、微小血管内血栓形成导致水分子的扩散速度下降有关[10];放疗后3个月ADC值较放疗结束时有所恢复;放疗后6个月ADC值进一步恢复,原因可能是以上微观病理变化在放疗结束后逐渐得以恢复。
综上所述,早期放射性脑损伤的主要病理学基础是神经元的受损及髓鞘的崩解和胶质细胞降解[11],以及脑组织细胞代谢产物浓度及水分子扩散发生改变。1H-MRS成像技术及DWI技术分别能监测脑组织细胞代谢产物浓度和脑组织细胞水分子交换功能的动态变化[11-12],可观察早期放射性脑损伤的发生、损伤逐步加重而后逐渐恢复的病理过程,并反映放疗后脑组织细胞的微观病理生理改变,为早期诊断放射性脑损伤提供重要参考。
[1] Kaminaga T,Shirai K.Radiation-induced brain metabolic changes in the acute and early delayed phase detected with quantitative proton magnetic resonance spectroscopy[J].J Comput Assist Tomogr,2005,29(3):293-297.
[2] 张海博,梁海乾,涂 悦,等.放射性脑损伤的研究现状[J].山东医药,2014,54(26):95-97.
[3] 中国鼻咽癌临床分期工作委员会.鼻咽癌′92分期修订工作报告[J].中华放射肿瘤学杂志,2009,18(1):2-6.
[4] Assi A,Kawamoto K.Radiation-induced brain injury[J].Brain Nerve,2008,60(2):123-129.
[5] 梁 霁,郑金瓯.放射性脑病48例的影象学特征[J].广西医学,2007,29(12):1 927-1 928.
[6] Vermathen P,Capizzano AA,Maudsley AA.Administration and1H MRS detection of histidine in human brain:application to in vivo pH measurement[J].Magn Reson Med,2000,43(5):665-675.
[7] 陈韵彬,刘征华,鲍道亮,等.氢质子磁共振波谱诊断鼻咽癌早期放射性脑损伤[J].福建医科大学学报,2007,41(3):222-224,228.
[8] 王宏琢.鼻咽癌放疗后放射性脑损伤的1H磁共振波谱与扩散张量成像[D].广州:南方医科大学,2010.
[9] Xiong WF,Qiu SJ,Wang HZ,et al.1H-MR spectroscopy and diffusion tensor imaging of normal-appearing temporal white matter in patients with nasopharyngeal carcinoma after irradiation:initial experience[J].J Magn Reson Imaging,2013,37(1):101-108.
[10]陈学文,卜雨华,付飞先,等.鼻咽癌放疗后早期放射性脑损伤的磁共振扩散加权成像研究[J].实用医学影像杂志,2014,15(5):305-307.
[11]王宏琢,邱士军,王燕钰,等.鼻咽癌放射治疗后放射性脑损伤的扩散张量成像与1H-MRS波谱研究[J].中华放射学杂志,2010,44(7):677-681.
[12]陈旺生,李建军,洪 澜,等.鼻咽癌放射性脑损伤迟发反应期的磁共振波谱研究[J].临床放射学杂志,2011,30(4):481-484.
罗考业(1983~),男,本科,主治医师,研究方向:医学影像诊断学。
R 814.46
A
0253-4304(2016)03-0421-03
10.11675/j.issn.0253-4304.2015.02.37
2015-08-27
2015-11-12)

