心力衰竭后交感神经重构的机制及美托洛尔联合神经生长因子干预效果的研究▲
梁 政 陈文江 何忠开 陈 灿
(广东医学院附属医院心血管内科,湛江市 524001,E-mail:yezi62002413@163.com)
论著·临床研究
心力衰竭后交感神经重构的机制及美托洛尔联合神经生长因子干预效果的研究▲
梁 政 陈文江 何忠开 陈 灿
(广东医学院附属医院心血管内科,湛江市 524001,E-mail:yezi62002413@163.com)
目的 探讨心力衰竭(HF)后交感神经重构的机制及美托洛尔联合神经生长因子(NGF)的干预作用。方法 40只Wistar大鼠分为HF组34只和正常对照组(NC组)6只,HF组采用阿霉素4 mg/kg腹腔注射建立模型。6周后心脏超声评估大鼠心功能,并检测血浆NGF。将HF组存活大鼠分为HF对照组5只(HF-C组)、美托洛尔干预组5只(HF-M组)、NGF注射组5只(HF-N组)、NGF注射+美托洛尔干预组6只(HF-N-M组),其中鼠NGF以60 μg/(kg·d)尾静脉注射,美托洛尔以0.25 mg/(kg·d)灌胃,共4周。干预4周后进行心律失常诱发,测定各组大鼠心功能和血浆NGF表达,并检测心脏组织的酪氨酸羟化酶(TH)、生长相关蛋白43(GAP43)、NGF的表达。结果 与NC组比较,建模后HF组大鼠左室舒张末期容积(LVEDV)和左室收缩末期容积(LVESV)明显升高,而左室射血分数(LVEF)和血浆NGF表达明显下降(P<0.05)。干预4周后,与HF-C组比较,HF-M组、HF-N组和HF-N-M组LVEF及NGF表达明显升高,LVESV明显降低(P<0.05);HF-N-M组的NGF水平较HF-M组和HF-N组升高,且LVESV明显降低(P<0.05)。HF-C组、HF-M组、HF-N组和HF-N-M组TH、GAP43、NGF mRNA和蛋白表达较NC组明显降低(P<0.05),但HF-M组、HF-N组和HF-N-M组TH、GAP43、NGF mRNA和蛋白表达较HF-C组明显升高(P<0.05),而HF-N-M组与HF-M组、HF-N组比较,差异无统计学意义(P>0.05)。NC组、HF-C组、HF-M组、HF-N组、HF-N-M组心律失常诱发率分别为0、80.00%、20.00%、20.00%、16.67%。结论 Wistar大鼠腹腔注射阿霉素可以成功诱发HF模型,HF后交感神经重构与TH、GAP43、NGF有关,而美托洛尔和NGF可以改善HF后交感神经重构及心功能,降低心律失常的发生率。
心力衰竭;交感神经重构;心功能;神经生长因子;美托洛尔;大鼠
心力衰竭(heart failure,HF)是各种心脏结构和(或)功能性疾病导致心室充盈及(或)射血能力受损而引起的一组常见临床综合征。《中国心血管病报告2014》显示,由于经济发展和社会转型,我国心血管病患病率持续上升,目前估计全国心血管病患者共2.9亿,其中高血压患者2.7亿,卒中患者至少700万,心肌梗死患者250万,而HF患者有大约450万[1],而慢性心力衰竭住院患者30 d死亡率为5.4%[2],可见HF对我国居民健康的严重威胁和沉重负担。流行病学调查结果显示,我国人群慢性心力衰竭患病率为0.9%(男性0.7%,女性1.0%);而且我国心血管患者分布不均,主要表现为北方患病率(1.4%)高于南方(0.5%),同时,城市患病率(1.1%)高于农村(0.8%)[1-2]。其发病主要与心脏结构重构、电重构和神经重构有关;当心脏排血量不足、心腔压力升高时,机体全面启动神经体液机制进行代偿,主要包括交感神经兴奋性增强和肾素-血管紧张素-醛固酮系统激活[3-6]。交感神经兴奋时,心力衰竭患者血中去甲肾上腺素水平升高,可使心肌应激性增强而有促心律失常作用,并伴随一些神经体液因子(如脑钠肽、内皮素)的变化,因此HF患者往往会发生恶性室性心律失常而导致心源性猝死[7-11]。本研究旨在探讨HF后交感神经重构的机制,以及采用美托洛尔和神经生长因子(nerve growth factor,NGF)进行干预的效果。
1 材料与方法
1.1 动物模型的建立、干预方法及标本采集 40只成年雄性清洁级Wistar大鼠,3个月龄,体重为(200±20)g,由广东省实验动物中心提供,使用许可证号:SYXK(粤)2013-0002,常规喂养。采用随机数字表法分为心力衰竭组(HF)34只和正常对照组(NC组)6只,HF组给予阿霉素(大连美仑生物技术有限公司,生产批号:MB1094)4 mg/kg腹腔注射,每周1次,共6周,累积总量24 mg/kg,而NC组应用生理盐水以HF组相同的方法、体积和时间进行注射。6周后,采集大鼠尾静脉血1 ml用于检测NGF的表达水平,并进行超声测定存活大鼠的心功能。采用随机数字表法将HF组分为HF对照组(HF-C组)、美托洛尔干预组(HF-M组)、NGF注射组(HF-N组)、NGF注射+美托洛尔干预组(HF-N-M组)。其中鼠NGF以60 μg/(kg·d)尾静脉注射,美托洛尔以0.25 mg/(kg·d)灌胃,每晚1次;而HF-C组和NC组以生理盐水按相同的方法、体积和时间进行处理,连续干预4周。鼠NGF注射液购自Sigma公司(生产批号:YYY-20140054),美托洛尔购自上海通用药业公司(生产批号:YBS-00492013)。于实验结束时,再次测定HF组存活大鼠心功能及NGF的表达水平;并对各组大鼠进行心律失常诱发实验,然后处死各组大鼠获取其心脏组织进行分装和储存。
1.2 心脏超声 以2%戊巴比妥钠(Sigma公司,批号T0894)腹腔注射麻醉各组大鼠,固定四肢并采用仰卧位,以彩色超声诊断仪(SONOS 5500,Hewlett-Packard公司)和小动物超声探头(15 MHz,型号Vevo 770)在大鼠胸骨旁以二维超声进行心脏形态和功能检测,测量指标主要有左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)、左室射血分数(left ventricular ejection fractions,LVEF)。LVEF=(LVEDV-LVESV)/LVEDV×100%。
1.3 心律失常诱发 以2%戊巴比妥钠腹腔注射麻醉各组大鼠,固定四肢并采用仰卧位,开胸,以小动物呼吸机(成都泰盟仪器公司提供,HX-101E)进行面罩呼吸支持,然后连接四肢导联心电图,以BL-420F型生物机能实验系统(成都泰盟仪器公司提供)进行记录。设置刺激强度为起搏阈值的2倍,脉宽0.2 ms,在右室流出道以S1S2或S2S3刺激方法诱发室性心动过速或心室颤动,计算诱发率,主要过程是在5次基础刺激(S0S0=180 ms)后给予一系列程序性早搏刺激,S1S2、S2S3分别取180 ms和160 ms,以-5 ms逐步递减,短阵促发刺激法诱发,如未诱发心律失常,则5 min后再重复1次。
1.4 NFG的测定 将所获取的各组大鼠全血进行离心(3 000 r/min,24℃,10 min)分离血浆,取各组大鼠的血浆,采用酶联免疫吸附测定试剂盒(深圳柏万森生物有限公司提供,生产批号:S20150043)对血浆NGF进行检测,观察其变化情况,具体步骤按照试剂盒说明书进行,最后用酶标仪(BioTek,美国,型号:EpochTM& Take3TM)在450 nm波长下测定吸光度(OD)值,并通过标准曲线计算大鼠血浆中NGF的浓度。
1.5 实时荧光定量PCR检测酪氨酸羟化酶、生长相关蛋白43、NGF mRNA 检测指标包括酪氨酸羟化酶(tyrosine hydroxylase,TH)、生长相关蛋白43(growth associated protein 43,GAP43)、NGF mRNA,首先用Trizol试剂盒(Invitrogen,美国,批号:15596-026)按照说明书步骤提取各组大鼠心脏组织的RNA,最后所得RNA OD值A260/A280在1.7~2.1为合格。按照反转录试剂盒(广州瑞真生物有限公司,批号:RR047Q)说明书将所提取RNA进行反转录,然后将反转录所获取的cDNA模板按照实时荧光定量PCR试剂盒(广州瑞真生物有限公司,批号:RR430S)说明书进行荧光定量测定,其中,预变性30 s,95℃;扩增、延伸15 s,95℃;退火30 s,60℃,共40个循环,β-肌动蛋白(β-actin)作为内参。NGF上游引物:ATCGCTCTCCTTCACAGAGTTT,下游引物:TGTACGGTTCTGCCTGTACG,产物片段为217 bp;GAP43上游引物:ATTCAGGCTAGCTTCCGTGG,下游引物:GAAGGTGCATCTCCTGCCTT,产物片段为218 bp;TH上游引物:CCTTCCAGTACAAGCACGGT,下游引物:GATGCTGTCCTCTCGGTAGC,产物片段为179 bp;β-actin上游引物:GCAGGAGTACGATGAGTCCG,下游引物:ACGCAGCTCAGTAACAGTCC,产物片段为74 bp;所有引物均由广州瑞真生物有限公司合成和提供。本研究采用2-△Ct相对定量方法进行数据分析:△Ct(实验组)=Ct(实验组目标基因)-Ct(实验组内参基因);△Ct(对照组)=Ct(对照组目标基因)-Ct(对照组内参基因)。
1.6 Western Blot检测TH、GAP43、NGF蛋白的表达情况 首先将所获取的各组大鼠心脏组织的左心室进行分离,取约50 mg组织提取其蛋白质,采用BCA法测量其蛋白浓度,继而进行蛋白电泳、转膜、NGF一抗孵育(NGF稀释比例 ∶500,GAP43稀释比例1 ∶400,TH稀释比例1 ∶500,β-actin稀释比例1 ∶1 000,由武汉博士德生物试剂公司提供)、二抗孵育、杂交、显影、曝光,Western及IP细胞裂解液(批号:P0013)、PMSF(批号:ST506)、增强型BCA蛋白浓度测定试剂盒(批号:P0009)等均由碧云天生物技术研究所提供。结果分析用Image J图像分析软件计算条带灰度值,最后结果为目的条带灰度值/内参条带灰度值。
1.7 统计学分析 采用GraphPad Prism 5(美国GraphPad软件公司)对数据进行分析,计量资料以(x±s)表示,采用t检验或者单因素方差分析,组间两两比较采用Bonferroni法;计数资料采用卡方检验或者Fisher检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠建模基本情况、建模后心功能情况及NGF表达水平 HF组34只大鼠经过6周阿霉素腹腔注射建模后,存活29只,死亡5只;NC组6只大鼠全部存活。HF组大鼠LVEDV和LVESV均明显高于NC组(P<0.05),而HF组LVEF则较NC组明显降低(P<0.05);HF组NGF表达量明显低于NC组降低(P<0.05),见表1。说明Wistar大鼠经过6周阿霉素腹腔注射可以成功诱导心力衰竭模型。
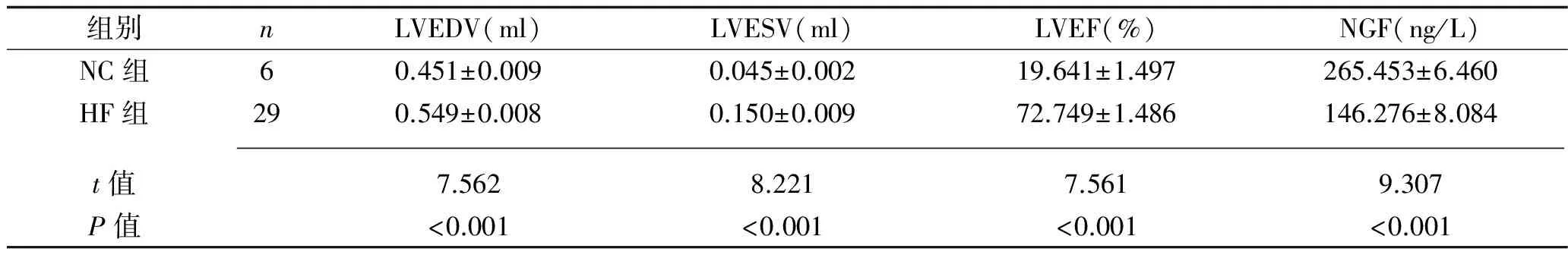
表1 两组大鼠造模6周后心功能情况和NGF水平(x±s)
2.2 HF组大鼠治疗后心功能和NGF情况 (1)将建模成功的29只大鼠分为HF-C组8只、HF-M组7只、HF-N组7只、HF-N-M组7只。4周后,HF-C组死亡3只,HF-M组和HF-N组死亡2只,HF-N-M组死亡1只,NC组未见死亡。(2)血浆检测结果显示,HF-C组、HF-M组和HF-N组NGF表达较NC组明显下降(P<0.05),而HF-M组、HF-N组和HF-N-M组NGF表达较HF-C组明显升高(P<0.05);HF-N-M组的NGF表达均高于HF-M组、HF-N组(P<0.05),但与NC组比较,差异无统计学意义(P>0.05)。(3)心功能测定结果显示,HF-C组、HF-N组和HF-N-M组LVEDV较NC组明显升高(P<0.05),HF-M组、HF-N-M组的LVEDV较HF-C组明显降低(P<0.05),而HF-N-M组低于HF-N组(P<0.05);HF-C组、HF-M组、HF-N组和HF-N-M组的LVESV较NC组明显升高(P<0.05),HF-M组、HF-N组和HF-N-M组的LVEDV较HF-C组明显降低(P<0.05),HF-N-M组均低于HF-M组、HF-N组(P<0.05);HF-C组、HF-M组、HF-N组和HF-N-M组的LVEF较NC组明显下降(P<0.05),HF-M组、HF-N组和HF-N-M组LVEF均较HF-C组明显提高(P<0.05)。HF-M组和HF-N组间各指标比较,差异均无统计学意义(P>0.05),见表2。
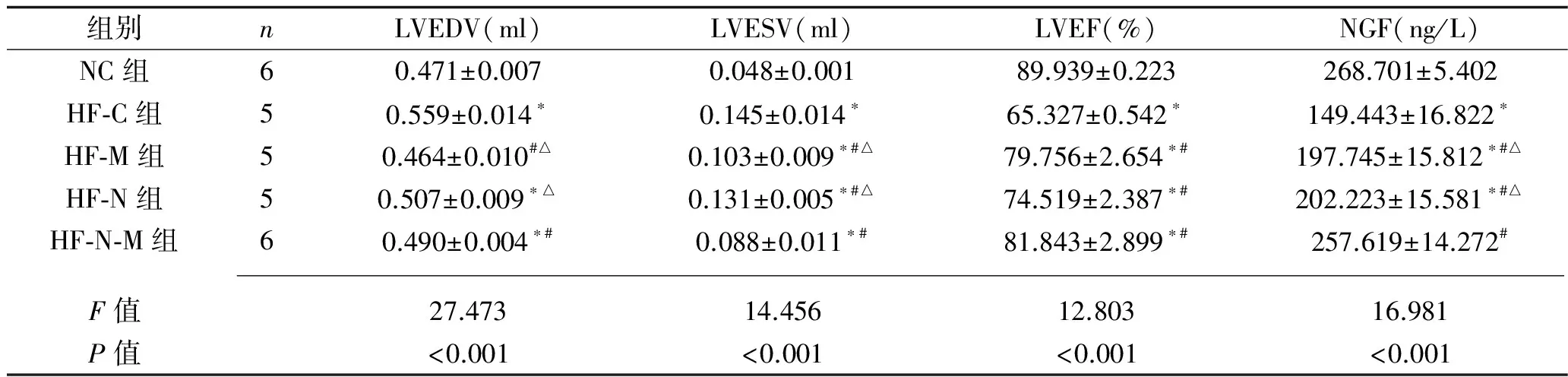
表2 各组大鼠治疗4周后心功能和NGF情况(x±s)
注:与NC组比较,*P<0.05;与HF-C组比较,#P<0.05;与HF-N-M组比较,△P<0.05。
2.3 心律失常诱发情况 在右室流出道以S1S2或S2S3刺激方法诱发室性心律失常时,NC组6只大鼠未诱发出明显室性心律失常(0.00%),HF-C组诱发出4只(80.00%),HF-M组(20.00%)、HF-N组(20.00%)和HF-N-M组(16.67%)各诱发出1只,所诱发的心律失常包括室性二联律、室颤、多形室速等,见图1。5组间的心律失常诱发率比较,差异有统计学意义(χ2=11.667,P=0.009),其中HF-C组室性心律失常诱发率明显高于其他组(P<0.05)。
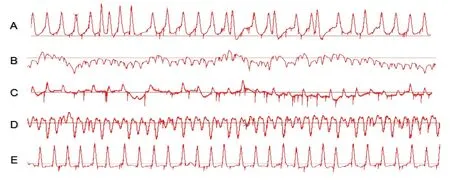
图1 心律失常诱发情况
A:二联律,B:室颤,C:室早合并房颤,D:多形室速,E为大致正常心电图。
2.4 5组大鼠TH mRNA、GAP43 mRNA、NGF mRNA表达情况 HF-C组的TH mRNA、GAP43 mRNA、NGF mRNA表达水平较NC组明显下降(P<0.05),HF-N组及HF-M组的TH mRNA、GAP43 mRNA、NGF mRNA表达水平均高于HF-C组(P<0.05);而HF-N-M组的TH mRNA、GAP43 mRNA、NGF mRNA的表达水平与HF-N组或HF-M组比较,差异无统计学意义(P>0.05),见表3。

表3 各组大鼠干预4周后TH mRNA、GAP43 mRNA、NGF mRNA的表达情况(x±s)
注:与NC组比较,*P<0.05;与HF-C比较,#P<0.05。
2.5 5组大鼠TH、GAP43、NGF蛋白的表达情况 HF组各亚组TH、GAP43、NGF蛋白的相对表达量均低于NC组(P<0.05),而HF-N组、HF-M组及HF-N-M组的TH、GAP43、NGF蛋白相对表达量均高于HF-C组(P<0.05);但HF-N-M组的TH、GAP43、NGF蛋白的相对表达量与HF-N组或HF-M组比较,差异无统计学意义(P>0.05),见表4和图2。
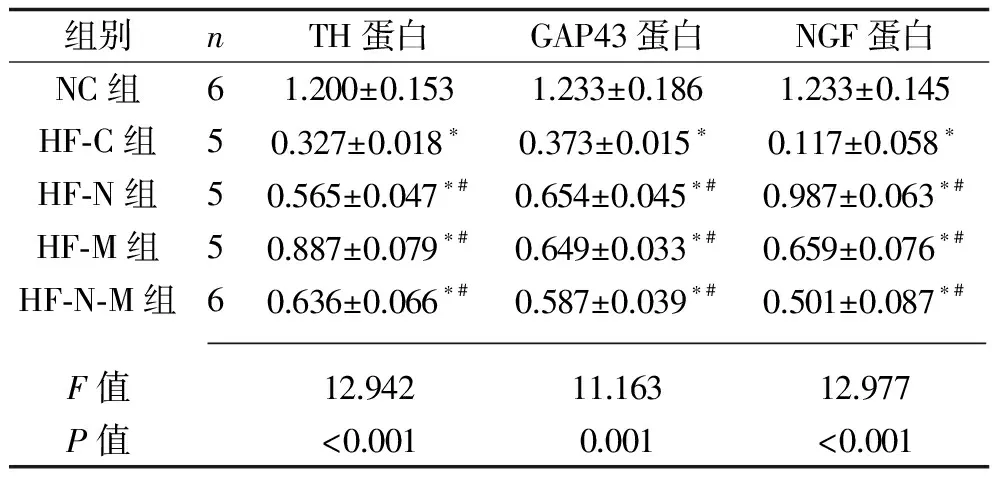
表4 各组大鼠治疗4周后TH、GAP43、NGF 蛋白相对表达量比较(x±s)
注:与NC组比较,*P<0.05;与HF-C比较,#P<0.05。
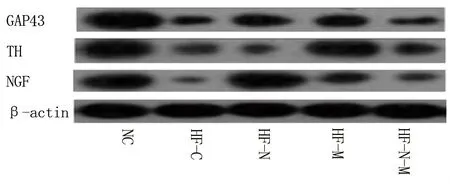
图2 治疗4周后5组的TH、GAP43、NGF蛋白表达情况
3 讨 论
多数学者认为HF患者出现神经重构后会导致恶性心律失常发生,尤其是室性心律失常,而且有可能会导致患者发生心源性猝死[12-14],由此可见其危害性。交感神经重构导致室性心律失常发生的具体机制还不明确,这可能是多种因素共同作用的结果,有学者推测交感神经重构与心肌电重构、组织重构的存在相互作用[3,6,13]。研究表明,HF患者在HF早期即出现心脏交感神经兴奋增加,心肌内去甲肾上腺素水平升高可以导致功能性交感神经去支配现象,表现为神经内去甲肾上腺素、酪氨酸羟化酶水平下降,神经重吸收去甲肾上腺素能力下降,去甲肾上腺素吸收载体-1密度降低,导致患者交感神经功能下降甚至死亡[15-16]。有研究证实血管紧张素转换酶抑制剂等可以使心力衰竭的交感神经去支配现象得到明显改善;β受体阻滞剂(如美托洛尔等)可以减少致命性心律失常发生、提高室颤阈值、减少猝死,这已得到广泛的认可,然而其具体机制仍然不清楚,可能与直接电生理作用(减慢心率、减少异位起搏点兴奋性、减慢传导和延长房室结不应期)和间接作用(减少交感驱动和心肌缺血,预防儿茶酚胺诱导的低钾血症等)等有关[17-20],但这还有待进一步研究。
TH和GAP43为判断交感神经重构较为常用的指标,二者在心梗或者HF后多表现为表达下调[3,6,10,13],在我们前期研究中已经发现TH和GAP43参与交感神经重构[21]。NGF为近年来研究发现的与HF密切相关的因子,主要表现为各种原因导致的HF后NGF表达下降,而经过一定治疗后可能会上调,能够刺激交感神经萌芽和重构,现也成为检测交感神经重构的指标之一[22-26]。本研究通过在基因和蛋白水平对交感神经重构指标TH、GAP43、NGF检测后发现,与NC组相比,HF-C组的TH、GAP43、NGF的表达明显降低(P<0.05),提示心力衰竭后TH、GAP43、NGF mRNA水平和蛋白表达会明显下降,说明HF后发生交感神经重构,且可能与TH、GAP43、NGF有关。而经过美托洛尔和NGF处理后,HF-M组、HF-N组和HF-N-M组TH、GAP43、NGF表达较HF-C组明显升高(P<0.05),提示运用NGF或者美托洛尔可以提高TH、GAP43、NGF蛋白的表达,然而,遗憾的是并没有观察到联合用药会明显改善TH、GAP43、NGF的表达。此外,通过心律失常诱发实验发现,NC组未诱发出明显室性心律失常,而HF-C组诱发率(80.00%)最高,而HF-M组(20.00%)、HF-N组(20.00%)及HF-N-M组(16.67%)的诱发率相似且明显降低,说明HF后心律失常易感性增加,而运用NGF或者美托洛尔后,可以降低室性心律失常发生率,然而联合运用并没有明显优势。
此外,采用NGF或(和)者美托洛尔干预4周后发现,与HF-C组比较,HF-M组、HF-N组和HF-N-M组LVEF及NGF表达明显升高,LVESV明显降低(P<0.05),说明经过美托洛尔或者NGF治疗后,HF大鼠心功能可改善,同时NGF表达也会升高。而且HF-N-M组的NGF水平均高于HF-M组和HF-N组,且LVESV明显降低(P<0.05),说明联合NGF和美托洛尔的效果优于单用NGF或者美托洛尔。然而,NGF和美托洛尔单独用于HF的治疗效果的优劣比较,还有待进一步研究。
综上所述,采用Wistar大鼠腹腔注射阿霉素可以成功建立HF模型,在HF后心律失常易感性增加,且TH、GAP43、NGF在基因和蛋白水平均较正常大鼠明显降低,说明HF后可发生交感神经重构,且可能与TH、GAP43、NGF有关;而经过NGF和美托洛尔治疗后,可以改善交感神经重构现象及心功能,降低心律失常诱发率。然而,本研究仅为小样本的动物模型研究,由于实验条件、给药剂量、动物本身异质性等因素,还需要进一步大样本、多方面研究以确定相关结论。
[1] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2014》概要[J].中国循环杂志,2015,30(7):617-622.
[2] Zhou M,Wang H,Zhu J,et al.Cause-specific mortality for 240 causes in China during 1990-2013:a systematic subnational analysis for the Global Burden of Disease Study 2013[J].Lancet,2016,387(10 015):251-272.
[3] 李书国.慢性心力衰竭大鼠的心脏交感神经重构及Carvedilol的保护作用研究[D].武汉:华中科技大学,2007.
[4] 王 樱,陈长勋.交感神经系统对心室重构的影响及中药对其的干预[J].中成药,2008,30(5):734-738.
[5] 胡嘉禄,颜 彦,侯月梅.干预交感神经治疗慢性心力衰竭研究[J].中华临床医师杂志:电子版,2013,7(24):11 739-11 741.
[6] 吴 双.心力衰竭时干预交感神经对心脏结构重构和交感神经重构的影响[D].哈尔滨:哈尔滨医科大学,2007.
[7] 李 舒,刘凤岐,马 丹,等.心区交感神经阻滞对慢性心力衰竭患者左心室重构及心功能的影响[J].中国超声医学杂志,2015,31(7):596-598.
[8] Qin F,Vulapalli RS,Stevens SY,et al.Loss of cardiac sympathetic neurotransmitters in heart failure and NE infusion is associated with reduced NGF [J].Am J Physiol Heart Circ Physiol,2002,282(1):H363-H371.
[9] Kimura K,Kanazawa H,Ieda M,et al.Norepinephrine-induced nerve growth factor depletion causes cardiac sympathetic denervation in severe heart failure [J].Auton Neurosci,2010,156(1-2):27-35.
[10]Sano H,Kasama S,Fujimoto S,et al.Effects of statin therapy on cardiac sympathetic nerve activity and left ventricular remodeling in patients with chronic heart failure:a propensity score-matched analysis [J].Medicine(Baltimore),2014,93(27):e214.
[11]Wang HJ,Wang W,Cornish KG,et al.Cardiac sympathetic afferent denervation attenuates cardiac remodeling and improves cardiovascular dysfunction in rats with heart failure [J].Hypertension,2014,64(4):745-755.
[12]Ma L,Cui B,Shao Y,et al.Electroacupuncture improves cardiac function and remodeling by inhibition of sympathoexcitation in chronic heart failure rats [J].Am J Physiol Heart Circ Physiol,2014,306(10):H1 464-H1 471.
[13]D′Elia E,Pascale A,Marchesi N,et al.Novel approaches to the post-myocardial infarction/heart failure neural remodeling [J].Heart Fail Rev,2014,19(5):611-669.
[14]Baker AJ.Adrenergic signaling in heart failure:a balance of toxic and protective effects [J].Pflugers Arch,2014,466(6):1 139-1 150.
[15]Florea VG,Cohn JN.The autonomic nervous system and heart failure [J].Circ Res,2014,114(11):1 815-1 826.
[16]Govoni S,Pascale A,Amadio M,et al.NGF and heart:Is there a role in heart disease?[J].Pharmacol Res,2011,63(4):266-277.
[17]韩 凌.交感神经系统在心力衰竭中的作用[J].临床和实验医学杂志,2015,14(4):343-345.
[18]徐 斌,李红莉.心力衰竭中交感神经激活的中枢机制[J].国际心血管病杂志,2015,41(5):308-310.
[19]张裕宝.β阻滞剂治疗慢性心力衰竭的应用进展[J].现代诊断与治疗,2015,26(3):510-511,551.
[20]罗苏敏.β受体阻滞剂在慢性心力衰竭治疗中的进展[J].中国继续医学教育,2015,7(7):247-248.
[21]Xin P,Pan Y,et al.Favorable effects of resveratrol on sympathetic neural remodeling in rats following myocardial infarction[J].Eur J Pharmacol,2010,649(1/3):293-300.
[22]曲秀芬,喜 杨,于彦伟,等.心肌梗死后神经生长因子的动态表达及其与交感神经重构的关系[J].中华心血管病杂志,2004,32(12):1 135-1 138.
[23]闫 文,金 鹏.心肌梗死后心脏交感神经重构与生长相关蛋白-43、神经生长因子(NGF)的研究进展[J].中国伤残医学,2013,21(8):461-463.
[24]徐振兴,李京波,魏 盟,等.美托洛尔对急性心肌梗死大鼠心肌神经生长因子表达和神经重构的影响[J].中华心律失常学杂志,2008,12(2):110-114.
[25]李书国,杨 俊,丁家望,等.慢性心力衰竭大鼠心肌神经生长因子表达及卡维地洛治疗的影响[J].中国医师杂志,2009,11(6):846-849.
[26]沈 丽,王 妍.神经生长因子的研究及应用进展[J].微生物学免疫学进展,2015,43(6):48-52.
Mechanism and intervention efficacy of metoprolol combined with nerve growth factor on sympathetic nerve remodeling after heart failure
LIANGZheng,CHENWen-jiang,HEZhong-kai,CHENCan
(DepartmentofCardiovascularMedicine,theAffiliatedHospitalofGuangdongMedicalCollege,Zhanjiang524001,China)
Objective To investigate the mechanism of sympathetic nerve remodeling after heart failure(HF),and to explore the intervention effect of metoprolol combined with nerve growth factor(NFG) on it.Methods A total of 40 Wistar rats were divided into HF group(n=34) and normal control group(NC group,n=6),and the modeling was conducted in HF group by intraperitoneal administration with adriamycin(4 mg/kg).After 6 weeks,the cardiac function was evaluated by echocardiography,and the plasma NGF level was detected.Then the survived rats in HF group were divided into control HF group(HF-C group,n=5),metoprolol group(HF-M group,n=5),NGF group(HF-N group,n=5),and NGF and metoprolol group(HF-N-M group,n=6).And mouse NGF was administered via caudal vein with a dose of 60 μg/(kg·d),and metoprolol via stomach with a dose of 0.25 mg/(kg·d) for 4 weeks.After 4 weeks of treatment,arrhythmia induction and cardiac function measurement were conducted,and the plasma level of NGF as well as the levels of tyrosine hydroxylase(TH),growth associated protein 43(GAP43) and NGF in cardiac tissues were detected.Results Compared to NC group,left ventricular end-diastolic volume(LVEDV) and left ventricular end-systolic volume(LVESV) increased significantly,left ventricular ejection fraction(LVEF) and plasma NGF level decreased significantly in HF group after modeling(P<0.05).Compared to HF-C group,LVEF and NGF level increased significantly,and LVESV decreased significantly in HF-M group,HF-N group and HF-N-M group after 4 weeks of treatment(P<0.05).Compared to HF-N group or HF-M group,NGF level increased,and LVESV decreased in HF-N-M group after 4 weeks of treatment(P<0.05).The expression levels of TH,GAP43 and NGF mRNA/protein in HF-C group,HF-M group,HF-N group and HF-N-M group were significantly lower than those in NC group(P<0.05).The expression levels of TH,GAP43,NGF mRNA/protein in HF-M group,HF-N group and HF-N-M group were significantly higher than those in HF-C group(P<0.05),but there was no significant difference between HF-N-M group and HF-M group or HF-N group(P>0.05).The induction rates of arrhythmia in NC group,HF-C group,HF-M group,HF-N group and HF-N-M group were 0,80.00%,20.00%,20.00% and 16.67% respectively.Conclusion Adriamycin can successfully induce HF model in Wistar rats.Sympathetic nerve remodeling is associated with TH,GAP43 and NGF.Metoprolol and NGF can improve sympathetic nerve remodeling and cardiac function,and reduce the incidence of arrhythmia after HF. 【Key words】 Heart failure,Sympathetic nerve remodeling,Cardiac function,Nerve growth factor,Metoprolol,Rat
广东省湛江市科技计划项目(2014B01082)
梁政(1979~),男,硕士,副主任医师,主要研究:心力衰竭发病机制及其防治。
R 541.6
A
0253-4304(2016)03-0313-06
10.11675/j.issn.0253-4304.2016.03.05
2015-12-12
2016-02-14)

