胰岛素样生长因子-1基因修饰骨髓基质细胞对大鼠脑缺血的神经保护作用▲
支东一 李 偲 吴 岚 刘开祥 李 浩
(桂林医学院附属医院神经内科,桂林市541001,E-mail:272740179@qq.com)
论著·基础研究
胰岛素样生长因子-1基因修饰骨髓基质细胞对大鼠脑缺血的神经保护作用▲
支东一 李 偲 吴 岚 刘开祥 李 浩
(桂林医学院附属医院神经内科,桂林市541001,E-mail:272740179@qq.com)
目的 探讨胰岛素样生长因子-1(IGF-1)基因修饰的骨髓基质细胞(MSCs)对大鼠脑缺血的神经保护作用及其机制。方法 健康雄性Wistar大鼠48只分为假手术组、缺血模型组、 MSCs组、MSCs-IGF-1组,每组12只。除假手术组外,其余组采用改良线栓法建立左侧大脑中动脉缺血再灌注模型。再灌注24 h后MSCs组、MSCs-IGF-1组分别采用MSCs、IGF-1修饰的MSCs干预治疗。每组于再灌注后3 d和14 d行神经功能缺损评分,采用免疫组化法测BrdU阳细胞数量,TUNEL法测大鼠神经细胞凋亡数量,分光光度计测脑组织超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。结果 再灌注14 d后MSCs组与MSCs-IGF-1组的神经功能缺损评分较缺血模型组明显降低(P<0.05),而MSCs-IGF-1组神经功能缺损评分低于MSCs组(P<0.05)。再灌注后3 d及14 d,假手术组与缺血模型组未见明显BrdU阳性细胞,MSCs-IGF-1组BrdU阳性细胞数较MSCs组明显增多(P<0.05)。再灌注后3 d及14 d,MSCs组与MSCs-IGF-1 组梗死半球神经细胞凋亡数目较缺血模型组相比明显减少(P<0.05),MSCs-IGF-1组比MSCs组凋亡细胞明显减少(P<0.05)。在灌注后3 d及14 d,与缺血模型组相比,MSCs组脑组织中SOD活性明显升高(P<0.05),MDA含量明显下降(P<0.05),且MSCs-IGF-1组SOD活性较MSCs组更高(P<0.05),MDA含量更低(P<0.05)。结论 IGF-1基因修饰骨髓基质细胞治疗干预比单纯骨髓基质细胞干预对脑缺血具有更好的神经保护作用,其机制可能与增强骨髓基质细胞的抗氧化应激能力、减少神经细胞凋亡有关。
脑缺血;骨髓基质细胞;胰岛素样生长因子1;大鼠;神经保护;基因修饰
骨髓基质细胞(marrow stromal cells,MSCs)是目前应用较多的外源性神经干细胞之一,其数量相对较多,较易采集,分化能力较强,整合性较好;具有潜在较强的多向分化性,其可分化为永久性的神经元和神经胶质细胞;将其移植入机体受损部位,可有效改善神经功能[1-2]。MSCs移植是已知的治疗大鼠局灶性脑缺血的有效方法。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)参与机体多种生理功能,是机体细胞增殖、分化和成熟过程中重要的一种细胞因子,不但对大脑生长、发育有重要的作用,而且能够诱导细胞分裂分化,调节细胞在体内的存活及迁移,并促进神经元和血管内皮细胞的增殖。本研究应用IGF-1 基因转染MSCs治疗大鼠局灶性脑缺血,采用5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU)标记MSCs行经尾静脉注射法移植,以探讨该疗法对移植细胞的存活及迁移、缺血脑组织中细胞凋亡的影响,以及对脑缺血的神经保护作用,为MSCs移植法治疗人类脑缺血疾病提供新的实验依据。
1 材料与方法
1.1 实验动物、主要试剂与仪器
1.1.1 主要试剂:胎牛血清(Gibco公司,批号16000-044),5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU;Sigma公司,批号B-5002),单克隆小鼠BrdU抗体(Sigma公司,批号B8434),Trizol试剂(美国Invitrogen公司,批号15596-026),载体DNA3.1(美国Invitrogen公司,批号5108),反转录试剂盒 (美国Invitrogen公司,批号18080-051),PCR引物 (美国Invitrogen公司,批号AM1005),大肠杆菌DH5α(上海生工公司,批号AY2022-1),限制性内切酶BamHⅠ及HindⅢ(Promega公司,批号R6041),质粒提取试剂盒(Omega biotek公司,批号D2156),LipofectAmine 2000 脂质体(美国Invitrogen公司,批号11668019),脱氧核苷酸末端转移酶介导的dUTP缺口末端标记[terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL]细胞凋亡检测试剂盒(德国Roche公司,批号11684817910),二喹啉甲酸(bicinchonininc acid,BCA)蛋白质浓度测定试剂盒(碧云天生物科技有限公司,批号P0010),链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)免疫组化试剂盒(Boster公司,批号SA1074)。
1.1.2 主要仪器:动物手术器械包(上海金钟医疗器械有限公司),双极电凝器(北京东方红剑医疗器械公司,型号CHR-V),CO2恒温培养箱(德国Heraeus公司,型号BB15),可调式微量移液器(德国Eppendorf 公司,型号3111),Labofuge 400R高速低温离心机(德国Heraeus公司),台式干燥箱[上海跃进医用光学器械厂,型号GZX-GF-MBS-Z(9123A)],电热恒温水浴箱(上海跃进医用光学器械厂,型号HH.WZ1.600S),-80℃超低温冰箱(德国SIEMENS公司,型号MYZNJ),双目显微镜(日本Olympus公司,型号IX70-SIFZ),2400型PCR扩增仪(Perkin-Elmer公司),蛋白垂直电泳系统 (美国Bio-Red公司,型号165-8001Mini-PROTEAN4),转移脱色摇床(海门其林贝尔仪器有限公司,型号TS-8),BIO-RAD iMARK酶标仪(美国Bio-Red公司,型号iMARK)。1.1.3 实验动物:(1)雄性Wistar大鼠10只,周龄6周,清洁级,体质量(180±20)g,购自桂林医学院实验动物中心,动物许可证:SCXK(桂)2009-0002。用于MSCs的提取。(2)雄性Wistar大鼠48只,周龄7~8周,清洁级,体质量(250±30)g,购自桂林医学院实验动物中心,动物许可证:SCXK(桂)2009-0002。采用颗粒型鼠粮喂养,饮用自来水,室温20℃左右。用于动物模型实验。
1.2 MSCs的提取、培养与标记 取雄性Wistar大鼠10只,术前称重,用10%水合氯醛(3 ml/kg)腹腔注射麻醉,无菌条件下取大鼠胫骨和股骨,去其干骺端。用含有15%胎牛血清的DMEM培养液冲洗骨髓,将冲洗出的骨髓轻轻吹打均匀。 按细胞悬液 ∶细胞分离液=3 ∶1比例2 500 r/min离心15 min,然后重悬为单细胞悬液。在37℃、5% CO2、饱和湿度、充足培养基条件下培养、扩增。待原代培养细胞铺满瓶底,达到80%融合时,用0.25%胰蛋白酶消化,按1 ∶2比例传代,传代细胞用含有10%胎牛血清的DMEM培养液继续培养,由于骨髓基质细胞容易老化,本实验经行尾静脉移植细胞选用第3~5 代传代细胞。在移植前,将MSCs 1 000 r/min离心5 min,制成单细胞悬液,按1×106个/ml接种于培养瓶,并加入BrdU进行标记。
1.3 基因工程MSCs-IGF-1的生成及鉴定 (1)从周龄6周的雄性Wistar大鼠肝脏组织中抽提总RNA:取新鲜组织100 mg,剪碎后加入1 ml Trizol溶液,孵育5 min,低温12 000 r/min离心15 min,去上清,加入75%乙醇,低温7 500 r/min离心5 min,干燥RNA沉淀,-20℃保存。(2)利用RT-PCR获取目的基因IGF-1互补DNA:总RNA反转录后得互补DNA,具体按反转录试剂盒说明书操作。经PCR扩增后凝胶电泳,割胶纯化。然后将该目的基因与质粒pcDNA3.1连接构建为重组质粒pcDNA3.1-IGF-1。(3)用氯化钙溶液制备大肠杆菌DH5α感受态细胞:挑取大肠杆菌DH5α菌落于37℃液体培养基中,待生长至对数期将菌液置于冰上,4℃ 8 000 r/min离心30 s,弃上清。用100 mmol/L的氯化钙溶液400 μl悬浮菌体10 min,4℃ 4 000 r/min离心5 min,弃上清。再把菌体悬浮在冰上预冷的氯化钙溶液中,此菌液即为感受态细菌。(4)将制备好的重组质粒加入感受态细胞进行转化。期间避免培养基温度过高,影响转化率。(5)先用氨苄西林抗性菌落初步培养,制备小量存活的转化体,采用BamHI与HindIII双酶切对转化体进行初步鉴定,酶切后进行测序鉴定:挑取菌株接种于5 ml含有50 μg/ml的氨苄西林的培养液中,37℃摇床中培养过夜,将培养后的菌液按照质粒提取试剂盒提取质粒,对含有目的片段的重组质粒进行全序列测定,测序结果通过Advanced BLAST2.0软件与GenBank中的大鼠IGF-1互补DNA系列进行分析。(6)然后摇菌大量扩增含有目的基因的重组质粒,SDS裂解法进行提取。构建重组质粒 p-EGFP-N1-IGF-1,分别利用酶切、PCR、测序等方法验证,以确定 IGF-1的真核表达载体是否构建成功。(7)基因转染时严格按照LipofectAm-ine2000脂质体使用说明书,将重组质粒pcDNA3.1-IGF-1转染骨髓基质细胞。
1.4 实验动物分组 术前12 h禁食不禁水。实验动物按随机数字表法分为假手术组、缺血模型组、MSCs组及MSCs-IGF-1组,每组12只。
1.5 大鼠局灶性脑缺血再灌注模型的建立 采用颈外动脉插入石蜡线栓栓塞法,建立大鼠局灶性大脑中动脉脑缺血再灌注模型。术前大鼠用10%水合氯醛(3 ml/kg)腹腔注射麻醉,取颈部正中皮肤切开,钝性分离左侧颈总动脉、左侧颈外动脉和左侧颈内动脉,此过程小心误伤迷走神经。用眼科剪在颈外动脉剪一“V”形小口,线栓由颈外动脉进入然后折向颈内动脉,缓慢插入线栓,直至遇到阻力不能插入为止,此时,线栓插入深度至颈动脉分叉处距离18~20 mm,线栓头达到左侧大脑中动脉起始部。2 h后拔线栓至颈外动脉实现再灌注。假手术组只分离血管,不行“V”形小口,不插入线栓。再灌注24 h后,MSCs组及MSCs-IGF-1组按1.0 ml/100 g体重行尾静脉注入法行MSCs移植,其中MSCs组行MSCs移植,MSCs-IGF-1组行等量IGF-1基因修饰的MSCs移植。缺血模型组再灌注24 h后经尾静脉注射等量生理盐水做对照。
1.6 观测指标及方法 分别在再灌注后7 d、14 d,每组选取6只大鼠进行指标的检测,其中3只用于BrdU阳性细胞检测及TUNEL法检测细胞凋亡,另3只用于超氧化物歧化酶(superoxide dismutase,SOD)活性与丙二醛(methane dicarboxylic aldehyde,MDA)含量测定。
1.6.1 神经功能缺损评分:按照 Longa等[3]评分标准,各组分别于再灌注3 d和14 d后行神经功能缺损评分。0分:正常,无神经功能缺损症状;1分:动物不能完全伸展右前肢;2分:动物右侧肢体瘫痪,行走时向右侧转圈,出现“追尾现象”;3分:动物行走跌倒或动物站立不能;4分:无自发活动,出现意识障碍。神经功能缺损评分为1~3分视为局灶性脑缺血再灌注模型成功建立,除假手术组外,评分为0分、4分及蛛网膜下腔出血大鼠予以剔除。
1.6.2 免疫组化测BrdU阳性细胞表达:每组于再灌注后3 d、14 d各取3只大鼠,10% 水合氯醛腹腔注射麻醉,打开老鼠的胸腔,充分显露心脏。然后依次用生理盐水及4%多聚甲醛心内快速滴注,待四肢伸直变硬后迅速断头取脑,切取以视交叉为中心、前后±2 mm的冠状面脑组织,用4%多聚甲醛固定。常规脱水包埋制片,冠状位切片。按照即用型SABC免疫组化试剂盒说明书,对标本进行免疫组化染色。光镜下观察,细胞核显示出特异性棕黄色即为BrdU阳性细胞。
1.6.3 TUNEL检测神经细胞凋亡:通过TUNEL法检测神经细胞凋亡情况。再灌注后3 d、14 d制作厚5 μm脑冠状面石蜡切片,步骤同“1.6.2”处免疫组化法,然后根据TUNEL试剂盒说明书,对标本进行神经凋亡细胞染色。其中细胞核内显示有棕黄色颗粒者为阳性凋亡细胞,每张切片于高倍镜视野(400×)下选取5个不重叠视野行凋亡细胞计数,其平均数即视为每张切片的阳性细胞数。
1.6.4 分光光度计测SOD活性、MDA含量:大鼠脑缺血再灌注模型制备成功后,每组随机选3只大鼠深度麻醉迅速断头取脑,取梗死侧(左侧)大脑半球,加入冰生理盐水,制成10%脑组织匀浆,低温3 000 r/min离心10 min、取上清液,BCA法测定蛋白质浓度,以上过程均在冰上操作。按照试剂盒说明书采用黄嘌呤氧化酶法行脑组织中SOD活性测定,硫代巴比妥酸法行MDA含量测定。
1.7 统计学分析 采用SPSS 17.0软件进行统计学分析,计量资料采用(x±s)表示,组间比较采用t检验,多样本均数比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结 果
2.1 MSCs的培养形态 MSCs接种初期,细胞种类较多,悬浮于培养基中,表面光滑、透亮,呈圆形或不规则形。3 d后即可出现细胞分裂现象,约1周细胞可铺满瓶底。传代至第2代细胞呈类似于成纤维细胞的长梭形,第3代以后细胞呈宽大扁平状。见图1、图2。

图1 原代MSCs(100×) 图2 第5代MSCs(100×)
2.2 神经功能缺损评分结果 与缺血模型组比较,再灌注3 d后MSCs组和MSCs-IGF-1组的神经功能缺损评分无明显差异(P>0.05);再灌注14 d后MSCs组与MSCs-IGF-1组的神经功能缺损评分较缺血模型明显降低(P<0.05),而MSCs-IGF-1组神经功能缺损评分低于MSCs组(P<0.05)。见表1。
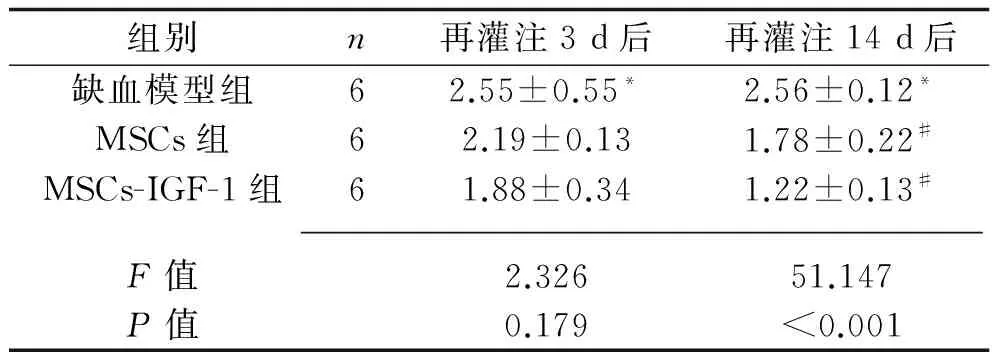
表1 神经功能缺损评分结果(x±s,分)
注:与缺血模型组比较,*P<0.05;与MSCs组比较,#P<0.05。
2.3 免疫组化测BrdU阳性细胞结果 假手术组与脑缺血模型组未见明显BrdU阳性细胞,MSC 组与MSCs-IGF-1组在大鼠梗死侧可见大量BrdU 阳性细胞,且在灌注后3 d及14 d,MSCs-IGF-1组BrdU 阳性细胞数目较MSCs 组明显增多(P<0.05)。见表2及图3、图4。
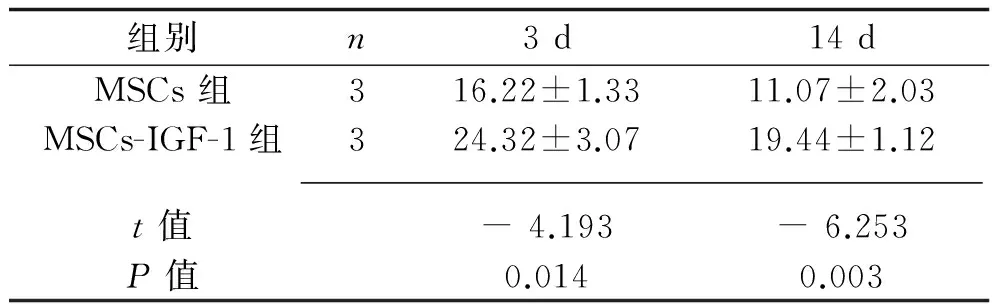
表2 BrdU阳性细胞数(x±s,个/HP)
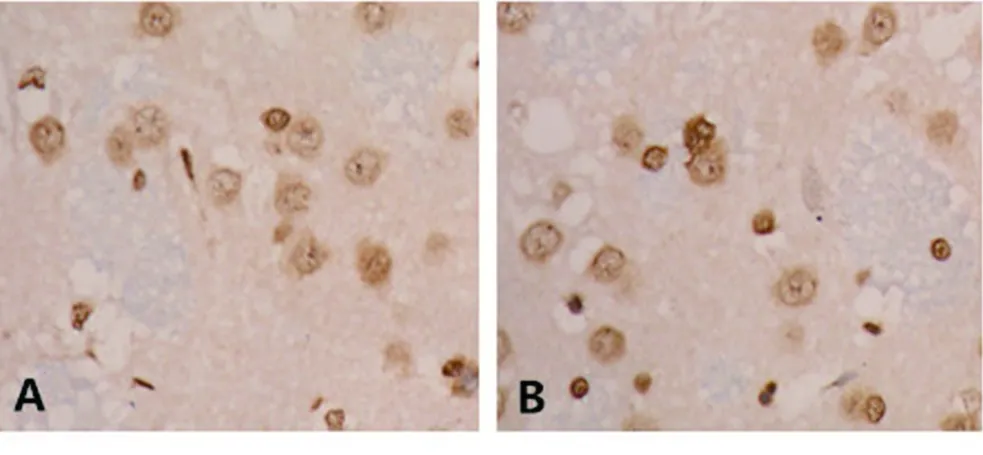

A MSCs组 B MSCs-IGF-1组图3 再灌注3 d后大鼠脑组织BrdU阳性细胞数(SABC染色,400×) A MSCs组 B MSCs-IGF-1组图4 再灌注14 d后大鼠脑组织BrdU阳性细胞数(SABC染色,400×)
2.4 TUNEL法测脑细胞凋亡结果 在灌注后3 d及14 d,缺血模型组大鼠病灶侧可见大量阳性凋亡脑细胞,较MSCs组、MSCs-IGF-1组明显增多(P<0.05);而MSCs-IGF-1组的脑细胞凋亡数量较MSCs 组明显减少(P<0.05)。见表3及图5、图6。
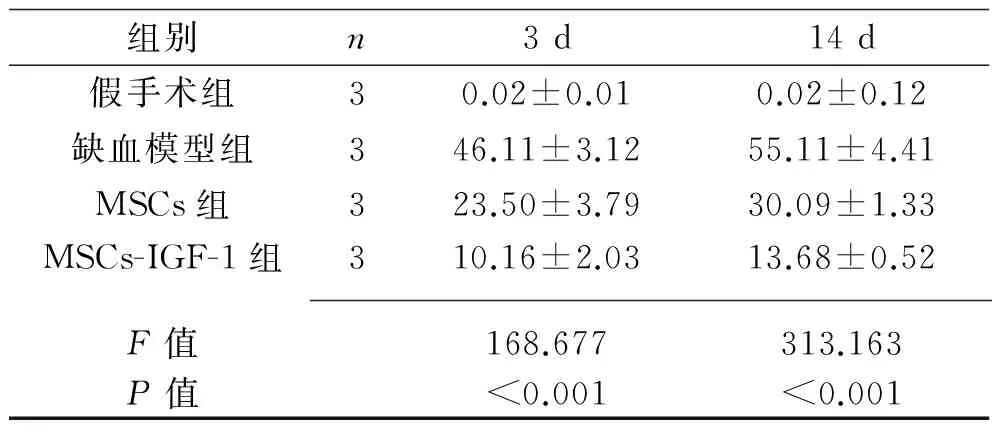
表3 各组脑组织凋亡细胞数量(x±s,个/HP)
注:各时间点,组间两两比较,P<0.05。

A 假手术组 B 缺血模型组

C MSCs组 D MSCs-IGF-1组
图5 再灌注3 d后大鼠脑细胞凋亡的结果(TUNEL,400×)
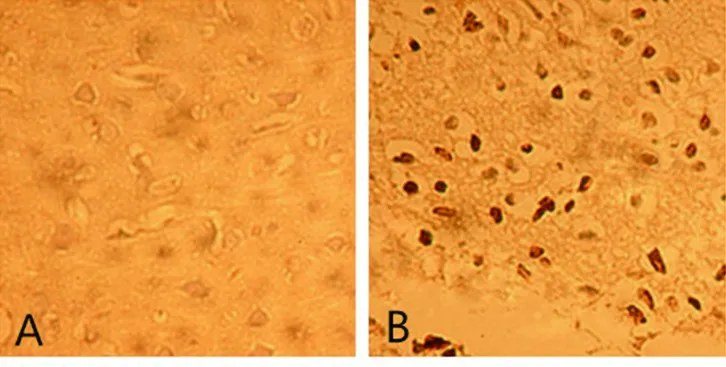
A 假手术组 B 缺血模型组

C MSCs组 D MSCs-IGF-1组
图6 再灌注14 d后大鼠脑细胞凋亡的结果(TUNEL,400×)
2.5 MDA和SOD检测结果 在灌注后各时间点,与假手术组比较,缺血模型组脑组织中SOD活性明显降低(P<0.05),MDA含量明显增加(P<0.05);与缺血模型组比较,MSCs组与MSCs-IGF-1组的SOD活性显著升高、MDA含量明显减少(P<0.05);与MSCs组比较,MSCs-IGF-1组脑组织中SOD活性更高(P<0.05),MDA含量更低(P<0.05)。见表4。
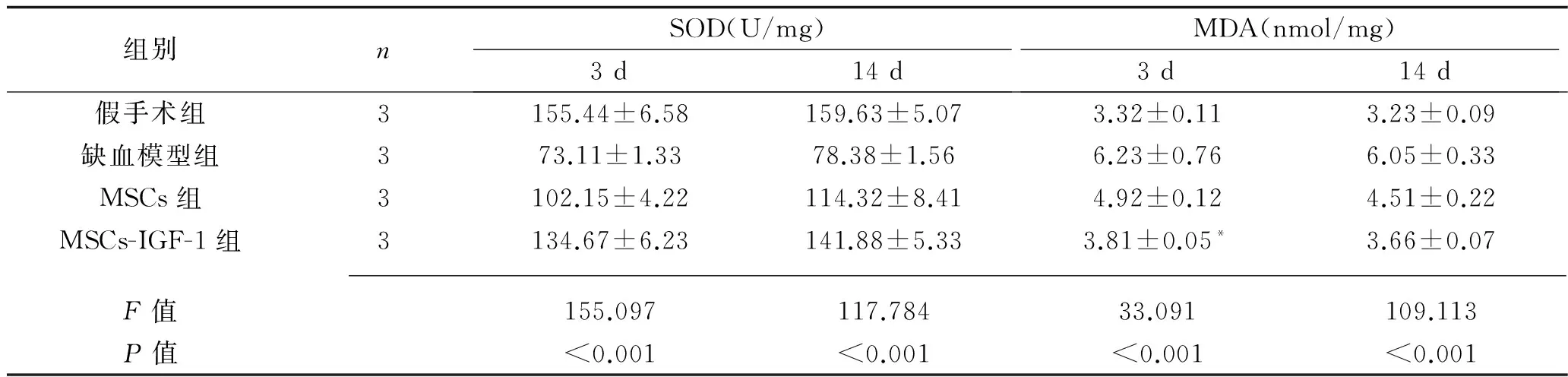
表4 各组MDA 与SOD检测结果(x±s)
注:与假手术组比较,*P>0.05,余各组间两两比较,P均<0.05。
3 讨 论
缺血性脑血管病是一种严重影响人类健康的常见病、多发病,其高致残率和致死率给家庭及社会带来沉重的负担[4]。改善脑缺血后的神经功能缺损、提高患者生活质量是目前神经病学研究的重点方面。本课题组前期实验表明,缺血组织再灌注主要通过释放大量炎性因子、引发神经细胞凋亡等方面造成神经功能缺损[5]。且应用远端肢体缺血后处理[6]的实验方法调动体内内源性保护通路来改善神经功能缺损取到了不错的效果。近年来,随着分子克隆和基因重组技术的逐渐成熟,神经干细胞治疗、基因工程治疗等新方法的出现,又为脑血管病的治疗提供了新思路。
MSCs是成体骨髓中的一类多能干细胞,具有分化成骨细胞、软骨细胞、脂肪细胞的潜能,亦可转分化成心肌细胞、神经细胞,从而替代损伤组织,修复机体功能缺损。相关研究表明,直接将MSCs移植入颅内,可明显促进治疗组神经功能的恢复,且病灶处的细胞存活、迁移及分化情况较对照组好[7-8]。另外,MSCs还可以促进血管再生[9],改善神经细胞生存环境,进一步加快神经功能恢复。因此,MSCs迅速成为临床研究重点。研究发现,单纯进行MSCs移植虽然有效,但是效果并不是十分理想[10]。目前,有研究采用基因工程技术,通过基因修饰使MSCs表达外源性基因,即在体外将编码神经营养因子、促生长因子、抗凋亡因子等的基因片段导入MSCs 中,并将基因修饰后的MSCs移植到受损部位,利用MSCs可在脑缺血的微环境中向神经细胞分化,促进各种神经营养因子分泌的特点[11-12],有效改善神经功能缺损。IGF是生长激素发挥生理作用过程中必需的一种活性蛋白多肽物质。现在已知的IGF包括IGF-1和IGF-2。IGF1是一类促进细胞生长、具有胰岛素样代谢效应的因子,可促进骨合成代谢,促进细胞有丝分裂、分化,并参与创伤修复等重要的生命过程。IGF-1同样存在于脑组织,是影响出生后大脑生长发育的一个重要调节因子[13]。相关研究表明,脑缺血后脑内IGF-1mRNA的表达增高,游离的IGF-1浓度上升,提示IGF-1可能有神经元保护作用[14]。不仅如此,IGF-1还能对神经细胞和血管内皮细胞的增殖、分化起到一定的诱导作用,并促进细胞的存活。这些研究结果提示IGF-1对神经系统的生长发育有重要作用。由于IGF-1分子量大,且血脑屏障的存在使常规静脉注射治疗效果不明显,采用脑内定向移植又加大了脑组织受损的风险,对技术操作要求较高。而基因治疗的方法可有效避免这些弊端,经基因修饰的干细胞移植,可使IGF-1在脑部持续表达,对于神经损伤的修复非常有利。本实验选用IGF-1基因修饰MSCs来治疗局灶性脑缺血模型大鼠,结果显示,再灌注14 d后MSCs组与MSCs-IGF-1组的神经功能缺损评分较缺血模型明显降低(P<0.05),而MSCs-IGF-1组神经功能缺损评分低于MSCs组(P<0.05),提示与MSCs组比较,IGF-1转染MSCs治疗组大鼠可显著改善大鼠神经功能,表明IGF-1 基因转染MSCs治疗脑缺血的疗效明显优越于单纯MSCs治疗。
氧化应激反应是脑缺血造成神经损伤的主要病理生理学机制之一。脑组织缺血后,可产生大量氧自由基,引起线粒体损害和细胞水肿,促进蛋白质DNA链断裂,引起神经细胞功能、结构等一系列改变[15]。因此,本研究从氧化应激反应方面探讨了MSCs移植发挥神经保护功能的作用机制。MDA是脂质过氧化代谢的最终产物,其含量可反映组织过氧化程度及细胞损伤的程度。SOD是超氧阴离子的天然杀手,能及时修复受损细胞,复原因自由基造成的细胞损害,SOD在生物体内的水平是机体抗氧化能力的直观指标之一。Valle-Prieto等[16]的研究发现体外MSCs可以增强SOD和谷胱甘肽过氧化物酶的活性,有效清除体内活性氧和活性氮物质,限制氧化应激造成的组织损伤。本实验结果显示,与缺血模型组比较,MSCs组SOD活性明显升高,MDA含量明显下降(P<0.05),说明MSCs具有一定的抗氧化应激作用,从而可减轻神经功能损害。此外,本文结果亦显示MSCs-IGF-1组在MSCs基础上,SOD活性进一步增加(P<0.05),MDA含量进一步减少(P<0.05),说明了MSCs经基因修饰后增强了其单独移植的抗氧化应激能力。本研究还检测了标记MSCs BrdU阳性细胞数,结果显示,再灌注后3 d和14 d,MSCs-IGF-1组BrdU阳性细胞数均较MSCs组明显升高(P<0.05),说明了IGF-1基因具有促进MSCs移植后的存活及迁移的作用。神经细胞凋亡是继发神经系统受损后的一个常见转归,也是造成神经功能缺损的一个重要因素。本文结果显示,再灌注后3 d和14 d,MSCs-IGF-1组的神经细胞凋亡数量均较MSCs组明显减少,原因可能是IGF-1基因本身具有一定的抗凋亡作用,也可能是MSCs经IGF-1基因修饰后促进了其在脑内的迁移及分化,从而加强了自身的抗细胞凋亡能力。
综上所述,经IGF-1基因转染后MSCs比其单独移植对脑缺血后的神经恢复具有更好的疗效。其机制可能是因为IGF-1基因修饰可促进MSCs的存活及迁移分化,并增强其抗氧化应激和抗细胞凋亡能力,从而发挥神经保护作用。
[1] Penny J,Harris P,Shakesheff KM,et al.The biology of equine mesenchymal stem cells:phenotypic characterization,cell surface markers and multilineage differentiation[J].Front Biosci(Landmark Ed),2012,17:892-908.
[2] Wakabayashi K,Nagai A,Sheikh AM,et al.Transplantation of human mesenchymal stem cells promotes functional improvement and increased expression of neurotrophic factors in a rat focal cerebral ischemia model[J].J Neurosci Res,2010,88(5):1 017-1 025.
[3] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4] Smith WS,Sung G,Starkman S,et al.Safety and efficacy of mechanical embolectomy in acute ischemic stroke:results of the MERCI trial[J].Stroke,2005,36(7):1 432-1 438.
[5] 李 浩,张多斌,吴 岚,等.丹参酮ⅡA对脑缺血再灌注损伤大鼠磷酸化p38MAPK和MMP-9表达及细胞凋亡的影响[J].中风与神经疾病杂志,2013,30(3):229-233.
[6] Li H,Zhou S,Wang L,et al.The role of p38MAPK signal pathway in the neuroprotective mechanism of limb postconditioning against rat cerebral ischemia-reperfusion injury[J].J Neurol Sci,2015,357(1-2):270-275.
[7] Chen C,Cheng Y,Chen J.Transfection of Noggin in bone marrow stromal cells(BMSCs) enhances BMSC-induced functional outcome after stroke in rats[J].J Neurosci Res,2011,89(8):1 194-1 202.
[8] Lu H,Liu X,Zhang N,et al.Neuroprotective effects of brain-derived neurotrophic factor and noggin-modified bone mesenchymal stem cells in focal cerebral ischemia in rats[J].J Stroke Cerebrovasc Dis,2016,25(2):410-418.
[9] Shinozuka K,Dailey T,Tajiri N,et al.Stem Cells for Neurovascular Repair in Stroke[J].J Stem Cell Res Ther,2013,4(4):12 912.
[10]Hanabusa K,Nagaya N,Iwase T,et al.Adrenomedullin enhances therapeutic potency of mesenchymal stem cells after experimental stroke in rats[J].Stroke,2005,36(4):853-858.
[11]Ding J,Cheng Y,Gao S,et al.Effects of nerve growth factor and Noggin-modified bone marrow stromal cells on stroke in rats[J].J Neurosci Res,2011,89:222-230.
[12]Jablonska A,Lukomska B.Stroke induced brain changes:Implications for stem cell transplantation[J].Acta Neurobiol Exp (Wars),2011,71(1):74-85.
[13]Carlson SW,Madathil SK,Sama DM,et al.Conditional overexpression of insulin-like growth factor-1 enhances hippocampal neurogenesis and restores immature neuron dendritic processes after traumatic brain injury[J].J Neuropathol Exp Neurol,2014,73(8):734-746.
[14]Dentil,Banchini A,Caporotundo S,et al.IGF system in acute ischemic stroke [ J ].J Endocrinal Invest,2002,25(10):55-56.
[15]Yoo SJ,Nakra NK,Ronnett GV,et al.Protective Effects of Inducible HO-1 on Oxygen Toxicity in Rat Brain Endothelial Microvessel Cells[J].Endocrinol Metab(Seoul),2014,29(3):356-362.
[16]Valle-Prieto A,Conget PA.Human mesenchymal stem cells ffciently manage oxidative stress[J].Stem Cells Dev,2010,19:1 885-1 893.
Effect of insulin-like growth factor-1 gene-modified marrow stromal cells on neurological protection in rats with cerebral ischemia
ZHIDong-yi,LICai,WULan,LIUKai-xiang,LIHao
(DepartmentofNeurology,theAffiliatedHospitalofGuilinMedicalCollege,Guilin541001,China)
Objective To explore the effect of insulin-like growth factor-1(IGF-1)gene-modified marrow stromal cells(MSCs) on the neurological protection in rats with cerebral ischemia,and to investigate the mechanism.Methods Forty-eight healthy male Wistar rats were divided into sham group,ischemia model group,MSCs group,MSCs-IGF-1 group,with 12 rats in each group.The ischemia-reperfusion model of left middle cerebral artery was established by using the modified embolism line methods in all groups except for the sham group.MSCs group and MSCs-IGF-1 group were treated with MSCs and IGF-1-modified MSCs respectively after 24 hours of reperfusion.At 3 and 14 days after reperfusion,neurological deficit scores were assessed,the amount of BrdU-positive cells was detected by immunohistochemistry,the apoptosis neural cells were detected by TUNEL method,and the superoxide dismutase(SOD) activity and methane dicarboxylic aldehyde(MDA) level of brain tissues were measured by spectrophotometer.Results At 14 days after reperfusion,the neurological scores of MSCs group and MSCs-IGF-1 group were significantly lower than that of ischemia model group(P<0.05),and the score of MSCs-IGF-1 group was significantly lower than that of MSCs group(P<0.05).At 3 and 14 days after reperfusion,the cells with significantly positive BrdU were not observed in the sham group and ischemia model group,and the cells with positive BrdU of MSCs-IGF-1 group were significantly more than those of MSCs group(P<0.05).At 3 and 14 days after reperfusion,the amount of nerve cell apoptosis in the infarct hemisphere was significantly lower in MSCs group or MSCs-IGF-1 group compared to that in the ischemia model group(P<0.05),and the amount in the MSCs-IGF-1 group was significantly lower than that in the MSCs group(P<0.05).At 3 and 14 days after reperfusion,MSCs group obtained significantly higher SOD activity and lower MDA level in the brain tissues compared to ischemia model group(P<0.05).And MSCs-IGF-1 group had higher SOD activity and lower MDA level compared to MSCs group(P<0.05).Conclusion IGF-1 gene-modified MSCs has a superior neurological protection effect on cerebral ischemia compared to MSCs alone,and the mechanism might be related to strengthening the ability of resisting oxidative stress of MSCs and reducing the number of apoptosis cells.
Cerebral ischemia,Marrow stromal cells,Insulin-like growth factor-1,Rat,Neurological protection,Gene-modified
广西自然科学基金(2013GXNSFAA019190);广西研究生教育创新计划资助项目(YCSZ2014207);广西医药卫生科研课题(Z2013480)
支东一(1989~),女,在读硕士研究生,研究方向:脑血管病。
李浩(1975~),男,在读博士研究生,教授,研究方向:脑血管病,E-mail:1871412324@qq.com。
R 743.31
A
0253-4304(2015)01-0001-06
10.11675/j.issn.0253-4304.2015.01.01
2015-10-21
2016-01-07)

