乳品中热带假丝酵母菌的双抗夹心ELISA快速检测方法
常 江,刘 熙,柳增善,任洪林,卢士英,胡 盼,李岩松,盖冬雪,金 雯,张 嵩,孟宪梅
(1.人兽共患病研究教育部重点实验室,吉林大学人兽共患病研究所,吉林大学动物医学学院,吉林长春 130062;2.吉林工商学院粮油食品深加工吉林省高校重点实验室,吉林长春 130507; 3.广泽乳业有限公司,吉林长春 130102)
乳品中热带假丝酵母菌的双抗夹心ELISA快速检测方法
常 江1,2,刘 熙3,柳增善1,*,任洪林1,卢士英1,胡 盼1,李岩松1,盖冬雪1,金 雯1,张 嵩1,孟宪梅2,*
(1.人兽共患病研究教育部重点实验室,吉林大学人兽共患病研究所,吉林大学动物医学学院,吉林长春 130062;2.吉林工商学院粮油食品深加工吉林省高校重点实验室,吉林长春 130507; 3.广泽乳业有限公司,吉林长春 130102)
本研究用于乳品中热带假丝酵母菌的快速检测。采用热带假丝酵母菌超声破碎后的上清蛋白作为免疫原分别免疫新西兰大耳白兔和Hartley豚鼠,获得热带假丝酵母菌的多克隆抗体。以兔抗体作为捕获抗体,豚鼠抗体作为检测抗体,通过矩阵法及正交分析建立乳品中热带假丝酵母菌快速、特异的双抗夹心ELISA检测方法。该方法检出限为98 ng/mL,板内变异系数小于2%,板间变异系数小于6%,特异性及重复性良好。实际样品检测中,通过对乳制品进行滤膜集菌并选择性增菌培养,超声后提取的蛋白上清应用本研究建立的双抗夹心ELISA检测方法,100 CFU/mL热带假丝酵母菌可在22 h内准确检测出阳性反应。
乳品,热带假丝酵母菌,双抗夹心ELISA,快速检测,选择性增菌,滤膜集菌
热带假丝酵母菌(Candidatropicalis)是一种腐物寄生的真菌微生物,广泛存在于乳制品、水果、蔬菜中,并可存在于人体皮肤、阴道等部位。该菌大小约为3~6 μm,对环境条件的抗性较强,对热的抵抗力不强,有假菌丝和厚壁孢子,是常见的条件致病菌[1]。近年来发现,由热带假丝酵母菌引起的奶牛乳房炎病例不断增多[2]。该种乳房炎在临床诊断中多不易查明,因而用药缺乏针对性。临床上对奶牛乳房炎的治疗多使用抗生素,但长期使用抗生素对真菌性乳房炎治疗无效并可导致病情恶化,[3]使奶牛产奶量急剧下降,造成重大的经济损失[4]。常规的培养检测方法主要有国标法和荧光定量方法。国标法对酵母菌的检测需要5~7 d,耗时长,操作繁琐;荧光定量方法虽耗时短,但成本较高,操作环境要求严格[5]。本研究建立乳品中热带假丝酵母菌的双抗夹心ELISA检验方法,能够快速、准确、特异地检验出热带假丝酵母菌含量,对真菌性乳房炎的发生和治疗具有重要意义。

表1 因素水平设计
1 材料与方法
1.1 材料和仪器
新西兰大耳白兔、Hartley豚鼠 吉林大学白求恩医学院动物实验中心,生产许可证号:SCXK-(吉)2012-0002;弗氏完全佐剂、弗氏不完全佐剂、卡那霉素、氨苄青霉素、Tween-20 Sigma公司;山羊抗兔IgG/辣根酶标记 博士德公司;山羊抗豚鼠IgG/l辣根酶标记 博奥森公司;A型辣根过氧化物酶标记试剂盒 Galaxy公司;TMB显色液、PDA培养基 本实验室制备;不同厂家生产或不同种类乳制品及酸乳制品 购自吉林省长春市零售超市;热带假丝酵母菌(Candida tropicalis)、马克斯克鲁维酵母菌(Kluyveromyces marxianus)、库德里阿兹威毕赤酵母菌(Pichi kudrivzevii)、阪崎杆菌(Bntorobater sakazakii)、中间葡萄球菌(Staphylococcus pseudintermedius)、大肠杆菌(Escherichia coli)、肠炎沙门氏菌(Salmonellaenteritidis) 吉林大学人兽共患病研究所细菌实验室保藏。
AKTA 100蛋白纯化仪 美国GE公司;Epoch酶标仪 美国Bio-Tek仪器有限公司;DHP120恒温培养箱 上海实验仪器厂有限公司;AIRTECH生物安全柜 苏州安泰空气技术有限公司;HZQ-X100振荡培养箱 哈尔滨市东联电子技术开发有限公司;微孔板振荡器 德国IKA公司;Allegra X-22R离心机 德国贝克曼库尔特有限公司;Nanodrop 2000微量紫外分光光度计 美国Thermo生物有限公司;超声波细胞破碎仪 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 免疫原的制备 复苏本实验室保藏的热带假丝酵母菌株,接种于PDA培养基中,28 ℃振荡24 h,8000 r/min离心10 min收集菌体。洁净的PBS洗涤三次后重悬菌沉淀,超声波细胞破碎仪破碎菌悬液,参数设置为:总时间50 min,作用4 s,间歇2 s,功率70%。超声后8000 r/min离心取上清可溶性蛋白[5],Bradford法[6]检测蛋白浓度。
1.2.2 兔多克隆抗体的制备与效价测定 雌性新西兰大耳白兔(2.37 kg)1只,耳缘静脉采血后收集阴性血清备用。首次免疫原量为1 mg,皮下多点注射,之后每两周追加免疫一次。每次免疫后1周测定效价,至第五次免疫1周后心脏采血。效价测定使用间接ELISA方法,包被10 μg/mL抗原,对检测血清和阴性血清分别倍比稀释,结果以检测血清OD值/阴性血清OD值(P/N)≥2.1为指标判定兔多克隆抗体的效价[7]。
1.2.3 豚鼠多克隆抗体的制备与效价测定 SPF级Hartley豚鼠(约750 g)2只,免疫原量为500 μg,免疫程序与效价测定同1.2.2。
1.2.4 抗体的纯化与辣根酶(HRP)的标记 用HiTrap Protein G HP亲和层析柱纯化抗血清[8]。纯化后的抗体加入透析袋,经PBS(pH=7.2)透析48 h,每6 h换液一次[9]。透析完成后,放入PEG-2000浓缩体积至2 mL。纯化后的抗体经SDS-PAGE电泳验证纯化效果,并用Bradford法[6]检测抗体浓度。采用A型辣根过氧化物酶标记试剂盒制备酶标抗体,紫外分光光度计测量A403 nm/A280 nm,计算HRP标记率(LR)[10]。
1.2.5 双抗夹心ELISA方法的初步建立 纯化的兔抗体用碳酸盐缓冲液1∶100、1∶200、1∶300、1∶400、1∶500、1∶600稀释后包被于酶标板,每孔100 μL,37 ℃温浴2 h后,0.1% PBST洗涤3遍,每遍1 min。加入封闭液,每孔200 μL,37 ℃温浴1 h,洗板3遍。加入抗原10 μg/mL,每孔100 μL,37 ℃温浴1 h,洗板3遍。豚鼠HRP标记抗体用PBS分别1∶200、1∶300、1∶400、1∶500、1∶600、1∶700稀释,每孔100 μL,37 ℃温浴1 h,洗板4遍后TMB显色液,终止反应后测量450 nm处的OD值。
1.2.6 双抗夹心ELISA方法的条件优化 利用L8(25)和L18(35)正交表对包被时间、封闭液选择、抗原稀释液选择、检测抗体稀释液选择进行优化,根据SPSS分析选择ELISA反应的最适条件,正交实验[12]设计见表1。
1.2.7 双抗夹心ELISA方法检出限的确定 将热带假丝酵母菌菌体蛋白从300 μg/mL倍比稀释至36.62 ng/mL,根据1.2.6优化的ELISA反应条件,以抗原浓度对数为横坐标,P/N为纵坐标,选择P/N≥2.1的点绘制标准曲线[13],确定本方法的检出限。
1.2.8 双抗夹心ELISA方法的特异性检测 无菌条件下将热带假丝酵母菌、马克斯克鲁维酵母菌、库德里阿兹威毕赤酵母菌、阪崎杆菌、中间葡萄球菌、大肠杆菌、沙门氏菌接种于PDA培养基中,在28 ℃下振荡培养24 h,按照1.2.1方法得到破碎后的全蛋白稀释至2 μg/mL,以上述各菌菌体蛋白作抗原,检测双抗夹心ELISA方法的特异性[14]。
1.2.9 双抗夹心ELISA方法的重复性检测 分别检测本实验的板内重复性和板外重复性[15],板内重复5次,板间重复4次。板内重复性:同一块酶标板随机抽取5条酶标反应条,每条随机选取4个酶标反应孔,用建立的双抗夹心ELISA方法检测不同浓度的菌体蛋白,读值后计算同一浓度下各孔间的变异系数。板间重复性:随机抽取4个酶标反应板,每板选择3个酶标反应孔,计算同一抗原浓度下各板间的变异系数。
1.2.10 热带假丝酵母菌的选择性增菌培养 在PDA培养基中分别加入0.1%的卡纳青霉素和0.1%的氨苄青霉素,分别接种100 CFU/mL热带假丝酵母菌、100 CFU/mL热带假丝酵母菌和100 CFU/mL大肠杆菌混合菌、100 CFU/mL热带假丝酵母菌和100 CFU/mL中间葡萄球菌混合菌,培养温度为28 ℃,培养转速为220 r/min[16]。绘制时间与菌液OD600值之间的生长曲线图,检测选择性增菌培养对细菌的抑菌效果。重复5次,计算经选择性增菌培养后,不同时间点菌液OD600之间的变异系数,检验热带假丝酵母菌在选择性培养基中的生长重复性。
1.2.11 乳品样品的检测 本实验样品选取10种市售牛奶及酸乳制品,用建立的方法检测其中热带假丝酵母菌含量。对乳品灭菌后进行加标回添实验,分别接种30、100 CFU/mL热带假丝酵母菌于1 mL灭菌乳品样品中,用0.9%的无菌氯化钠注射液稀释至10 mL。取直径1.2 cm、口径2 μm无菌滤膜[16]放入灭菌后的可换式集菌培养滤器中,将样品稀释液通过集菌培养滤器,滤净后用10 mL 0.9%的无菌氯化钠注射液冲洗一遍。无菌操作下取出滤膜,加入含有5 mL选择性PDA培养基中培养[17]。增菌培养22 h后吸出菌悬液4 mL并离心收集菌体,用无菌PBS冲洗2遍后重悬至2 mL,超声破碎菌体,操作同1.2.1。以30 CFU/mL和100 CFU/mL的接菌量在乳品中接菌,用建立的双抗夹心ELISA方法检测,28 ℃下以220 r/min振荡培养,检测菌体蛋白可检测出的准确阳性值。
1.3 数据处理
使用Excel对原始数据进行初步分析,用GraphPad Prism 5对数据进行图形处理。正交分析采用SPSS软件,模拟正交分析表,并对数据进行单因素主效应方差分析。
2 结果与分析
2.1 兔抗血清效价测定
采用间接ELISA测定兔4免后抗血清效价,结果如图1,以该兔免疫前血清为阴性对照,此时效价约为64000。

图1 兔抗血清效价曲线Fig.1 Titer cure of rabbit antisera
2.2 豚鼠抗血清效价测定
采用间接ELISA测定2只豚鼠4免后抗血清效价,结果如图2,以豚鼠免疫前血清为阴性对照,此时2只豚鼠效价均约为51200。

图2 豚鼠抗血清效价曲线Fig.2 Titer cure of guinea pig antisera
2.3 抗体的纯化与辣根酶(HRP)标记
HiTrap Protein G HP亲和层析柱分别纯化兔抗体和豚鼠抗体,SDS-PAGE电泳检验两种抗体的纯化效果,结果如图3。经A型辣根过氧化物酶标记试剂盒标记后,检测标记率为0.724,可以正常使用[10]。
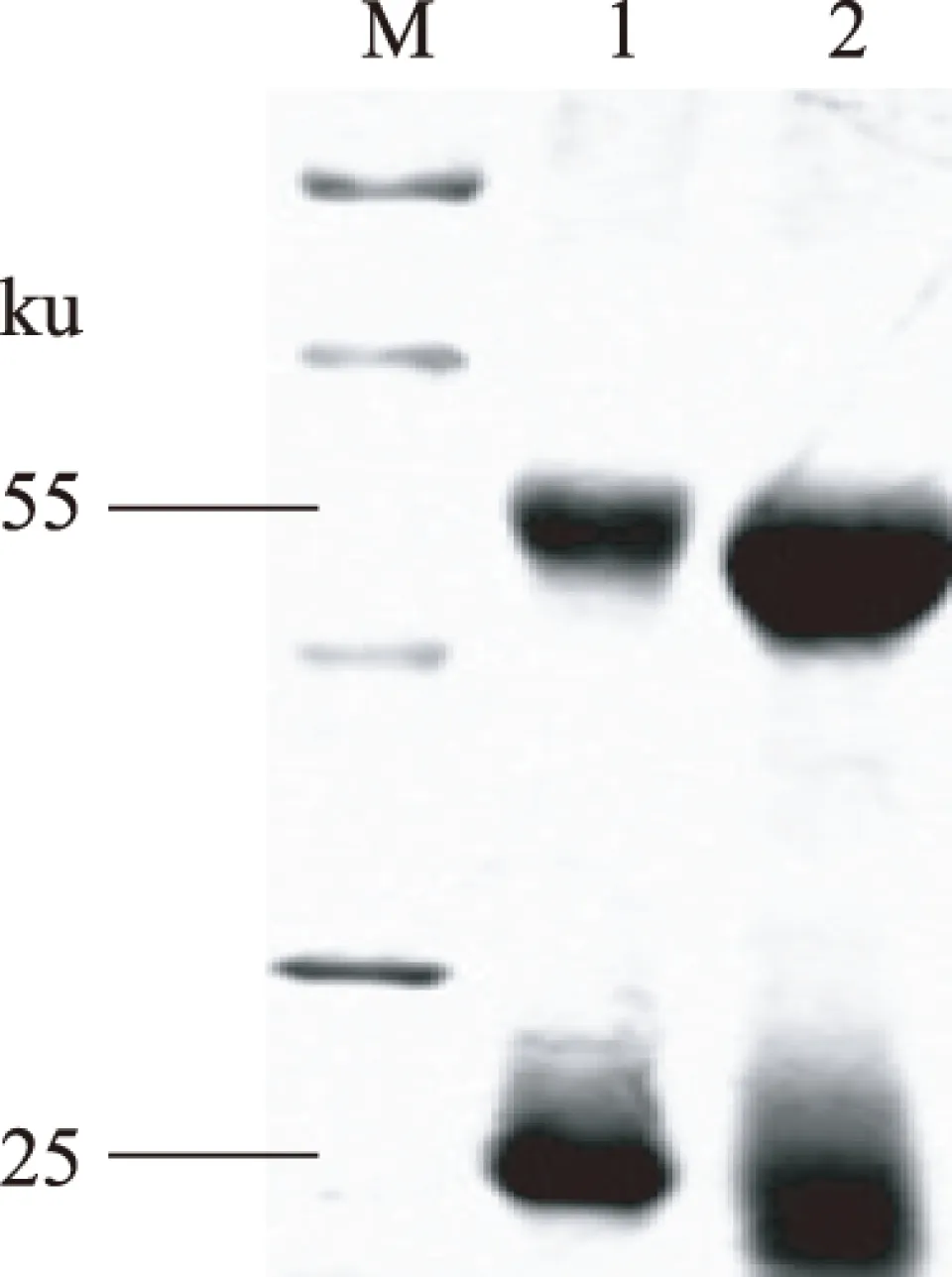
图3 抗体纯化结果Fig.3 Results of antibody purification注:M:Marker;1:兔多抗;2:豚鼠多抗。
2.4 最佳抗体对稀释倍数的确定
通过棋盘法确定两种抗体的最佳稀释倍数,由表2可见,兔多抗稀释200倍作为捕获抗体,酶标豚鼠多抗稀释400倍作为检测抗体时P/N值最大,选择兔抗体200倍稀释、豚鼠抗体400倍稀释作为抗体对的最佳稀释倍数。
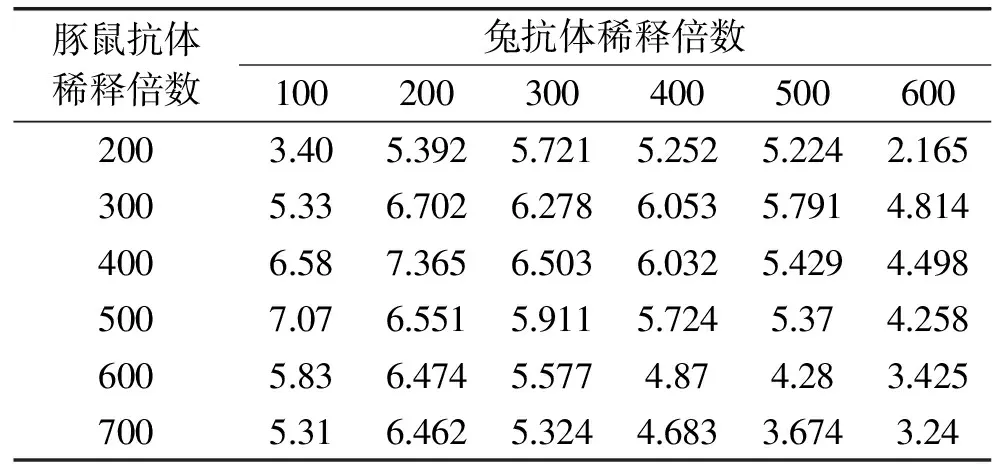
表2 棋盘法对最佳抗体对稀释倍数的细致摸索
2.5 双抗夹心ELSIA方法的条件优化
通过正交实验优化反应条件,每个处理有3个重复。表3优化了兔抗体包被条件、封闭条件、抗原结合条件、豚鼠抗体检测条件,正交实验结果见表4。根据结果可以说明,封闭条件、豚鼠抗体稀释液对P/N的影响显著,其余因素影响不显著,结合减少反应时间的原则,选择A1B1C1D2处理为最优条件,即最佳反应条件为:37 ℃包被1 h,NH4Cl封闭1 h,PBS稀释抗原结合1 h,1%脱脂奶粉稀释检测抗体反应1 h。
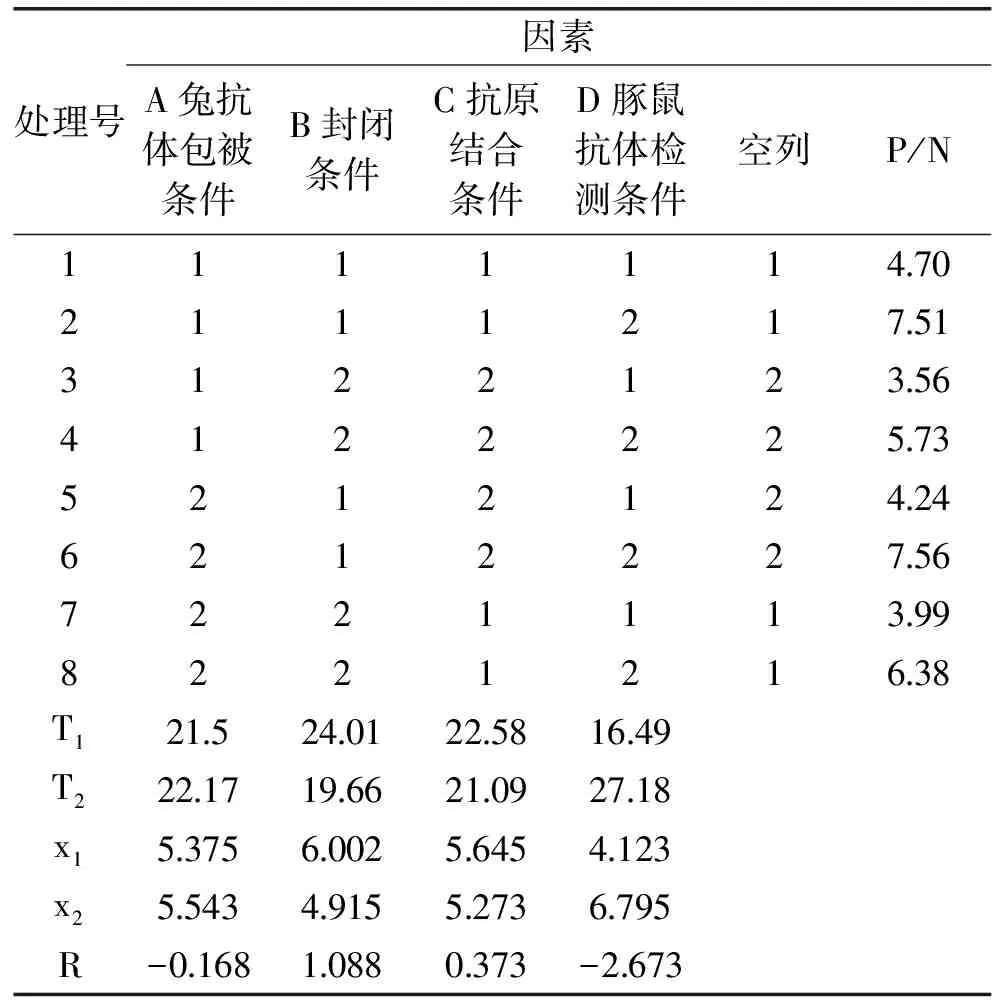
表3 正交实验结果
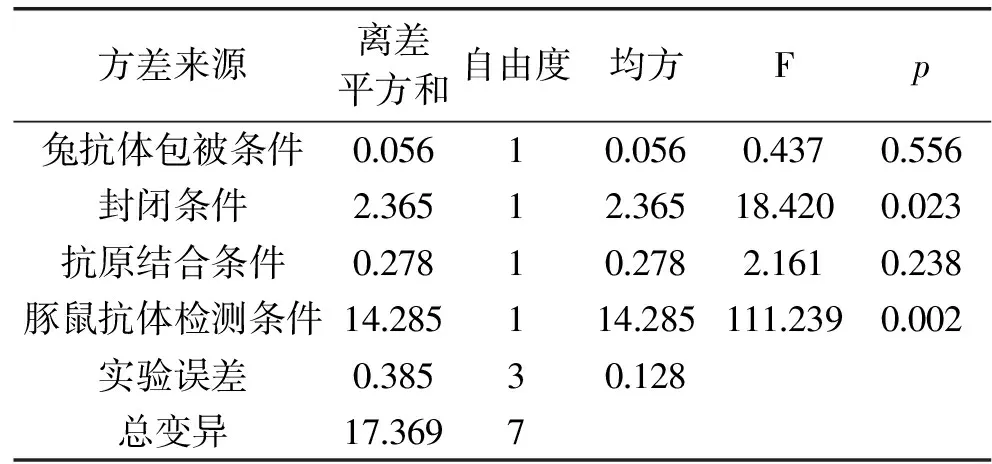
表4 正交实验方差分析
2.6 双抗夹心ELISA方法标准曲线及检出限的确定
对抗原标准品梯度稀释,利用2.5得到的最优反应条件测定本ELISA方法的检出限,以抗原标准品浓度对数为横坐标,以测定孔OD值-阴性孔OD值为纵坐标,建立如图4所示的标准曲线,根据P/N≥2.1的阳性值判定标准,本方法的检出限为98 ng/mL。
2.7 双抗夹心ELISA的特异性检测
采用热带假丝酵母菌与其他菌株菌体蛋白作抗原,抗原浓度均调至2 μg/mL,以不同菌株为横坐标,不同菌株菌体蛋白OD值与阴性孔OD值的比值(P/N)为纵坐标,检验本研究双抗夹心ELISA方法的特异性,结果如图5,说明该方法特异性优良。
2.8 双抗夹心ELISA的重复性检测
根据建立的方法对热带假丝酵母菌菌体蛋白做板内和板间重复性检测,以变异系数为衡量指标,结果见表5、表6。根据结果可知,板内变异系数小于2%,板间变异系数小于6%,所建ELISA方法重复性良好。
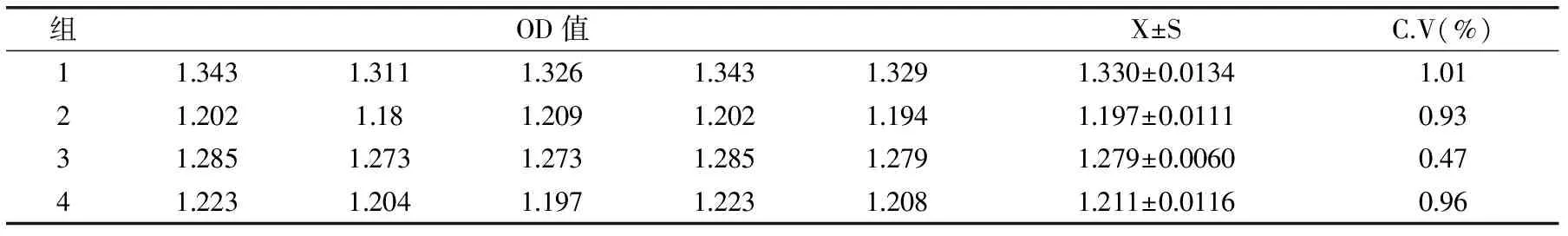
表5 板内重复性检测
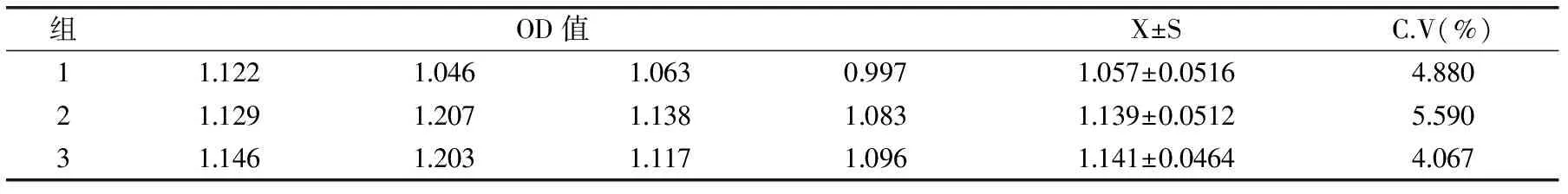
表6 板间重复性检测

表7 选择性增菌的重复性验证
2.9 选择性培养基的抑菌检测
绘制分别接种在选择性PDA培养基上的100 CFU热带假丝酵母菌、100 CFU热带假丝酵母菌和100 CFU大肠杆菌混合菌、100 CFU热带假丝酵母菌和100 CFU沙门氏菌混合菌的菌液OD600值与时间之间的生长曲线图,结果如图6。三种接种方法的生长曲线相同,说明选择性培养基可有效抑制细菌,而不对热带假丝酵母菌的生长产生影响。
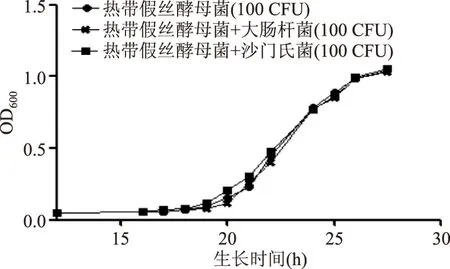
图6 选择性培养基抑菌检测Fig.6 Detection of antibacterial in selective medium
2.10 选择性增菌的重复性检验
根据确定的增菌条件检验选择性增菌的重复性,以变异系数为指标,结果如表7,变异系数均小于10%,说明重复性良好。
2.11 提取热带假丝酵母菌全蛋白的方法分析
用热法、碱热法、超声破碎法分别对热带假丝酵母菌的全蛋白进行提取,采用间接ELISA方法检验结合效果后,选择超声破碎法提取全蛋白。固定超声破碎条件如1.2.11,以菌体蛋白浓度为横坐标,以菌液OD600值为纵坐标,结果如图7,说明过低的增菌量可能导致处理中酵母菌体的损失,选用菌液OD600值大于0.1的菌液浓度用于本ELISA的检测。
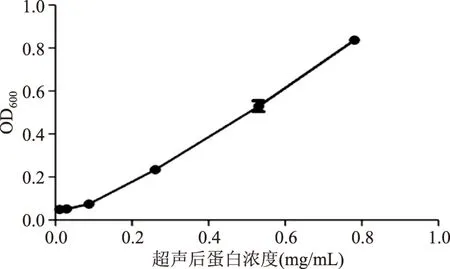
图7 蛋白浓度与菌液OD600相关性曲线Fig.7 Protein concentration-bacteria OD600 correlation curve
2.12 乳品样品中的检测
10种乳制品经前处理,28 ℃下以220 r/min振荡培养22 h,实验结果均呈阴性。以30 CFU/mL和100 CFU/mL的接菌量在乳品中接菌,28 ℃下以220 r/min振荡培养。加标回收实验表明,30 CFU/mL接菌量培养24 h后,提取蛋白可检测出准确阳性值;100 CFU/mL接菌量培养22 h后,提取蛋白可检测出准确阳性值,见表8。
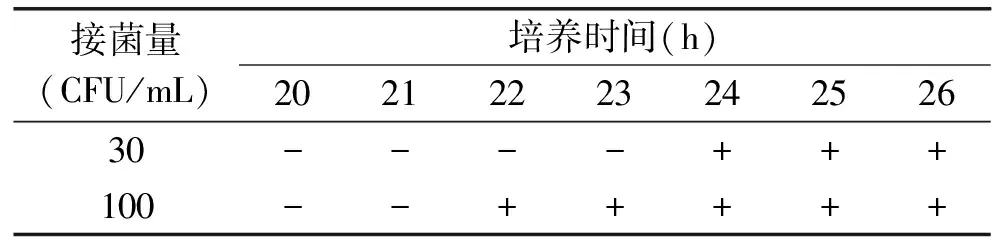
表8 乳品样品加标回收检验结果
注:“+”和“-”分别表示阳性和阴性。
3 结论
酶标板对蛋白质的吸附能力较强,对大颗粒性抗原如酵母菌的吸附能力很差。因此,本研究采用滤膜集菌并通过具有选择性的PDA培养基进行前增菌,对增菌后菌悬液超声破碎,建立热带假丝酵母菌上清蛋白的双抗夹心ELISA快速检测方法。本研究获得了热带假丝酵母菌上清蛋白的兔、豚鼠多克隆抗体,效价分别为1∶64000和1∶51200。建立的双抗夹心ELISA方法经优化后,最佳反应条件为:37 ℃包被1 h,NH4Cl封闭1 h,PBS稀释抗原结合1 h,1%脱脂奶粉稀释检测抗体反应1 h。所建立的双抗夹心ELISA方法重复性好、特异性高,检测限为98 ng/mL。经过前处理并以所建双抗夹心ELISA方法检测,100 CFU/mL接菌量在22 h后,经超声破碎并离心可检测出准确阳性值。
[1]龙燕,郑磊,曾方银,等. 热带假丝酵母菌实时荧光定量PCR检测方法的建立及临床应用初步评价[J]. 热带医学杂志,2012(5):550-552,580.
[2]韩春杨,刘翠艳,冯士彬,等. 奶牛热带假丝酵母菌性乳房炎的诊断与治疗[J]. 畜牧与兽医,2010,42(2):103-104.
[3]Hayashi T,Sugita T,Hata E,et al. Molecular-based identification of yeasts isolated from bovine clinical mastitis in Japan.[J]. Journal of Veterinary Medical Science,2013,75(3):387-390.
[4]张瑜乐. 奶牛乳房炎病原菌分离鉴定及热带假丝酵母菌的致病性研究[D]. 泰安:山东农业大学,2013.
[5]张军,王晓飞,王瑞东,等. 通过增加痰液量和超声裂菌提高结核分枝杆菌荧光定量PCR检出率[J]. 检验医学,2014(3):215-218.
[6]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1-2):248-254.
[7]Zhao Y,Li G. Detection of Penicillinase in Milk by Sandwich Elisa Based Polyclonal and Monoclonal Antibody[J]. Journal of Immunoassay & Immunochemistry,2016,37(1):80-89.
[8]Lin H,Huang J,Shu Z,et al. Cloning,expression and characterization of a lipase gene,lipC24,from Burkholderia sp. ZYB002[J]. Acta Microbiologica Sinica,2015,55(1):59-66.
[9]杨舸,李晶,吕林峰,等. 播娘蒿DsCOR蛋白纯化、抗体制备及对冷诱导的响应[J]. 应用与环境生物学报,2010(3):337-340.
[10]牛发良,侯亚利,李俊杰,等. 三种辣根过氧化物酶标记羊抗人IgG方法的比较[J]. 张家口医学院学报,2002,19(1):24-26.
[11]段霞,黄欣,黄岭芳,等. 双抗夹心ELISA方法检测食品中单核细胞增生李斯特氏菌[J]. 食品科学,2010,31(24):272-276.
[12]葛萃萃,钟青萍,张旺,等. 双抗夹心ELISA检测食品中大肠杆菌O157∶H7方法研究[J]. 食品科学,2007,28(1):171-175.
[13]石曼,生威,杜欣军,等. 检测乳粉中克罗诺杆菌属穆汀斯克罗诺杆菌的双抗夹心ELISA方法的研究[J]. 食品工业科技,2012(1):335-337.
[14]伍燕华,牛瑞江,赖卫华,等. 双抗夹心酶联免疫吸附法检测沙门氏菌[J]. 食品工业科技,2014,35(10):62-65.
[15]Shehata A A,Fiebig P,Sultan H,et al. Development of a recombinant ELISA using yeast(Pichia pastoris)-expressed polypeptides for detection of antibodies against avian influenza A subtype H5[J]. Journal of Virological Methods,2012,180(1-2):18-25.
[16]刘弋青,吕维敏,刘魁武,等. 基于滤膜上细菌直接计数法的细菌总数快速检测[J]. 生物医学工程研究,2009,28(1):60-62.
[17]王似锦,高春. 疫苗类制品无菌检查方法(薄膜过滤法)的研究[J]. 药物分析杂志,2011(8):1556-1559.
A double-antibody sandwich ELISA for detection ofCandidatropicalisin dairy product
CHANG Jiang1,2,LIU Xi3,LIU Zeng-shan1,*,REN Hong-lin1,LU Shi-ying1,HU Pan1,LI Yan-song1,GAI Dong-xue1,JIN Wen1,ZHANG Song1,MENG Xian-mei2,*
(1.Key Laboratory of Zoonosis,Ministry of Education,Institute of Zoonosis,Jilin University,Changchun 130062,China; 2.Key Laboratory of Grain and Oil Processing of Jilin Province, Jilin Business and Technology College,Changchun 130507,China; 3.Ground Dairy Industry Co.,Ltd.,Changchun 130102,China)
This study focused on developing an rapid detection ofCandidatropicalisin dairy products. The soluble protein was expressed byCandidatropicalisas immunogen to obtain the polyclonal antibodies(PAbs)of rabbit and guinea pigs respectively. A sandwich ELISA detection method based on PAb pair targetingCandidatropicaliswas then established,in which rabbit PAb was capture antibody and guinea pig PAb was detection antibody. There was no cross reaction with miscellaneous bacteria or microzymes and the detection limits forCandidatropicaliswas 98 ng/mL,the intro-batch variation was less than 2%,and the inter-batch variation was less than 6%. During the actual sample tests,theCandidatropicalisin dairy were enriched by filter and selective cultural method,followed by the sandwich ELISA detection. The results showed that 100 CFU/mLCandidatropicaliscould be detected accurately in 22 h. The test results of this improved method were validated by national standard method.
dairy;Candidatropicalis;double-antibody sandwich ELISA;rapid detection;selective enrichment;collecting bacteria using millipore filter
2016-06-13
常江(1992-),男,在读硕士研究生,研究方向:兽医公共卫生,E-mail:245661900@qq.com。
*通讯作者:柳增善(1959-),男,博士,教授,研究方向:兽医公共卫生,E-mail:zsliu1959@sohu.com。 孟宪梅(1964-),女,博士,教授,研究方向:食品安全,E-mail:mengxm222@sina.com。
吉林省重点科技攻关项目(20140204065NY);吉林省世行贷款农产品质量安全应用研究项目(2011-Y36);吉林省科技发展计划项目(201205054);粮油食品深加工省高校重点实验室项目(2016003)。
TS252.7
A
1002-0306(2016)24-0000-00
10.13386/j.issn1002-0306.2016.24.000

