miRNA-152表达与NSCLC对顺铂耐药的关系及其机制研究
郭 迪,李宏云△,杨 华
(郑州大学第五附属医院:1.呼吸内科;2.普通外科,郑州 450052)
miRNA-152表达与NSCLC对顺铂耐药的关系及其机制研究
郭 迪1,李宏云1△,杨 华2
(郑州大学第五附属医院:1.呼吸内科;2.普通外科,郑州 450052)
目的 研究微小RNA-152(miRNA-152)在非小细胞肺癌(NSCLC)顺铂(DDP)耐药过程中的作用机制。方法 实时荧光定量逆转录PCR(qRT-PCR)检测NSCLC细胞株A549及其DDP耐药株A549/DDP细胞内的miRNA-152水平。通过转染miRNA-52模拟物(miRNA-152 mimic)以提高A549/DDP细胞内的microRNA-152水平。MTT试验、倒置相差显微镜技仪和流式细胞术观察上调miRNA-152对细胞增殖及凋亡的影响,同时采用qRT-PCR和Western blot技术观察细胞内Bcl-2及核转录因子-κB(NF-κB)水平变化。结果 A549/DDP细胞中存在miRNA-152的低表达,Bcl-2及NF-κB的高表达。上调miRNA-152后,DDP造成的A549/DDP细胞增殖抑制率和凋亡率显著高于未上调miRNA-152的细胞,差异有统计学意义(P<0.05)。此外,miRNA-152 mimic转染可显著降低A549/DDP细胞中的Bcl-2及NF-κB表达。结论 低miRNA-152表达可能引起NSCLC对DDP的耐药,miRNA-152可能通过调节Bcl-2及NF-κB的水平介导NSCLC细胞对顺铂的敏感性。
癌,非小细胞肺;微小RNAs;Bcl-2;核因子κB;顺铂;药物耐受性
非小细胞肺癌(non-small cell lung cancer,NSCLC)的生长分裂较慢,扩散转移较晚,因此大部分患者在首诊时已经进入进展期,丧失了手术根治的时机。这种情况下,NSCLC的非手术治疗就成为了治疗的重要环节[1]。非手术治疗主要包括靶向治疗和化学治疗,对于表皮生长因子受体(epidermal growth factor receptor,EGFR)突变阳性的NSCLC患者来说,首选方案为EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)靶向治疗,如使用吉非替尼等药物。而对于EGFR突变阴性的NSCLC患者EGFR-TKI的使用效果有限,因此这类患者首选化学治疗[2-3]。化学治疗方案中,以铂类药物为基础的联合化学治疗应用广泛,如顺铂(cisplatin,DDP)方案的效果已经得到临床证实。但是NSCLC患者对铂类药物的耐药现象同样不容忽视,进一步探索NSCLC患者对铂类药物耐药的机制具有重要意义[4]。近年来微小RNA(microRNA,miRNA)的转录后调控作用备受瞩目,大量研究发现miRNA的表达变化与肿瘤的发生、发展及耐药机制有关。研究证实NSCLC患者存在miRNA-152的低表达[5],但关于miRNA-152表达与NSCLC对铂类药物耐药之间的关系还鲜有研究。因此,本研究探讨耐药的A549细胞中miRNA-152表达变化,观察其对DDP敏感性的影响,并初步阐述其介导耐药的机制。
1 材料与方法
1.1 主要试剂和材料 人肺腺癌A549细胞株购自上海中科院细胞库,DDP耐药A549/DDP细胞株购自上海斯信生物科技有限公司。胎牛血清和DMEM培养基购自美国Gibco公司。miRNA快速提取试剂盒购自北京百泰克生物技术有限公司。ImProm-ⅡTM逆转录试剂盒、GO Taq®qPCR Master Mix试剂盒购自普洛麦格(北京)生物技术有限公司。Trizol试剂及LipofectamineTM2000购自美国Invitrogen公司。CCK-8试剂盒购自上海博谷生物科技有限公司。ECL发光试剂盒购自北京普利来生物科技有限公司。鼠抗人Bcl-2抗体、鼠抗人NF-κB抗体、鼠抗人GAPDH抗体、二抗购自英国Abcam公司。miRNA-152模拟物购自上海吉玛公司。
1.2 细胞培养 A549细胞株培养于含10%胎牛血清的DMEM培养基。A549/DDP细胞株培养于含12%胎牛血清的DMEM培养基,正常传代3次后,须向培养基加入DDP,并维持DDP水平为2 μg/mL以保持其耐药性。培养环境均为5% CO2,37 ℃。A549/DDP细胞的耐药性已经在预试验中得到验证,耐药指数约为4.51。
1.3 实时荧光定量逆转录PCR(qRT-PCR)检测miRNA-152 使用miRNA 快速提取试剂盒提取并纯化A549细胞及A549/DPP细胞中的miRNA。使用ImProm-ⅡTM逆转试剂盒将提取的miRNA转录为cDNA。以cDNA为模板进行PCR扩增,扩增体系和条件严格参照厂商提供的说明书。miR-152正向引物序列为5′-GAG TGC TCA GTG CAT GAC AG-3′,反向引物序列为5′-GTG CAG GGT CCG AGG T-3′。采用U6 RNA作为内参,其正向引物序列为5′-CTC GCT TCG GCA GCA CA-3′,反向引物序列为5′-AAC GCT TCA CGA ATT TGC GT-3′。以2-ΔΔCt法计算miRNA-152的相对表达情况。其中ΔCt=Ct目标-Ct内参。
1.4 qRT-PCR检测Bcl-2 mRNA和NF-κB mRNA 使用Trizol试剂提取A549细胞及A549/DPP细胞中的总RNA。ImProm-ⅡTM逆转录试剂盒对提取出的总RNA进行逆转录,以合成cDNA。逆转录体系参照试剂盒提供的说明书。使用GO Taq®qPCR Master Mix试剂盒对上述合成的cDNA进行PCR扩增。Bcl-2的正向引物为5′-TTC TTT GAG TTC GGT GGG GTC-3′,反向引物为5′-TGC ATA TTT GTT TGG GGC AGG-3′;NF-κB的正向引物为5′-CTG CAT TTC CAC AGT TTC CAG AACC-3′,反向引物为5′-ACG CTG CTC TTC TAT AGG AAC TTG G-3′;内参GAPDH的正向引物为5′-ACC ACA GTC CAT GCC ATC AC-3′,反向引物为5′-TCC ACC ACC CTG TTG CTG TA-3′。反应体系和方案参照试剂盒说明书。使用2-△△CT法分析目的mRNA的相对表达情况。
1.5 Western blot法检测Bcl-2和NF-κB 提取A549细胞及A549/DPP细胞中的总蛋白,使用12%的聚丙烯酰胺凝胶进行电泳,并转膜。转膜结束后,使用5%脱脂奶粉室温封闭1 h。分别使用1∶1 500的鼠抗人Bcl-2抗体,1∶2 000的鼠抗人NF-κB抗体及鼠抗人GAPDH抗体,4 ℃孵育12 h。接着使用磷酸盐缓冲液-Tween 20(PBST)洗涤3次,除去未结合的一抗。二抗稀释后(1∶1 000)与膜接触,室温下孵育1~2 h,ECL发光试剂盒显色并分析条带。
1.6 miRNA-152的过表达 转染前将A549/DDP细胞转移至不含DDP的培养基中常规培养,待细胞贴壁后,消化细胞制备细胞悬液,以6 000/孔的细胞密度将细胞接种于96孔板,当细胞汇合度达到80%左右时,使用LipofectamineTM2000转染试剂盒将miRNA-152模拟物(miRNA-152 mimic)转入细胞,miRNA-152 mimic的工作水平为50 nmol/L,相同方法转染无关miRNA mimic作为阴性对照。继续培养48 h,qRT-PCR验证转染效果。
1.7 CCK-8试验及形态学检查分析miRNA-152上调对细胞抑制率的影响 将A549/DDP细胞分为5组:未经DDP处理且未任何转染处理的A549/DDP细胞(A组),未经DDP处理,但经无关miRNA mimic转染处理的A549/DDP细胞(B组),未经DDP处理,但经miRNA-152 mimic转染处理的A549/DDP细胞(C组),经3 μmol/L DDP处理,但未经任何转染处理的A549/DDP细胞(D组),经3 μmol/L DDP处理且经无关miRNA mimic转染处理的A549/DDP细胞(E组),经3 μmol/L DDP处理且经miRNA-152 mimic转染处理的A549/DDP细胞(F组)。处理24 h后,MTT法计算各组抑制率。倒置相差显微镜观察各组细胞的增殖情况。
1.8 流式细胞仪检测细胞凋亡率 细胞分组同上,各组处理时间达到后,常规收集细胞,使用Annexin V-FITC试剂盒内的缓冲液重新悬浮细胞。依此加入5 μL Annexin V-FITC和10 μL碘化丙啶染色液,混匀后室温避光孵育15 min上机检测。
1.9 qRT-PCR及Western blot分析miRNA-152过表达对细胞Bcl-2及NF-κB表达的影响 培养未经转染的A549/DDP细胞(空白对照组),转染miRNA-152 mimic 的A549/DDP细胞(试验组),以及转染无关miRNA mimic的A549/DDP细胞(阴性对照组)48 h。按上文所述方法提取3种细胞中的总RNA及总蛋白样本。qRT-PCR及Western blot分析方法同上,相关引物和抗体均同前,检测miRNA-152上调后A549/DDP细胞中Bcl-2及NF-κB的表达变化。

2 结 果
2.1 A549/DDP细胞的miRNA-152表达 与A549细胞相比,A549/DDP细胞miRNA-152表达较低,相对降低的倍数为(0.65±0.04)倍,差异有统计学意义(P<0.05),见图1。

图1 A549及A549/DDP细胞中的miRNA-152相对表达水平
2.2 A549/DDP细胞的Bcl-2及NF-κB表达 与A549细胞相比,A549/DDP细胞Bcl-2及NF-κB mRNA 表达水平较高,分别相对提高了(1.53±0.21)倍和(1.37±0.13)倍,差异有统计学意义(P<0.05)。Western blot分析证实,Bcl-2及NF-κB蛋白表达同样在A549/DDP细胞中较高,见图2、3。

A:Bcl-2;B:NF-κB。
图2 A549及A549/DDP细胞中的Bcl-2、NF-κB mRNA相对表达水平

图3 A549及A549/DDP细胞中的Bcl-2及NF-κB蛋白表达水平
2.3 miRNA-152表达上调增加A549/DDP细胞对DDP的敏感性 如图4所示,B、C、D、E、F组的细胞增殖抑制率分别为(7.5±2.5)、(6.8±2.1)、(22.6±3.8)、(23.4±3.4)、(41.3±4.4)%。其中F组细胞抑制率显著高于D组和E组,差异有统计学意义(P<0.05)。形态学结果显示,DDP能够抑制细胞增殖且F组细胞增殖显著低于D组,见图5。

图4 3 μmol/L DDP处理 A549/DDP细胞24 h后的细胞抑制率
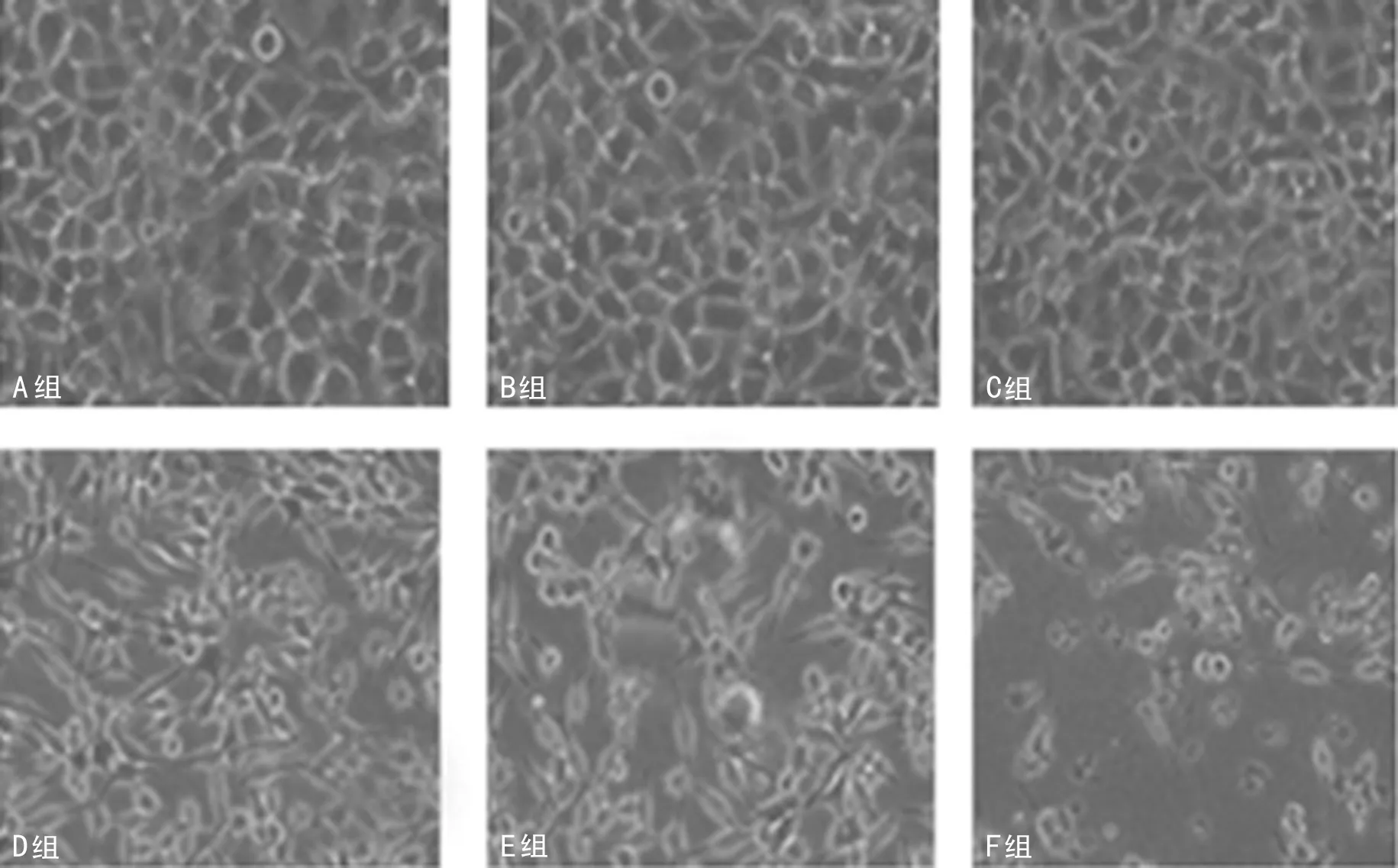
图5 各组细胞倒置相差显微镜图像(×200)

A:流式细胞分析图;B:凋亡分析图。
图6 3 μmol/L DDP处理 A549/DDP细胞24 h后的流式细胞分析图和凋亡分析图
2.4 miRNA-152表达上调增加DDP引起的A549/DDP细胞凋亡 如图6所示,A、B、C、D、E、F组的细胞凋亡率分别为(3.8±1.3)、(4.4±0.9)、(4.8±1.1)、(14.5±2.2)、(13.2±1.9)、(22.3±2.1)%。其中F组细胞凋亡率显著高于D组和E组,差异有统计学意义(P<0.05)。
2.5 miRNA-152表达上调可以降低A549/DDP细胞中Bcl-2及NF-κB的表达 qRT-PCR发现,试验组Bcl-2及NF-κB mRNA 水平较空白对照组及阴性对照组显著降低,差异有统计学意义(P<0.05)。Western blot结果显示,试验组Bcl-2及NF-κB 蛋白水平也显著降低,差异有统计学意义(P<0.05)。图7、8。

A:Bcl-2;B:NF-κB。
图7 miRNA-152 mimic 转染对A549/DDP细胞中Bcl-2、NF-κB mRNA水平的影响

图8 miRNA-152 mimic 转染对A549/DDP细胞中Bcl-2和NF-κB mRNA水平的影响
3 讨 论
DDP的耐药机制较为复杂,主要涉及药物转运、药物解毒、细胞凋亡等多个方面,常见的机制有如下几个方面:(1)细胞膜上的分子泵表达异常,大量药物排出细胞外,导致细胞内的药物水平降低,如人类多药耐药基因编码的P-gp过表达引起的耐药,P-gp由人类多药耐药基因(mul-tidrug resistance gene,MDR)家族中的mdr1编码产生,定位于细胞膜,是一种能量依赖性的分子泵,它能将DDP或其他化学治疗药物泵出细胞外,导致肿瘤细胞内的药物水平降低或者药物重分布[6]。(2)细胞的药物解毒效应增强,也导致药物代谢、排除增加或者药物毒性减少,如谷胱甘肽转硫酶π家族的表达异常引起的耐药,谷胱甘肽转硫酶π可增加药物极性、清除药物的代谢产物、阻止药物与肿瘤细胞的DNA结合及催化谷胱甘肽与亲电子物质结合、消除化学治疗药物产生的活性氧损伤,避免细胞膜上的脂质氧化[7]。(3)DNA的修复功能异常,如拓扑异构酶Ⅱ的突变会造成DDP耐药。(4)凋亡调控蛋白的异常,DDP可能通过一些凋亡调控因子促进细胞凋亡,这些调控因子异常时,可能造成DDP的疗效降低[8]。
很多关于肿瘤的研究开始关注miRNA与肿瘤发生发展及耐药现象的关系。miRNA是一类长约21~25 nt的非编码小分子RNA,其在转录后水平上抑制靶基因的表达,从而调控细胞的增殖、凋亡等生命现象。越来越多的研究证实,miRNA与肿瘤关系密切,影响肿瘤的进展、分化、转移甚至耐药等[9]。特别是耐药是临床上肿瘤内科治疗亟待解决的瓶颈问题,寻找可以用于逆转耐药的潜在的miRNA靶点引起人们广泛的兴趣。有研究表明,乳腺癌的阿霉素耐药株MCF-7/ADR与非耐药株相比,存在36个miRNA的表达差异[10]。还有研究发现,miR-17~92基因簇与卵巢浆液性癌化学治疗耐药有关,可用于化学治疗效果的评估[11]。本研究发现与非耐药的A549细胞相比,对DDP耐药的A549/DDP细胞存在miR-152的低表达,因此,作者认为较低的miR-152表达抑制肿瘤细胞的凋亡,不利于治疗。此观点与既往的一些研究结果类似,如有研究发现miRNA-152可以抑制NSCLC的生长和侵袭能力,过低的miRNA-152表达增加了肿瘤细胞增殖[5]。
当然,miRNA在肿瘤的耐药中要发挥作用,必然通过其靶基因,具体机制涉及:(1)miRNA可以调节一系列耐药相关蛋白。如miR-298可以抑制MDR-1的表达,进而减少P-糖蛋白的表达,起到缓解乳腺癌细胞耐药的作用。相反,miR-27a激活MDR-1,引起肿瘤细胞耐药[12];(2)miRNA可以影响药物的靶点蛋白,从而引起耐药性的改变。如在小细胞肺癌中,miR-126可以血管内皮生长因子为靶基因,减少其表达,后者为贝伐单抗的靶点,因此miR-126可以增加miRNA对贝伐单抗的敏感性[13];(3)miRNA可以影响药物的转运。研究发现miR-206可以靶向抑制连接蛋白,后者发挥转运药物的功能,其功能受限后,会导致药物不能向邻近细胞转运;(4)miRNA可以影响药物引起的细胞死亡。如miR-21可以下调Bax的水平,从而抑制凋亡发生[9]。
虽然很多研究发现miR-152在肿瘤中存在低表达,且具有抑制肿瘤的功能[14-15],但未见有研究报道miR-152与化学治疗耐药的关系。本研究中,使用miR-152 minic上调A549/DDP细胞的miR-152后,发现原本耐药的细胞对DDP的敏感性提高了。同时发现miR-152 mimic降低耐药细胞中Bcl-2和NF-κB的表达水平。因此,作者认为miR-152可能通过调节Bcl-2和NF-κB发挥药物敏感性的调节作用。Bcl-2和NF-κB均为公认的抗凋亡基因。大量研究证实,肺癌、胃癌、卵巢癌,以及结肠癌等均存在Bcl-2和NF-κB过表达,二者的抗凋亡作用在肿瘤细胞的恶性增殖过程中扮演重要角色,与侵袭和转移行为密切相关[16-17]。在耐药性研究方面,Hall等[18]发现Bcl-2可以作为生殖系统肿瘤化学治疗的靶点,较高的Bcl-2意味着较差的预后。Sun等[19]发现肺腺癌A549细胞中的NF-κB表达过高,抑制NF-κB的表达可以增加A549对化学治疗药物的敏感性。本研究中miR-152表达上调后,Bcl-2和NF-κB表达减少,抗凋亡减弱,这可以解释为何原本耐药的A549/DDP细胞对DDP的敏感性得到了提高。但Bcl-2和NF-κB是否是miR-152的直接靶基因,还是miR-152调节通路下游的某个环节,需要进一步的研究证实。
[1]Kocher F,A Pircher,A Mohn-Staudner,et al.Multicenter phase Ⅱ study evaluating docetaxel and cisplatin as neoadjuvant induction regimen prior to surgery or radiochemotherapy with docetaxel,followed by adjuvant docetaxel therapy in chemonaive patients with NSCLC stage Ⅱ,ⅢA and ⅢB(TAX-AT 1.203 Trial)[J].Lung Cancer,2014,85(3):395-400.
[2]Pircher A,Manzl C,Fiegl M,et al.Overcoming resistance to first generation EGFR TKIs with cetuximab in combination with chemotherapy in an EGFR mutated advanced stage NSCLC patient[J].Lung Cancer,2014,83(3):408-410.
[3]Rolfo C,Giovannetti E,Hong DS,et al.Novel therapeutic strategies for patients with NSCLC that do not respond to treatment with EGFR inhibitors[J].Cancer Treat Rev,2014,40(8):990-1004.
[4]Wu C,Wang Y,Xia Y,et al.Wilms′ tumor 1 enhances Cisplatin-resistance of advanced NSCLC[J].FEBS Lett,2014,588(24):4566-4572.
[5]Su Y,Wang Y,Zhou H,et al.miRNA-152 targets ADAM17 to suppress NSCLC progression[J].FEBS Lett,2014,588(10):1983-1988.
[6]Li S,Lei Y,Jia Y,et al.Piperine,a piperidine alkaloid from Piper nigrum re-sensitizes P-gp,MRP1 and BCRP dependent multidrug resistant cancer cells[J].Phytomedicine,2011,19(1):83-87.
[7]Wang W,Liu G,Zheng J.Human renal UOK130 tumor cells:A drug resistant cell line with highly selective over-expression of glutathione S-transferase-π isozyme[J].Eur J Pharmacol,2007,568(1/3):61-67.
[8]Heavey S,Barr M,Edwards C,et al.7 NFkB-IκBα interaction:a mechanism of resistance to cisplatin in NSCLC[J].Lung Cancer,2012,75(12):S3.
[9]林高阳,徐克.MicroRNA调控肿瘤耐药的研究进展[J].中国肺癌杂志,2014,17(10):741-749.
[10]崔秀英,郭运杰,姚和瑞.耐药乳腺癌细胞株MCF-7/ADR中microRNA的分析[J].南方医科大学学报,2008,28(10):1813-1815.
[11]陶陶,王敏.化疗耐药及敏感卵巢癌细胞差异表达microRNA的筛查与组织鉴定[J].中国医科大学学报,2013,42(2):118-122.
[12]李智敏,胡沙,肖兰,等.微小RNA 27a在卵巢上皮性癌紫杉醇耐药细胞中的表达及其与耐药的关系[J].中华妇产科杂志,2010,45(5):372-375.
[13]谢云,诸兰艳.胸水miRNAs表达对非小细胞肺癌患者化疗敏感性的预测价值[J].医学信息,2013,26(18):284-285.
[14]Ma J,Yao Y,Wang P,et al.MiR-152 functions as a tumor suppressor in glioblastoma stem cells by targeting Krüppel-like factor 4[J].Cancer Lett,2014,355(1):85-95.
[15]Wu Y,Huang A,Ti L,et al.MiR-152 reduces human umbilical vein endothelial cell proliferation and migration by targeting ADAM17[J].FEBS Lett,2014,588(12):2063-2069.
[16]Batsi C,Markopoulou S,Kontargiris E,et al.Bcl-2 blocks 2-methoxyestradiol induced leukemia cell apoptosis by a p27Kip1-dependent G1/S cell cycle arrest in conjunction with NF-κB activation[J].Biochem Pharmacol,2009,78(1):33-44.
[17]Luna-López A,González-Puertos VY,Romero-Ontiveros J,et al.A noncanonical NF-κB pathway through the p50 subunit regulates Bcl-2 overexpression during an oxidative-conditioning hormesis response[J].Free Radic Biol Med,2013,63:41-50.
[18]Hall C,Troutman SM,Price DK,et al.Bcl-2 Family of Proteins as therapeutic targets in genitourinary neoplasms[J].Clin Genitourin Cancer,2013,11(1):10-19.
[19]Sun C,Chan F,Briassouli P,et al.Aurora kinase inhibition downregulates NF-κB and sensitises tumour cells to chemotherapeutic agents[J].Biochem Biophys Res Commun,2007,352(1):220-225.
Relation between microRNA-152 expression and cisplatin resistance in non-small cell lung cancer cells and its mechanism
GuoDi1,LiHongyun1△,YangHua2
(1.DepartmentofRespiration;2.DepartmentofGeneralSurgery,FifthAffiliatedHospitalofZhengzhouUniversity,Zhengzhou,Henan450052,China)
Objective To investigate the action mechanism of microRNA-152(miRNA-152) in the cisplatin(DDP) resistance process in non-small cell lung cancer (NSCLC).Methods The miRNA-152 level in NSCLC cell line A549 and its cisplatin-resistant cell line A549/DDP was detected by the real time quantitative PCR(qRT-PCR).miRNA-152 mimic was transfected for increasing the intracellular miRNA-152 level in A549/DDP.The MTT assay,inverted miroscope technique and flow cytometry were adopted to observe the effect of up-regulating miRNA-152 on cell proliferation inhibition and apoptosis,meanwhile,the level changes of intracellular Bcl-2 and NF-κB were also observed by adopting qRT-PCR and Western blot.Results The low expression of miRNA-152 and the high expression of Bcl-2 and NF-κB were found in A549/DDP cells.Up-regulation of miRNA-152 enhanced the inhibitory effect of DDP in A549/DDP cells.Furthermore,after up-regulating miRNA-152,the inhibiting rate and apoptosis rate of A549/DDP cells caused by DDP were significantly higher than those in the cells without up-regulating miRNA-152,the difference was statistically significant(P<0.05).In addition,miRNA-152 mimic transfection significantly decreased the expression of Bcl-2 and NF-κB in A549/DDP cells.Conclusion Low expression of miRNA-152 may induce the resistance of NSCLC to DDP,miRNA-152 could mediate the sensitivity of NSCLC cells to DDP via regulating Bcl-2 and NF-κB levels.
carcinoma,non-small-cell lung;microRNAs;Bcl-2;NF-κB;cisplatin;drug tolerance
郭迪(1980-),主治医师,硕士,主要从事呼吸内科研究。△
,E-mail:drliofres@163.com。
� 著·
10.3969/j.issn.1671-8348.2016.10.001
R734.2
A
1671-8348(2016)10-1297-05
2015-11-08
2015-12-20)

