醋酸铅对人和小鼠瞬时受体电位A1离子通道的抑制作用
赵 红,宋玉竹
(1.昆明理工大学生命科学学院,云南昆明 650500;2.中国科学院昆明动物研究所,云南昆明 650500)
醋酸铅对人和小鼠瞬时受体电位A1离子通道的抑制作用
赵 红1,2,宋玉竹1
(1.昆明理工大学生命科学学院,云南昆明 650500;2.中国科学院昆明动物研究所,云南昆明 650500)
目的 研究醋酸铅对瞬时受体电位A1(TRPA1)通道的影响。方法 应用细胞内钙荧光成像系统检测原代培养的小鼠背根神经节(DRG)神经元上TRPA1(mTRPA1)通道和外源性表达在HEK293细胞上的人源TRPA1(hTRPA1)和mTRPA1通道介导的细胞外钙内流;应用双电极电压钳技术记录外源性表达在爪蟾卵母细胞上的hTRPA1通道介导的电流。结果 醋酸铅3.0和10.0 μmol·L-1对TRPA1介导的小鼠DRG神经元外钙内流的抑制率分别为(36.7±4.1)%和(79.4±3.1)%;醋酸铅浓度依赖性地抑制爪蟾卵母细胞上hTRPA1通道介导的电流,醋酸铅0.3,1.0,3.0,10.0和30.0 μmol·L-1对+80 mV处电流的抑制率分别为(1.0±0.7)%,(11.6±0.8)%,(57.7±3.2)%,(93.6±2.6)%和(93.2±2.7)%,其IC50为2.4 μmol·L-1。结论 TRPA1通道是铅的内源性作用靶点,低浓度醋酸铅可抑制TRPA1通道。
醋酸铅;背根神经节;神经元;瞬时受体电位A1通道;电压钳技术;钙成像
铅作为一种常见的工业毒物和环境污染物,对人体健康危害很大。人长期接触低浓度铅造成体内蓄积,会导致造血、泌尿、生殖、免疫、神经、心血管和消化等系统长期慢性的损伤。血铅水平1 mg·L-1时即可表现出行为改变。铅的神经毒性可导致包括感觉功能、运动能力、注意力、视听记忆和情感状态等在内的神经功能变化[1-2]。铅主要影响中枢神经系统[3],而外周神经系统是慢性铅中毒最主要的靶器官之一[4]。铅中毒性外周神经疾病的临床研究也较多,在临床铅中毒案例中,有很大比例的患者出现了触痛觉障碍[5]。
瞬时受体电位(transient receptor potential,TRP)A1通道是位于外周神经系统上的离子通道,属于TRP通道中的一种。TRPA1通道可被多种刺激性化学物质所激活,如异硫氰酸丙酯(propyl iso⁃thiocyanate,AITC)和甲醛等[6],被认为是人体的一个化学感受器[7]。环境污染物中也有多种成分能激活TRPA1通道,如丙烯醛、直径≤2.5 μm的可入肺颗粒物和某些重金属离子等[8]。作为一个组织伤害感受器的通道,敲除TRPA1通道基因小鼠对伤害性化学刺激的感受显著降低[9-10],表明此通道与痛觉感受相关。此外,TRPA1通道还与温度感受和机械感受相关,参与多种重要的生理和病理过程[11]。
铅的神经毒性涉及到多种信号传导系统和离子通道。铅作用于神经元细胞上多种离子通道,如钾、钠和钙通道等,但是关于铅对TRPA1通道的作用国内外未见报道。本研究集体已观察到铅对小鼠背根神经节(dorsal root ganglion,DRG)神经元上TRPA1通道的抑制作用。本研究进一步将小鼠TRPA1(mTRPA1)和人TRPA1(hTRPA1)通道在HEK293细胞和爪蟾卵母细胞中表达,研究醋酸铅对TRPA1通道的作用。
1 材料与方法
1.1 动物、细胞、试剂和主要仪器
C57BL/6新生小鼠,中国科学院昆明动物研究所,动物许可证号:11401300006046;非州爪蟾,中国科学院上海生命科学学院赠送。HEK293细胞:中国科学院昆明动物研究所。mTRPA1和hTRPA1重组质粒,中国科学院昆明动物研究所杨建研究员实验室。醋酸铅(西陇化工股份有限公司);DMEM和DMEM/F12(美国Corning公司);胶原蛋白酶P(瑞士Roche公司);Hanks平衡盐溶液(HBSS,北京索莱宝科技有限公司);胰蛋白酶和青/链霉素(德国BI公司);小牛血清和胎牛血清(美国Gibco公司);NaCl,KCl,MgCl2,HEPES和CaCl2(中国生工生物公司);Fura-2,F-127和G418(美国Invitrogen公司);转染试剂LipofectamineTM2000(美国Life Technology公司);AITC(美国Sigma公司);辣椒素和三卡因(中国阿拉丁公司)。CSMZ-168型解剖镜(德国Motic公司);5702型水平离心机和5424R型超速离心机(德国Eppendorf公司);IX71型钙荧光成像系统(日本Olympus公司);230V细胞培养箱(美国Thermo公司);LS-172细菌培养箱(菲律宾LabServ公司);钙离子荧光激发显微系统(Flexstation3,美国Molecular Devices公司);1440A双电极电压钳(美国Axon公司)。
1.2 醋酸铅溶液配制
称取3.25 g醋酸铅,溶于100 mL超纯水中,配制成醋酸铅100 mmol·L-1储存液,室温保存。临用时用含钙的生理溶液(mmol·L-1:NaCl 140,KCl 4.25,MgCl21.7,HEPES 8.5,CaCl22)进行相应的浓度梯度稀释。
1.3 小鼠DRG神经元和HEK293细胞培养
分离C57BL/6新生小鼠DRG置于HBSS中,用胶原蛋白酶P 0.5 μg·L-1于37℃消化20 min;用胰蛋白酶2 g·L-1于37℃消化2 min;终止酶消化吹打分散后,按109L-1密度将神经元分入96孔板培养,48 h后进行钙成像实验。
HEK293细胞培养于含有10%小牛血清、青霉素100 kU·L-1和链霉素100 mg·L-1的DMEM,置于37℃,5%CO2的培养箱中进行培养。稳转系细胞在培养基中另外加入的抗生素G418 0.2 μg·L-1。
1.4 瞬时转染[6]
采用脂质体瞬时转染的方法。HEK293细胞传代24 h之内,细胞密度为80%进行转染。将hTRPA1和mTRPA1重组质粒1.5 μg与脂质体转染试剂混合在DMEM中,静置15~20 min后加入HEK293细胞中开始转染,质粒转染48 h后将细胞酶解后进行钙荧光成像实验。
1.5 细胞钙荧光成像实验[6]
DRG神经元和表达外源性通道的HEK293细胞在含有10 μmol·L-1Fura-2和0.04%F-127的无钙生理溶液(mmol·L-1:NaCl 140,KCl 4.25,MgCl21.7,HEPES 8.5)中37℃染色1 h,无钙生理溶液洗涤2次,加入上述含钙生理溶液。DRG神经元在加入醋酸铅3和10 μmol·L-12 min之后加入AITC 100 μmol·L-1,进行荧光检测;阳性对照组为无醋酸铅处理、直接加入AITC 100 μmol·L-1灌流。HEK293细胞直接进行荧光检测。使用IX71型钙荧光成像系统进行细胞钙荧光采集,Metafluor软件进行数据分析。通过检测DRG神经元和HEK293细胞加入相应的离子通道特异性激动剂后荧光值的变化,确定醋酸铅对特定离子通道的作用。
1.6 RNA制备
将hTRPA1重组质粒载体用限制性内切酶将其线性化;然后用PCR试剂盒将DNA进行纯化;使用T7 RNA聚合酶体系(5×T7聚合酶缓冲液20 μL+0.1 mol·L-1二硫苏糖醇10 μL+RNA酶重组核糖核酸酶抑制剂2 μL+25 mmol·L-1rNTPs 10 μL+ 40 U·μL-1T7 RNA聚合酶1 μL+m7G帽子10 μL+水47 μL,共100 μL)体外合成2 h,然后进行mRNA纯化;最后用水将RNA溶解,置于-80℃保存。
1.7 卵母细胞制备和TRPA1通道表达及电流记录
非洲爪蟾用3%三卡因麻醉,腹部取卵母细胞放入生理溶液OR2(mmol·L-1:NaCl 82.4,KCl 2.5,MgCl21,HEPES 5),加入0.15 μg·L-1胶原蛋白酶A振荡消化1.5 h,OR2振荡洗涤2次,每次15 min,放入含有青霉素100 kU·L-1和链霉素100 mg·L-1的生理溶液ND96(mmol·L-1:NaCl 96,KCl22.5,MgCl21,HEPES 5,CaCl21.8)中进行培养,显微注射hTRPA1的RNA,每个卵母细胞50.6nL,表达后进行电流记录。
双电极电压钳电流记录:记录时电极电阻为2~ 10 MΩ,采样频率为5 kHz。钳位电压为-80 mV,给予指令电位从-100持续至+100 mV,时程为100 ms,用pClamp 10.2软件处理资料。记录液(mmol·L-1:NaCl 100,KCl 2.5,MgCl21,HEPES 5)。电极内液:KCl 3 mol·L-1。
1.8 统计学分析
实验结果数据均以x±s表示,统计学处理用方差分析和配对t检验,P<0.05表示差异具有统计学意义。剂量效应曲线的拟合采用Logistic方程。
2 结果
2.1 醋酸铅抑制小鼠DRG神经元TRPA1通道激动剂AITC引起的钙离子内流
小鼠DRG神经元用Fura-2染色后进行钙荧光检测。据文献报道,97%表达TRPA1通道的DRG神经元同时表达TRPV1[6]。在本研究条件下,给神经元依次灌流TRPA1通道特异性激动剂AITC和TRPV1激动剂辣椒素。结果发现,加入AITC后部分神经元的钙荧光信号增强(图1);随后加入辣椒素,这些对AITC起反应的神经元均对辣椒素有反应,对AITC有反应的神经元占到对辣椒素有反应神经元的(14.0±1.0)%。加入醋酸铅后,对辣椒素有反应的神经元数量稳定,而对AITC有反应的神经元数量明显降低(P< 0.01)。加入醋酸铅3和10 μmol·L-1后,对AITC有反应的神经元所占的比例由(14.0±1.0)%分别降至(8.9±1.12)%和(3.0±0.2)%,与阳性对照组之间存在显著差异(P<0.01,n=5)。由此可见,醋酸铅抑制了TRPA1通道特异性激动剂AITC引起的钙荧光信号的增加,醋酸铅浓度越高,抑制作用越强,提示DRG神经元上的TRPA1通道可能被醋酸铅抑制。
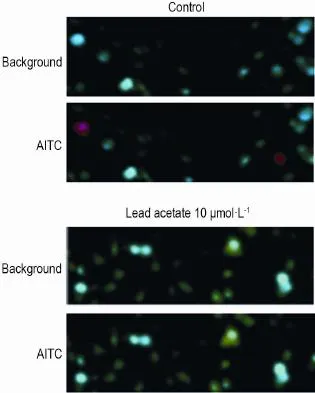
Fig.1 Propyl isothiocyanate(AITC)induced external calcium influx in dorsal root ganglion(DRG)neurons inhibited by lead acetate(×200).The representative ratio⁃metric calcium images of DRG neurons activated by AITC 100 μmol·L-1in the presence(lead acetate 10 μmol·L-1for 2 min)or absence(control)of lead acetate,the duration of AITC perfusion was 1 min.
2.2 醋酸铅抑制外源性表达在HEK293细胞的TRPA1通道介导的钙离子内流
mTRPA1通道基因在HEK293细胞过表达后进行活细胞钙成像实验。TRPA1通道特异性激动剂AITC 100 μmol·L-1可引起过表达mTRPA1通道的HEK293细胞内钙荧光信号增加,醋酸铅3 μmol·L-1可抑制mTRPA1通道介导的钙信号(图2A),抑制比例为(47.2±2.8)%。在过表达hTRPA1通道的HEK293细胞中得到类似结果。醋酸铅对hTRPA1通道介导的钙荧光信号具有浓度依赖性抑制作用(图2B),醋酸铅3.0,5.0,10.0和30.0 μmol·L-1对钙荧光信号的抑制分别为(30.6±6.0)%,(34.9±4.6)%,(60.2±0.9)%和(62±1.1)%(n=5,P<0.01)。由此可见,醋酸铅能抑制外源性表达在HEK293细胞上mTRPA1和hTRPA1通道介导的钙离子内流,此结果与醋酸铅对神经元的作用一致。
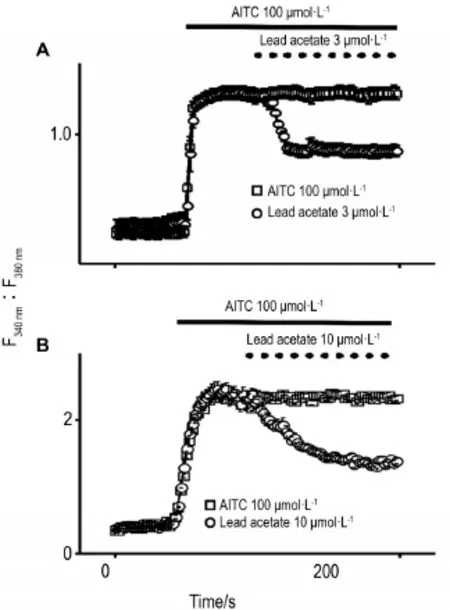
Fig.2 Inhibitory effect of lead acetate on mouse and human transient receptor potential A1(mTRPA1 and hTRPA1)mediated calcium influx,which was expressed in HEK293 cells.A:lead acetate 3 μmol·L-1on mTRPA1 mediated calcium influx(n=8);B:lead acetate 10 μmol·L-1on hTRPA1 mediated calcium influx(n=6).HEK293 cells were perfused with AITC 100 μmol·L-1for 1 min,and then perfused with AITC 100 μmol·L-1and lead acetate 10 μmol·L-1for 100 s.
2.3 醋酸铅抑制外源性表达在爪蟾卵母细胞中的hTRPA1通道介导的电流
为了进一步定量分析醋酸铅对hTRPA1通道的抑制作用,将hTRPA1通道过表达在爪蟾卵母细胞后运用双电极电压钳技术进行电流记录。AITC 30 μmol·L-1可引起hTRPA1通道介导的全细胞电流,加入醋酸铅可抑制hTRPA1通道介导该电流。醋酸铅抑制hTRPA1通道介导的电流呈浓度依赖性,浓度越高抑制比例越大。醋酸铅10 μmol·L-1可将AITC 30 μmol·L-1引起的电流抑制85.9%(图3A)。醋酸铅0.3,1.0,3.0,10.0和30.0 μmol·L-1对+80 mV处电流的抑制率分别为(1.0±0.7)%,(11.6±0.8)%,(57.7±3.2)%,(93.6±2.6)%和(91.2±2.0)%(n≥4)。分析不同浓度醋酸铅对hTRPA1介导的电流的抑制率,以Logistic方程拟合,得出醋酸铅引起电流抑制的浓度效应曲线关系,其IC50为2.4 μmol·L-1(图3 B)。

Fig.3 Inhibitory effect of lead acetate on hTRPA1-mediated current,which was exogenously expressed inXenopusoocytes.A:inhibitory effect of lead acetate 10 μmol·L-1on hTRPA1-mediated current in the presence of 30 μmol·L-1AITC,the duration of AITC and lead acetate perfusion were 50 s and 90 s,respectively,currents were recorded with the protocol(top).After treatment with lead acetate 10.0 μmol·L-1,currents were decreased by 85.9%at+80 mV(medium).B:concentrationresponse curve of lead acetate on hTRPA1-mediated current at+80 mV.The smooth curves were generated from fit of the data using a Logistic equation,and IC50is 2.4 μmol·L-1.x±s,n≥4.
3 讨论
本研究发现,醋酸铅对于外周神经系统的TRPA1通道具有抑制作用。据报道,包括Cr2+和Hg2+在内的多种二价重金属离子对TRPA1通道有激活作用[12-14]。与这些重金属离子作用不同的是,本研究结果则表明,醋酸铅对TRPA1通道有抑制作用。首先,利用钙荧光成像技术发现醋酸铅抑制TRPA1通道的特异性激动剂AITC可引起的DRG神经元细胞外钙内流产生钙荧光。细胞钙荧光是由于细胞外钙离子流入细胞内与染料Fura-2结合所发出的荧光,钙荧光被抑制表明小鼠DRG神经元上的TRPA1通道可能被醋酸铅所抑制。为证明醋酸铅对TRPA1通道的作用,在HEK293细胞中外源性表达mTRPA1和hTRPA1通道基因,检测醋酸铅对TRPA1通道介导的HEK293细胞钙荧光的影响。结果表明,醋酸铅的确能抑制mTRPA1和hTRPA1通道介导的HEK293细胞钙荧光,该荧光被抑制表明醋酸铅抑制了mTRPA1和hTRPA1通道介导的钙离子内流。进一步在爪蟾卵母细胞中外源性过表达hTRPA1通道,对醋酸铅抑制hTRPA1的作用进行进一步的定量分析。结果表明,醋酸铅浓度依赖性地抑制hTRPA1通道介导的电流。以上结果均表明,醋酸铅对TRPA1通道具有抑制作用。
TRPA1通道广泛分布于DRG、三叉神经节和结状神经节,这些神经广泛支配着皮肤、呼吸道和胃肠道等组织器官。TRPA1通道的生理功能与疼痛和机械感受相关,其受到抑制可使皮肤对外界的机械感受能力下降。铅是一种亲神经性毒物,体内蓄积到一定水平可引起神经组织损害,铅中毒重症病例导致铅麻痹,出现垂腕、垂足等症状。李颖等[5]临床研究表明,在124例铅中毒患者中,92例出现了触痛觉障碍,比例高达74.2%。触痛觉障碍表明外周神经系统与触痛觉感受相关的途径出现了障碍,TRPA1通道是外周神经系统与触痛觉相关的离子通道。本研究结果表明,醋酸铅对TRPA1通道具有抑制作用,提示醋酸铅对TRPA1通道的抑制作用可能是其外周神经系统毒性的重要组成部分。
日常生活中接触到的大气、土壤、尘埃、水、装饰材料、日用品、玩具和学习用品都可能含有铅。铅在人体内长期积累对人体危害极大,铅抑制hTRPA1通道介导的电流的IC50仅为2.4 μmol·L-1,而人体内血铅浓度>100 μg·L-1(约0.5 μmol·L-1),即视为铅中毒,这个浓度接近铅抑制TRPA1通道的浓度。
研究表明,我国人口的铅中毒比例约10%。杜静等[15]研究大庆地区儿童铅中毒的比例,城区儿童血铅浓度≥100 μg·L-1的比例高达21.1%,农村儿童则为18.4%,且随着年龄的增长,铅中毒的比例逐渐增高。随着现代化工业、交通、运输业的快速发展,铅污染的危害可能会日益加重,研究铅中毒机制从而寻求有效的治疗方法已成为重要的课题。本研究发现,醋酸铅对TRPA1通道有抑制作用,为醋酸铅对TRPA1通道的抑制作用机制及其外周神经系统毒性作用的研究提供了实验依据。
[1]Ruan SY,Gu ZW,Xiang CQ,Qin YQ,Zhang YY,Shen H.Effect of lead exposure on permeability,calcium distribution,microtubules and filaments of neurons[J].Occup Health Emerg Rescue(职业卫生与应急救援),2000,18(1):9-11.
[2]Winneke G,Collet W,Lilienthal H.The effects of lead in laboratory animals and environmentallyexposed children[J].Toxicology,1988,49(2-3):291-298.
[3]Waldmann R,Lazdunski MH.H(+)-gated cation channels:neuronal acid sensors in the NaC/DEG family of ion channels[J].Curr Opin Neurobiol,1998,8(3):418-424.
[4] Yang Z.Non-linear regression analysis on inci⁃dence of legal contagious diseases[J].Pract Prev Med(实用预防医学),2003,10(5):716-718.
[5]Li Y,Luo GM,Xiao XB,Zhang XH,Huang L,Yu YX,et al.Analysis of clinical curative effects of nerve growth factor in treating peripheral nerve disease induced by lead poisoning[J].Pract Prev Med(实用预防医学),2012,19(8):1144-1145.
[6]Jordt SE,Bautista DM,Chuang HH,Mckemy DD,Zygmunt PM,Hogestatt ED,et al.Mustard oils and cannabinoids excite sensory nerve fibres through the TRP channel ANKTM1[J].Nature,2004,427(6971):260-265.
[7]Tai C,Zhu SS,Zhou N.TRPA1:the central mole⁃cule for chemical sensing in pain pathway?[J].J Neurosci,2008,28(5):1019-1021.
[8]Bautista DM,Jordt SE,Nikai T,Tsuruda PR,Read AA,Yamoah EN,et al.TRPA1 mediates the inflammatory actions of environmental irritants and proalgesic agents[J].Cell,2006,124(6):1269-1282.
[9]Macpherson LJ,Dubin AE,Evans MJ,Schultz PG,Cravatt BF.Noxious compounds activate TRPA1 ion channels through covalentmodification of cysteines[J].Nature,2007,445(7127):541-545.
[10]McNamara CR,Mandel-Brehm J,Bautista DM,Siemens J,Deranian KL,Zhao M,et al.TRPA1 mediates formalin-induced pain[J].Proc Natl Acad Sci,2007,104(33):13525-13530.
[11]Zygmunt PM,Högestätt ED.TRPA1[J].Handb Exp Pharmacol,2014,222:583-630.
[12]Yuan Y,Lu YP.The research progress of effects of lead on neuronal ion channels[J].Biol Teach(生物学教学),2009,34(9):5-6.
[13]Dai XQ,Ruan DY.Inhibitory effect of Pb2+on slowinactivating K+current inacutely isolated rat dorsal root ganglion neurons[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2002,16(3):176-181.
[14]Jang HO,Kim JS,Kwon WC,Kim JK,Kim DH,Kim WI,et al.The effect of lead on calcium release activated calcium influx in primary cultures of human osteoblast-like cells[J].Arch Pharm Res,2008,31(2):188-194.
[15]Du J,Yu XF,Zhang Y,Rong JM,Li BX.The investigation and analysis on 2087 cases of children′s blood lead level in Daqing area[J].Chin J Birth Health Hered(中国优生与遗传杂志),2010,18(5):134.
Inhibitory effect of lead acetate on TRPA1 channel in mice and humans
ZHAO Hong1,2,SONG Yu-zhu1
(1.Academy of Life and Science,Kunming University of Science and Technology,Kunming 650500,China;2.Kunming Institute of Zoology,Chinese Academy of Sciences,Kunming 650500,China)
OBJECTIVE To investigate the inhibitory effect of lead acetate on transient receptor potential A1(TRPA1)channel.METHODS TRPA1-mediated calcium influx in mice dorsal root ganglion(DRG)neurons and HEK293 cells expressing nouse TRP1(mTRPA1)and human TRPA1(hTRPA1)wasrecorded by intracellular calcium imaging.TRPA1-mediated currents were detected by two-electrode voltage clamp.RESULTS Lead acetate 3.0 and 10.0 μmol·L-1inhibited external calcium influx in DRG neurons by(36.7±4.1)%and(79.4±3.1)%(n=5),respectively.The inhibitory effect of lead acetate on hTRPA1-mediated current was concentration-dependent.Lead acetate 0.3,1.0,3.0,10.0 and 30.0 μmol·L-1inhibited the amplitudes of currents by(1.0±0.7)%,(11.6±0.8)%,(57.7±3.2)%,(93.6± 2.6)%and(91.2±2.0)%(n≥4),respectively,with the IC502.4 μmol·L-1.CONCLUSION TRPA1 channel may be an endogenous target of lead.Lead acetate inhibits TRPA1 channel at a very low concentration.
lead acetate;dorsal root ganglion;neuron;transient receptor potential A1 channel;two-electrode voltage clamp;calcium imaging
SONG Yu-zhu,E-mail:yuzhusong@kmust.edu.cn
R995
A
1000-3002-(2016)09-0949-06
10.3867/j.issn.1000-3002.2016.09.007
2015-11-07接受日期:2016-07-15)
(本文编辑:齐春会)
赵 红,硕士研究生,主要从事神经毒理学研究。
宋玉竹,E-mail:yuzhusong@kmust.edu.cn

