探讨染色体微阵列分析在无明显表型异常成年人中的临床应用
何薇 吴菁 卢建 尹爱华
(广东省妇幼保健院 医学遗传中心,广东 广州 510010)
探讨染色体微阵列分析在无明显表型异常成年人中的临床应用
何薇 吴菁 卢建 尹爱华*
(广东省妇幼保健院 医学遗传中心,广东 广州 510010)
目的 探讨染色体微阵列分析(CMA)技术在无明显表型异常成年人中的临床应用。方法 选取2014年1月至2016年5月在广东省妇幼保健院医学遗传中心进行的,无明显表型异常成人外周血CMA病例,共计136例进行回顾性分析,所有病例均进行了染色体G显带核型分析及CMA检测。结果 33例因产前诊断胎儿CMA阳性进行外周血CMA检测,外周血CMA检测结果阳性有10例,占总病例的30.3%,占家庭数的52.6%;76例因不良生育史进行外周血CMA检测,外周血CMA检测结果阳性有9例,占总病例的11.8%,占家庭数的16%;25例因夫妇一方染色体异常进行外周血CMA检测,外周血CMA检测结果阳性有3例,占总病例的12%;2例因特殊家族史进行外周血CMA检测的,外周血CMA均未见明显异常。结论 对于无明显表型异常的成年群体可以有针对性地选择CMA检测,可以明确其遗传学病因,从而提供更全面详细的细胞遗传学信息及遗传咨询。
无表型异常成年人;染色体微阵列分析技术;染色体核型分析
染色体微阵列技术(chromosomal microarray analysis, CMA)代表所有以微阵列为技术基础的基因组拷贝数分析技术,包括基于比较基因组杂交的微阵列( array-based comparative genomic hybridization,aCGH)和基于单核苷酸多态性的微阵列( single nucleotide polymorphism arrays,SNP arrays)。染色体微阵列技术有高分辨率、高敏感性、高通量、快速准确、易于自动化、样品用量少等优点,基于以上这些优点,该项技术现已广泛地应用于生物医学的各个领域,特别是对产前遗传性疾病的诊断[1-5]。
对于超声异常胎儿孕期产前诊断首选CMA,美国妇产科医师协会(ACOG)和母胎医学协会(SMFM)提供的指南中指出,对于只要了解介入性产前诊断风险、CMA检测意义及局限性者,产前超声没有任何异常也可进行胎儿CMA检查[6]。无明显表型异常的成人,并不代表CMA检测结果无异常,即便是检测出特定疾病,其在不同患者间临床表现可能存很大变异以及对后代的影响不尽相同,原因可能与累及基因的表现度和外显率不同有关,因此CMA检测在该类群体中有一定的意义。目前暂无指南对无明显表型异常的成人群体提供明确指导性的检测建议,本文章旨在通过回顾性分析本中心在2014年1月至2016年5月无明显表型异常成人外周血CMA病例,探讨CMA在无明显表型异常成年人群中的临床应用价值。
1 资料与方法
1.1 研究对象 分析2014年1月至2016年5月在广东省妇幼保健院医学遗传中心进行外周血CMA检测,且年龄≥18岁以上的病例,年龄在18~57岁,平均(29.57±5.96)岁,共计136例,包括33例产前诊断胎儿CMA阳性,76例不良生育史,25例因夫妇一方染色体异常及2例特殊家族史进行外周血CMA检测。
1.2 实验方法
1.2.1 标本采集 抽取静脉血5ml,所有标本均进行染色体核型分析及CMA检测。
1.2.2 染色体核型分析 对外周血标本进行常规制片、G显带分析,显微镜下检查20个核型,分析3个核型,若出现嵌合体则检查50个或100个核型。
1.2.3 CMA检测 本中心在2016年4月之前,采用Agilent公司生产的8×60k芯片进行全基因组扫描检测,自2016年4月开始,采用美国Affymetric公司提供的高分辨率全基因组Cytoscan 750K芯片对全基因组已知基因区域的拷贝数进行分析,Affymetric平台不仅能检测基因组缺失、重复,还能检测杂合性缺失和单亲二体。实验操作严格按照各个公司提供的操作流程。
1.3 数据分析 分析过程分别参照本中心内部数据库以及在线公开数据库,如DGV数据库、DECIPHER数据库、OMIM数据库等。
2 结果
2.1 排除11例表型异常病例,对136例无明显表型异常者外周血CMA检测的病例汇总分析,具体见表1。
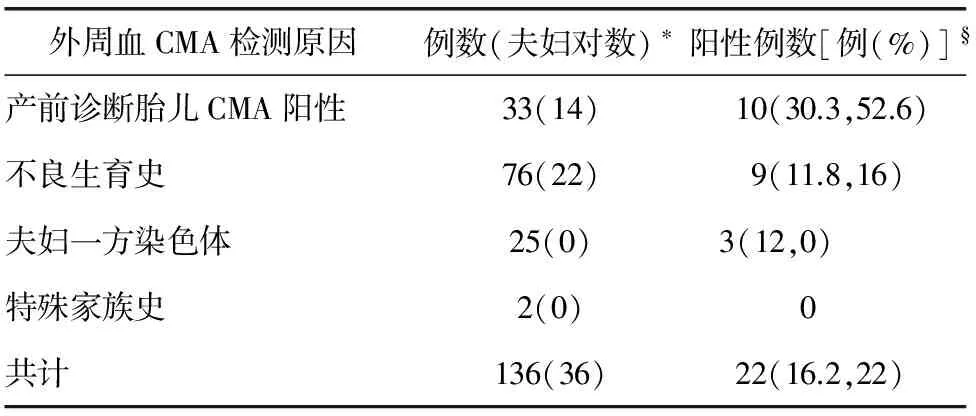
表1 136例无明显表型异常成人外周血CMA检测结果
注:*夫妇对数,若夫妇双方都进行CMA检测,算一对夫妇,例数算2例;§百分率,括号中有两个数值,第一个数值的是阳性病例数的百分率,第二个数值是阳性家庭数(一对夫妇算一个家庭)的百分率
2.2 2 2例外周血CMA检测阳性病例结果汇总分析,具体见表2。
3 讨论
3.1 CMA检测结果分析 33例因产前诊断胎儿CMA阳性进行外周血CMA检测,其中包括14对夫妇,外周血CMA检测结果有10例阳性,占总病例的30.3%,占家庭数(双亲同时做则算一个家庭)的52.6%,遗传自双亲的10例,除case1(在孕20+周,超声提示胎儿骨骼发育异常:胸廓狭窄、四肢长骨短小、双足内翻、颈段及骶尾段椎体异常)、case2、case5和case7选择终止妊娠,其余6例均选择继续妊娠。4例NT增厚病例,NT厚度分别为3.6mm、2.7mm、2.6mm和3.0mm,根据本中心总结NT数值与产前诊断阳性例数相关性及国内外数据[7,8],现已将NT≥3.0mm定义为NT增厚,尤其对于NT≥3.5mm者,更应建议选择介入性产前诊断,排除胎儿染色体异常。有4例22q11微重复综合征,均在双亲中找到了遗传来源,双亲携带者均无明显异常。
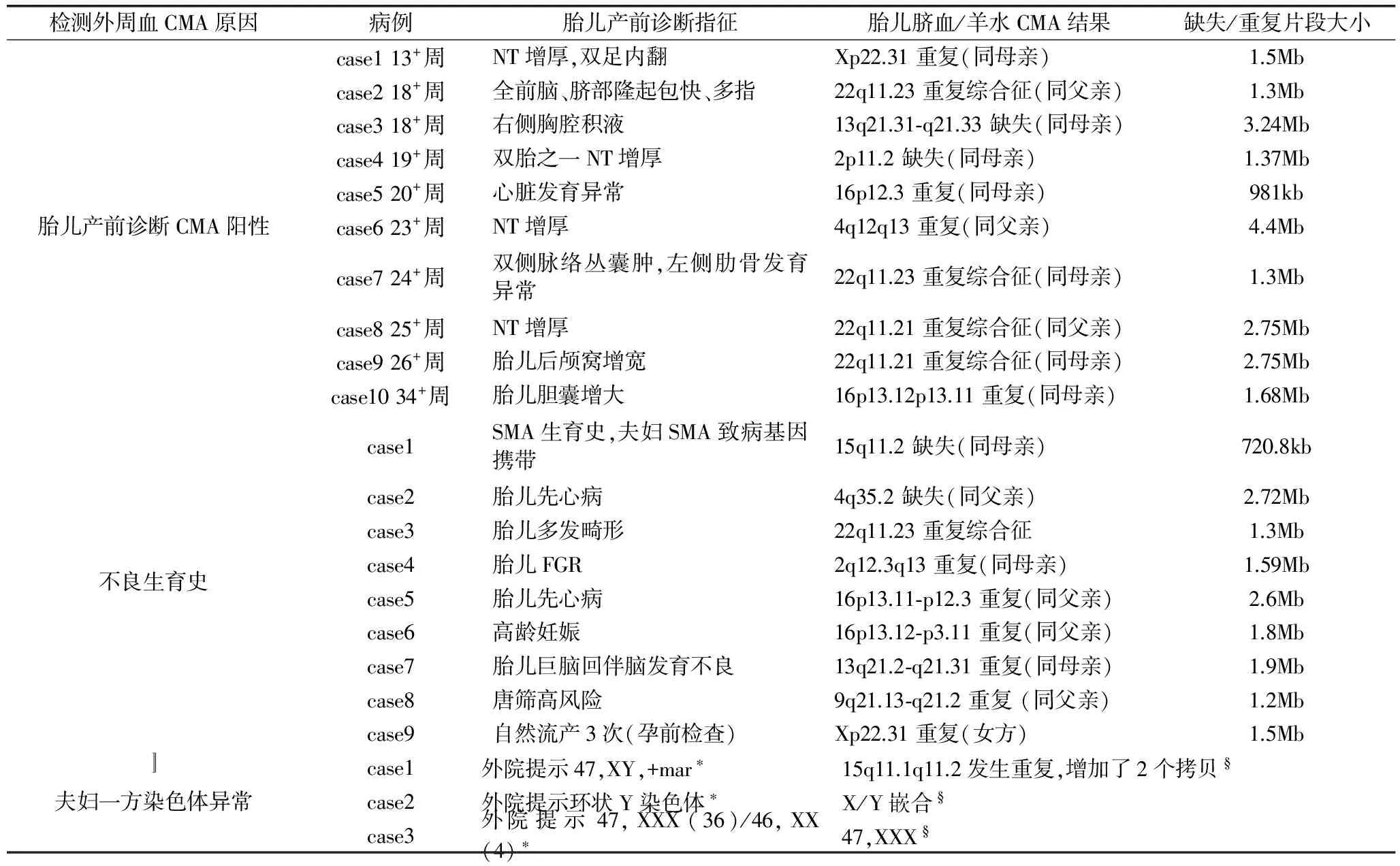
表2 22例外周血CMA阳性病例
注:*外周血染色体G显带结果;§外周血CMA结果
76例因不良生育史进行外周血CMA检测,其中包括22对夫妇,外周血CMA检测结果有9例阳性,占总病例的11.8%,占家庭数的16%。该组病例有些是因为既往孕期发现胎儿超声异常,进行了胎儿CMA检测,但夫妇双方拒绝CMA检测,对于不明原因的CNV无法判断来源及胎儿预后,选择终止妊娠为结局,当再次备孕或妊娠时,在孕前或孕期选择性的进行夫妇双方或一方外周血CMA检测。9例阳性病例均同既往引产胎儿染色体微缺失或微重复一致。建议在产前发现CNV时,胎儿双亲应及时进行CMA检测,虽然目前发现一些CNV在父母身上表型是正常的,下一代身上表型是异常的[9],但进行胎儿双亲CMA检测,仍然可对胎儿预后的评估起到不可替代的意义。Case9,患者本人既往史无特殊,无明显表型异常,G3P0,自然流产3次,其中2次流产物FISH均提示8号三体,外周血染色体G显带核型分析提示:46,XX,9qh+,16qh+,外周血CMA检测结果提示:X染色体X22.31位置发生重复,片段大小约1.5Mb。该重复区域包含HDHD1A、STS、VCX、PNPLA4基因,其中STS基因的纯合性缺失可导致X连锁鱼鳞病,但该区域的重复是否致病尚存在争议,有学者认为与发育迟缓、癫痫等有关,亦有学者认为可能是良性变异,因此该CNV的临床意义不明,建议下次孕期行产前诊断。
25例因夫妇一方染色体异常进行外周血CMA检测,外周血CMA检测结果有3例阳性,占总病例的12%。值得说明的,染色体G显带对CMA检测是有效补充,特别在染色体提示数目异常,结构异常等情况下。因此,在条件允许情况下,尽量选择染色体G显带及CMA同时检测。该25例夫妇一方染色体异常,均不属于染色体数目异常,其中2例是嵌合体,23例是无法确认异常片段的来源和性质。Case1外周血CMA结果发现15号染色体15q11.1-q11.2发生重复,增加了2个拷贝,提示marker染色体可能来源于15号染色体,目前尚无证据表明该区域重复可以致病。
2例因特殊家族史进行外周血CMA检测的,均是家族中有2名或2名以上先天性智障者,其外周血CMA未见明显异常。
在2014年1月至2016年5月期间,有11例成年表观异常者选择外周血CMA检测,共有2例阳性,占总病例数的18.1%。与其他几组数据比较,除“因产前诊断胎儿CMA阳性”组(30.3%,52.6%),成年表观异常组的CMA阳性率均较其他几组高。在欧美国等发达国家CMA检测已被广泛应用于智力障碍、儿童早期发育迟缓、新生儿出生缺陷、孤独症谱系障碍等[10,11],CMA检测应用于表型异常者,即应用于先证者时阳性检出率明显增加。在遗传咨询时,若家族中存在先证者,应建议先证者先进行检测,根据检测结果,咨询者再相应的选择检查项目。
3.2 CMA检测的局限性 CMA是一种基于基因芯片技术的染色体病诊断方法,可以检测染色体核型分析不能诊断的小片段缺失或重复(限于所选平台检测范围内的),但是无法检出染色体平衡易位(相互易位、罗伯逊易位)、倒位等不存在片段缺失或重复的染色体结构异常、也不适合检测染色体多倍体(如三倍体、四倍体)、异常比率较低(≤20%)的嵌合体以及其他拷贝数没有变化的染色体畸变、基因重组和点突变则无法检测。单独选择CMA,不进行外周血染体G显带检测时会遗漏部分染色体结果异常的病例。
CMA能够在全基因组水平进行扫描,可检测染色体不平衡的拷贝数变异 (copy number variant, CNV)尤其是对于检测染色体组微小缺失、重复等不平衡性具有突出优势。因 CMA 得到的检测结果信息量大,健康个体普遍存在拷贝数多态性,需要结合 CNV 片段的大小、位置和基因含量,并查阅相关数据库来判断 CNV 的性质。按照指引的分类[12,13],CNV可分为致病CNV、可能致病CNV、临床意义不明CNV(variants of unknown significance,VOUS)、可能良性CNV和良性CNV,焦点在“VOUS”,值得探讨的在“可能致病的CNV、可能良性的CNV”。VOUS其中部分情况是罕见的新生突变,部分与突变基因的外显率有关,即胎儿有罹患某种遗传病的易感性,但并不一定发病。一些CMA阳性结果的发现不能确定其是否有临床价值,需要对先证者双亲进行相应的检测来协助判断,如因“产前诊断胎儿CMA阳性”组,有10例CMA阳性,在先证者双亲中的一方外周血CMA检查结果中发现与胎儿类似CNV,说明该CNV为家族性变异。很多良性或者致病 CNV 虽已被证实,但由于表达的不稳定性和个体差异不完全的外显率,很多检测结果仍然不能被准确的解释。
3.3 CMA检测的遗传咨询 随着科技的发展,越来越多的分子遗传学检测项目应用于临床,如一代测序、二代测序等,所有遗传检测项目都应经过有丰富临床经验的医学遗传医师进行评估和咨询,针对咨询者的实际情况建议合适的检查。CMA检测亦是如此,在检查前,应充分告知检测者该项检查的范围、意义和局限性,在解释结果时,因很多基因变异的临床意义尚未明确,检测结果的相关结论是基于目前科学研究和数据库资料的基础上而得到,必要时需双亲,甚至家族成员进行相关检测,应充分解释。
3.4 容易忽略的咨询 CMA并不能检出所有的CNV,CMA探针的设计是关键基因区探针覆盖,例如,1、9、16号及Y染色体次缢痕区域和D组、E组染色体短臂等区域,这些区域并未设置检测探针,因此CMA检测结果未见异常,实际表明没有检测出关键基因在200kb以上的缺失或重复;对于低于检测分辨率的CNV也无法检出;CMA无法检测单基因遗传病的点突变异常、基因表达异常和甲基化异常;此外,CMA检测结果会带有预测性质的告知今后可能发生的疾病即成人期迟发型疾病,可能会带来恐慌和家庭纠纷,因在选择CMA检测时应充分告知,并使夫妇作出合理的决定;应用不同的平台及分辨芯片,针对同一样本进行检测有可能会出现差异性结果,这是由于检测本身的技术特点所决定,而并非医务人员造成误诊或漏诊。
3.5 无明显表型异常成人CMA检测的适用 建议在有资质及经验的医学遗传医师咨询后,充分了解CMA的意义、局限性及检测费用后,要求进行CMA检测者;胎儿产前诊断CMA报告提示意义床意义不明CNV(VOUS)、可能致病的CNV、可能良性CNV和良性CNV;子代发现外显率低的复发性CNV;不良生育史者(如因超声异常引产或生育异常患儿者);存在染色体嵌合体或不明原因染色体者。
CMA 技术在分子遗传学分析中有着显著的优越性,总结以上经验,对于无明显表型异常的成年群体可以有针对性地选择CMA 检测以明确其遗传学病因,从而提供科学的生育指导。随着 CMA技术的不断发展和完善,其检测价格将会在一定程度上降低,相信 CMA 技术会有更加广阔的应用前景。
[1] Wapner RJ, Martin CL, Levy B, et al. Chromosomal microarray versus karyotyping for prenatal diagnosis[J].N Engl J Med,2012,367(23):2175-2184.
[2] Hillman SC, McMullan DJ, Hall G, et al. Use of prenatal chromosomal microarray: prospective cohort study and systematic review and meta-analysis[J].Ultrasound Obstet Gynecol,2013,41(6):610-620.
[3] Reddy UM, age GP, Saade GR, et al. Karyotype versus microarray testing for genetic abnormalities after stillbirth[J].N Engl J Med,2012,367(23):2185-2193.
[4] Dhillon RK, Hillman SC, Morris RK, et al. Additional information from chromosomal microarray analysis (CMA)over conventional karyotyping when diagnosing chromosomal abnormalities in miscarriage: a systematic review and meta-analysis[J].BJOG, 2014, 121(1):11-21.
[5] Coils P, Escudero T, Fischer J, et al. Validation of array comparative genome hybridization for diagnosis of translocations in pre-implantation human embryos[J].Reprod Biomed Online,2012,24(6):621-629.
[6] South ST, Lee C, Lamb AN, et al. ACMG standards and guidelines for constitutional cytogenomic microarray analysis, including postnatal and prenatal applications: revision 2013[J].Genet Med, 2013, 15 (11):901-909.
[7] Sahota DS, Leung WC, To WK, et al. Quality assurance of nuchal translucency for prenatal fetal down syndrome screening[J]. J Matern Fetal Neonatal Med, 2012, 25(7): 1039-1043.
[8] 周祎, 鲁云涯, 陈涌珍,等.颈项透明层增厚胎儿的产前诊断及预后分析[J].中山大学学报医学科学版,2013,34(6):888-893.
[9] Girirajan S, Eichler EE. Phenotypic variability and genetic susceptibility to genomic disorders[J]. Hum Mol Genet,2010,19(2):176-187.
[10] Shaffer LG, Rosenfeld JA. Microarray-based prenatal diagnosis for the identification of fetal chromosome abnormalities[J]. Expert Rev Mol Diagn,2013,13(6):601-611.
[11] Miller DT, Adam MP, Aradhya S, et al. Consensus statement: Chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies[J]. Am J Hum Genet, 2010, 86(5):749-764.
[12] Kearney HM, Thorland EC, Brown KK, et al. American College of Medical Genetics standards and guidelines for interpretation and reporting of postnatal constitutional copy number variants[J].Genet Med,2011, 13 (7):680-685.
[13] 染色体微阵列分析技术在产前诊断中的应用协作组.染色体微阵列分析技术在产前诊断中的应用专家共识[J].中华妇产科杂志,2014,49(8):570-572.
编辑:宋文颖
Objective To evaluate the contribution of chromosome microarray analysis (CMA) in adults those who with no obvious phenotypic abnormalities. Method 136 no obvious phenotypic abnormality cases between January 2014 and May 2016 were retrospectively, at Medical Genetics Center of Guangdong Women and Children’s Hospital, all of the cases were evaluated by the traditional karyotype and CMA. Results Fetal prenatal diagnosis CMA positive group have 33 cases,10 cases of peripheral blood CMA positive, accounting for 30.3% of the total cases,52.6% of the number of households; adverse reproductive history group have 76 cases, 9 cases of peripheral blood CMA positive , accounting for 11.8% of the total cases, 16% of the number of households; one of the couple chromosomal abnormalities group have 25 cases, 3 cases of peripheral blood CMA positive, accounting for 12% of the total cases; special family history group have 2 cases, peripheral blood CMA results were no significant abnormalities. Conclusions The application of CMA in adults with no obvious phenotypic abnormalities, can identify the etiology genetic, provide more comprehensive and detailed cytogenetic information and genetic counseling.
adults with no obvious phenotypic abnormalities;chromosome microarray analysis; karyotype
10.13470/j.cnki.cjpd.2016.04.007
R714.55
A
2016-09-25)
DOI: 10.13470/j.cnki.cjpd.2016.04.008
*通讯作者:尹爱华,E-mail:yinaiwa@126.vip.com

