一种模拟心脏血流形态的药物洗脱支架的药物释放装置
姚天平,邹凤平,颜文涛,黄嘉华
上海市医疗器械检测所,上海市,201318
一种模拟心脏血流形态的药物洗脱支架的药物释放装置
【作者】姚天平,邹凤平,颜文涛,黄嘉华
上海市医疗器械检测所,上海市,201318
该文介绍了一种新型模拟心脏血流形态的药物释放装置,利用该装置来模拟人体生理环境下药物洗脱支架中药物的释放。实验结果表明,该装置测定释放度的结果满足试验规律,具有一定的体内外相关性,从而说明本装置具备作为体外释放度测定方法的价值。
释放装置;药物洗脱支架;雷帕霉素
经皮血管支架植入术(Percutaneous Coronary Intervention, PCI)是治疗动脉血管狭窄较为有效的手段之一,然而普通金属裸支架植入后容易引起血管平滑肌细胞的内膜增生和细胞外基质的沉淀[1],有报道称金属裸支架再狭窄率高达50%[2],这已成为影响PCI手术远期治疗效果的主要障碍。近年来研制的药物洗脱支架(Drug Eluting Stent, DES),通过药物缓慢释放能够显著抑制血管平滑肌细胞及新生内膜的过度增殖,降低PCI术后再狭窄率,开创了PCI技术新的里程碑。
体外释放度是评价药物洗脱支架安全有效性的重要指标。目前,药物支架的释放度测定常常借鉴美国药典USP<711>第四法和USP<724>第七法。其中,USP<711>第四法,其设计原理主要是通过泵将释放介质以一定的脉动频率对药物支架进行冲刷,该设计比较接近支架在血管所承受径向脉动频率的生理状态,但没有体现支架在血管中所承受的纵向脉冲压力。USP<724>第七法,通过药物支架在释放介质中垂直上下反复运动,此方法也没有体现支架在血管中承受脉动频率和脉动压力的冲洗过程。此外,陈玉成[3]等设计的用于雷帕霉素药物涂层缓释试验的心脏泵血模拟装置,采用蠕动泵转速为60 r/min进行临床模拟,只考虑了血液冲刷的流速,也没有考虑血管内支架承受的脉冲压力和模拟血管对药物释放的影响。
目前,尚未有文献报道最佳的药物释放装置,来模拟药物支架在血管中更合适的释放状态。本文设计了一种新型模拟心脏血流形态的药物释放装置测定支架上雷帕霉素药物的释放度,将扩张后的支架置于具有一定顺应性的模拟血管中,通过蠕动泵产生脉冲频率使释放介质冲刷支架,同时,利用释放介质与支架水平位置产生的自然高度落差,设计出与血管相同的脉冲压力,模拟血管支架在血管中同时承受脉冲压力和脉冲频率的作用环境,保证释放试验更加贴合临床实际,为载药支架释放度测定研究提供参考。
1 新型模拟心脏血流形态释放装置
1.1 原理
血管支架大多置于具有一定顺应性的动脉血管中,其纵向承受一定脉动频率、流量流速的血液冲刷,径向承受80~160 mmHg(1 mmHg=133.32 Pa)的脉动压力。本文正是基于此临床实际设计了模拟心脏血流形态释放装置。该装置的基本原理是将雷帕霉素支架置于模拟血管中并扩张固定,将装有药物支架的模拟血管与蠕动泵连接形成封闭的循环体系,利用释放介质与支架水平位置产生的自然高度落差,配合蠕动泵的作用,设计出与血管相同的脉冲压力。在37±1oC恒温条件下,以0.1%十二烷基硫酸钠(SDS)作为释放介质,采用脉冲压力为80~160 mmHg,脉冲频率为72±1次/min的蠕动泵使释放介质循环流动,冲洗雷帕霉素支架,来考察支架上药物的释放规律。
1.2 组成
模拟心脏血流形态的药物释放装置(专利号:ZL 2015 2 0451074.7)见图1,主要由温度控制器、储液槽、蠕动泵、模拟血管和压力传感器组成。蠕动泵用于控制管路中释放介质的流量、频率和压力,压力传感器用于快速采集管路中压力的变化,支架置放于模拟血管中。释放介质通过蠕动泵,由储液槽流动到模拟血管,再经外导管流回储液槽,从而形成一个封闭的循环管路。
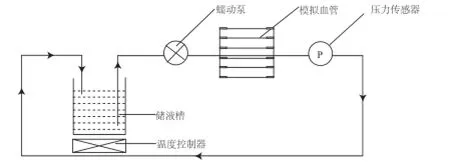
图1 模拟心脏血流形态释放装置原理图Fig.1 The schematic diagram of simulating dissolution device for drug release of drug-eluting stent
1.3 操作步骤
新型模拟心脏血流形态释放装置实物图见图2。该装置的整个恒温箱维持药物释放介质的温度为37±1oC,试验所有管路均为模拟血管。装置的上半部分为磁力搅拌加热部分和蠕动泵,磁力搅拌加热部分也是为了保证释放介质温度控制在37±1oC。蠕动泵提供固定脉动频率和流量的释放环境。装置的下半部分为支架安装处,在蠕动泵的配合下,支架与释放介质高度差产生一定脉冲压力,压力表监控压力变化在80~160 mmHg。
开启磁力搅拌器的加热和搅拌,待释放介质的温度达到37±1oC后,将六根支架依次间隔安装到支架管路上。然后启动蠕动泵并调节泵流速为80±5 mL/min,开启外箱空气加热部分,并关闭外箱门,此时模拟心脏血流形态释放装置提供释放介质温度为37±1oC,蠕动泵脉冲速度为72 次/min,脉冲压力为80~160 mmHg的模拟释放试验。到达对应的取样时间点(2 h,24 h,3 d,7 d,14 d和28 d)后,停止蠕动泵,取下支架即可。
1.4 技术参数
仪器的技术参数见表1。

图2 药物释放装置Fig.2 Simulating dissolution device for drug release of drug-eluting stent

表1 仪器的技术参数Tab.1 The technical parameters of simulating dissolution device
2 实验方法
2.1 雷帕霉素释放试验的设计
药物释放取样时间点的选择应该能够体现药物释放的初始阶段,中间阶段和最后阶段。根据《中华人民共和国药典》2015年版四部通则9013缓释、控释和迟释制剂指导原则[4],缓释制剂应从释药曲线图中至少选出3个取样时间点,第一点为开始0.5~2 h的取样时间点,用于考察药物是否有突释,第二点为中间取样时间点,用于确定释药特性,最后的取样时间点,用于考察释药是否基本完全。美国食品药品监督管理局针对冠状动脉洗脱支架的临床试验和非临床试验发布的作业指导文件[5]指出,支架药物洗脱曲线应该至少用3个点来体现释放的三个阶段。奚廷斐[6]则建议药物洗脱支架的释放度测定至少需要5个点,其中释放初期和中间阶段取3个时间点来表征,而药物释放最后阶段则至少需要2个时间点来表征。本文设计2 h、24 h、3 d,7 d,14 d和28 d的时间点来监测雷帕霉素的释放率,包括了释放初期,中期和后期三个阶段,能够起到考察释放规律的目的。
2.2 雷帕霉素释放测定
2.2.1 材料及仪器
冠脉雷帕霉素洗脱钴基合金支架系统由上海微创医疗器械(集团)有限公司提供(规格:2.5 mm×13 mm);雷帕霉素药物对照品(HPLC含量为98.48%)由北京世纪奥科生物技术有限公司提供;甲醇(HPLC级)、乙腈(HPLC级)和丙酮(HPLC级)均购自Merck公司;十二烷基硫酸钠(生物纯)购自Genebase公司;超纯水(18.2 MΩ)来自经计量后自购设备(Millipore公司);微量天平(型号:XP6,分辨率0.001 mg)购自梅特勒-托利多公司;高效液相色谱仪(Waters Alliance2695/2487,紫外检测器)购自Waters公司;模拟血管(顺应性5%~7%)购自东易中美科技(北京)有限公司。
2.2.2 测试程序
2.2.2.1 高效液相色谱条件
流动相比例:甲醇/乙腈/水=60/ 16/ 24(V/V/V),流速:1.0 mL/min,柱温:40oC,C18分析柱(规格:4.6 mm×250 mm,粒径5 µm),检测波长:277 nm,进样量:20 µL,运行时间:40 min。
2.2.2.2 释放介质的制备
配制 0.1%(g/mL)的十二烷基硫酸钠纯化水溶液1 000 mL,置于三角锥形瓶中,超声脱气 15 min,置于磁力搅拌器上作为释放介质待用。
2.2.2.3 支架的安装和取出
开启磁力搅拌器和外箱空气加热部分,调节温度至37±1oC,将支架依次间隔安装到支架管路上。启动蠕动泵并调节泵流速为80±5 mL/min,释放装置开始提供脉冲速度为72 次/min,脉冲压力为80~160 mmHg的模拟释放试验。到达相应的释放时间点,取下支架压扁后置于10 mL容量瓶中,加入0.5 mL丙酮浸没3 min,再用乙腈定容至10 mL,混匀用上述HPLC色谱条件测定支架上雷帕霉素的残留量。最后按照公式(1)计算支架上雷帕霉素的药物释放率:

3 结果与讨论
3.1 雷帕霉素释放试验测定结果及处理
雷帕霉素释放试验测定结果及处理参见图3。从释放曲线图可以看出,取样时间点2 h、24 h、3 d,7 d,14 d和28 d时,新型模拟心脏血流形态释放装置测得的雷帕霉素释放率分别为17%,39%,51%,67%,72%,83%。结果显示,药物在前24 h内释放较快,之后逐渐减缓,达到28 d后,释放基本完全,总体上释放过程呈前快后慢趋势。因此,该装置可以有效的评估药物支架的释放初期,中期和最后阶段,符合缓释、控释和迟释制剂指导原则。

图3 雷帕霉素释放曲线Fig.3 The drug-releasing curve of rapamycin-eluting stent

图4 药物释放试验结果Fig.4 The results of drug release
3.2 雷帕霉素药物支架体外体内释放一致性的评估
药物活性成分进入体内的程度和速度是评价药物有效性的重要手段,通常以建立体内吸收-时间曲线来评价,寻找体内释放规律,建立良好的体内外相关关系,使体内外释放规律具有相关性。Ma等[7]研究了紫杉醇和雷帕霉素混合药物支架体内体外21 d的释放行为。体外释放介质选择磷酸盐缓冲液(PBS)体系,体内释放则选择将支架植入雄鼠的腹主动脉进行评价,结果如图4所示。体外实验表明,在PBS体系体外释放试验中,药物在第一周释放率为51.7%。后期药物释放呈现缓慢趋势,21 d后,雷帕霉素释放率为69.6%。体内试验结果表明,药物在前3 d释放量较大,相比体外在第一周突释的时间要提早些,后期药物释放呈缓慢趋势。体内释放试验21 d后,雷帕霉素释放率为91.7%,药物基本释放完全。通过体内体外释放规律的比较,可以看出药物在体内外的释放具有相似性。
从上面文献可以看出,药物支架在体内释放呈现两个规律:①药物释放不是瞬间完成,而是前快后慢的释放规律;②支架植入体内21 d后,药物的释放率达到80%以上,基本释放完全。本装置测定体外释放度的结果满足这两条试验规律,具有一定的体内外相关性,从而间接说明本装置具备作为体外释放度测定方法的价值。
4 结论
含药金属支架通常将药物涂层涂覆于支架外表面,植入人体后,载药表面贴合于血管壁,在人体血液脉冲压力和脉冲频率的共同冲刷作用下,向病变部位缓慢释放雷帕霉素,达到抑制血管平滑肌细胞及新生内膜过度增殖的作用。与美国药典USP<711>第四法、USP<724>第七法和陈玉成[3]等测定载药支架药物释放度的方法相比,模拟了药物支架在体内脉冲压力和脉冲频率共同冲刷作用下的生理环境。利用该新型装置测得的雷帕霉素体外释放规律与体内释放结果具有一致性。因此,本文设计的模拟心脏泵血的药物洗脱支架释放装置可以用于药物体外释放度试验的评价。
[1] 钟杨, 武衡, 成志, 等. 雷帕霉素抑制血管平滑肌细胞增殖的研究进展[J]. 临床和实验医学杂志, 2009, 8(4): 130-131.
[2] Schiele TM. Current understanding of coronary in-stent restenosis[J]. Z Kardiol, 2005, 94 (11): 772-790.
[3] 陈玉成, 熊素彬, 幸浩洋, 等. 雷帕霉素缓释涂层支架在模拟心脏泵血状态下的体外释药研究[J]. 中国药学杂志, 2008, 43(9): 688-692.
[4] 中华人民共和国药典委员会编. 9013缓释、控释和迟释制剂指导原则[z]. 中华人民共和国药典2015年版四部, 2015: 368-370.
[5] Food and Drug Administration, US Department of Health and Human Services. Guidnce for industry-coronary drug-eluting stents—nonclinical and clinical studies DRAFT GUIDANCE[S]. 2008.
[6] 奚廷斐. 药物洗脱支架评价指南[R/OL]. http://upload.haoyisheng. com/conference/20090220/ywxtzjpjzn.ppt.
[7] Ma XD, Oyamada S, Gao F, et al. Paclitaxel/sirolimus combinationcoated drug-eluting stent: in vitro and in vivo drug release studies[J]. J Pharm Biomed Anal, 2011, 54 (4): 807-811.
A Drug Delivery Device for Drug-eluting Stents Simulating the Cardiovascular Blood Flow Pattern
【Writers】YAO Tianping, ZOU Fengping, YAN Wentao, HUANG Jiahua
Shanghai Testing and Inspection Institute for Medical Device, Shanghai, 201318
A novel drug delivery device simulating the cardiovascular blood f ow pattern was introduced. The device was used to simulate the in vivo drug release in the drug-eluting stents. The results regarding the drug release rate were subject to the pattern from in vivo measurement. Therefore, the device was validated as a measurement method for in vivo drug release rate.
simulating dissolution device, drug-eluting stent, rapamycin
TQ460.1;R318.08
A
10.3969/j.issn.1671-7104.2016.05.003
1671-7104(2016)05-0322-04
2016-07-28
上海市科委课题 (13441902600)
姚天平,E-mail: ytp_2013@163.com
——雷帕霉素

