造血干细胞移植后神经系统并发症的临床分析
尹 周,张 平, 张 莹, 唐晓文*, 付铮铮, 陈 峰, 薛胜利, 余自强, 孙爱宁, 吴德沛, 董万利, 薛 群*
1.苏州大学附属第一医院神经内科,苏州 215006 2.苏州大学附属第一医院血液科, 苏州 215006
短篇论著
造血干细胞移植后神经系统并发症的临床分析
尹 周1,张 平2, 张 莹1, 唐晓文2*, 付铮铮2, 陈 峰2, 薛胜利2, 余自强2, 孙爱宁2, 吴德沛2, 董万利1, 薛 群1*
1.苏州大学附属第一医院神经内科,苏州 215006 2.苏州大学附属第一医院血液科, 苏州 215006
目的:分析造血干细胞移植(HSCT)后神经系统(NS)并发症的临床特点,评估HSCT后患者发生NS并发症的相关危险因素,以提高HSCT后NS并发症的诊断和治疗,改善患者预后。方法:回顾性分析2012年8月至2015年8月87例HSCT后发生NS并发症患者的临床资料。结果:87例HSCT伴NS并发症患者中,中枢性神经系统并发症占71.3%(62/87)、外周性占28.7%(25/87)。NS并发症的原发病中,急性淋巴细胞白血病(ALL)占34.5%(30/87)、急性髓性白血病(AML)占23.0%(20/87)、慢性髓性白血病(CML)占12.6%(11/87)、其他类型白血病和淋巴瘤占9.2%(8/87)、再生障碍性贫血占13.8%(12/87)、骨髓增生异常综合征占6.9%(6/87);移植相关因素中,人类白细胞抗原(HLA)全相合19例(21.8%)、半相合53例(60.9%)、无关相合15例(17.2%),分别有16.1%、69.4%、14.5%发生中枢神经并发症,36.0%、40.0%、24.0%发生外周神经并发症(χ2=6.682,P=0.034)。NS并发症的其他相关因素中,儿童组和成人组发生率分别为 26.4%(23/87)和73.6%(64/87,P=0.435);伴有移植物抗宿主反应(GVHD)或感染患者的NS并发症的发生率分别为 69.0%(60/87)和59.8%(52/87,P<0.05)。87例中,伴中枢神经并发症者发病时间1~726(中位数49 )d,伴外周神经并发症者发病时间20~694(中位数80)d。87例患者的病死率为33.3%(29/87),其中伴中枢神经并发症者病死率占93.1%(27/29),伴外周神经并发症者病死率占6.9%(2/29,P<0.05)。结论:HSCT后中枢性神经系统并发症较外周性发病率高,发病时间短,病死率高;HSCT后NS并发症与HLA配型、GVHD和感染有关。
造血干细胞移植;神经系统并发症; 危险因素
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)已成为治疗造血系统疾病的重要方法之一。随着HSCT的应用,移植后并发症也受到广泛关注。目前研究[1]显示,神经系统(nervous system,NS)并发症常是引起移植相关神经系统疾病和死亡的主要原因之一。 此外,HSCT患者的NS并发症发生率较高,预后一般较差,严重时可危及生命,故NS并发症的早期评估、诊断及防治对改善HSCT患者的预后非常重要。本研究通过回顾分析在我院 HSCT后发生NS并发症的患者的临床资料,探讨HSCT后NS并发症发生的影响因素及患者的预后,为减少HSCT后NS并发症的发生、提高HSCT后NS并发症的诊治水平提供依据。
1 资料与方法
1.1 一般资料 2012年8月至2015年8月在我院进行HSCT后伴发NS并发症的患者共87例,其中,男性47例,女性40例;年龄1~63岁,平均年龄(24.0±11.2)岁。87例中,急性淋巴细胞白血病(ALL)30例,急性髓性白血病(AML)20例,慢性髓性白血病(CML)11例,其他类型白血病 4例,淋巴瘤4例,再生障碍性贫血(AA)12例,骨髓增生异常综合征(MDS)6例。移植类型分别为:半相合53例,全相合19例,无关相合15例;骨髓移植32例,外周血移植24例,脐带血移植12例,脐带血和骨髓移植9例,外周血和骨髓移植9例,脐带血和外周血移植1例。
1.2 NS并发症诊断方法及分类 中枢神经系统(central nervous system,CNS)并发症的诊断:根据头颅CT和(或)MRI、EEG、肌电图、神经传导速度、体感诱发电位、脑脊液、生化、细菌或真菌、PCR、病毒DNA、抗体等检查结果及临床表现诊断。排除标准:原发NS疾病,与白消安等药物相关的非重复性发作或因情绪因素引起的非器质性疾病。NS并发症包括:脑血管病变(脑出血、脑梗死),中枢神经系统感染,脑病(代谢性脑病、药物毒性相关性脑病、移植物抗宿主病),癫痫,肿瘤复发,脱髓鞘脑炎,外周神经系统(peripheral nervous system,PNS)并发症(神经根病、周围神经病、肌病、其他外周神经病变)。
1.3 HLA相合程度 半相合HSCT为人白细胞抗原(HLA)配型3/6-5/6相合;全相合为6/6或10/10相合;无关相合为无关外周或骨髓HLA配型6/10-10/10相合和脐带血移植配型 4/6-6/6相合(包括采用多份脐带血移植)。
1.4 预处理方案 白血病和淋巴瘤采用经典或改良马利兰/环磷酰胺(Bu/Cy) 或马利兰/氟达拉滨(Bu/Flu)方案,MDS采用Bu/Cy方案,多发性骨髓瘤(MM)采用氟达拉滨/马法兰(Flu/Mel)或 Mel方案,重型再生障碍性贫血(SAA)采用Cy+抗人胸腺细胞球蛋白(ATG)方案。
1.5 急性移植物抗宿主病(aGVHD)的预防 单倍型、非血缘和脐带血HSCT采用ATG+环孢素A (CsA)/他克莫司(FK506)+短程甲氨蝶呤(MTX)和霉酚酸酯 (MMF)方案。同胞相合HSCT采用CsA+短程MTX +MMF方案。
1.6 统计学处理 采用SPSS 19.0 和GraphPad 6.0进行统计学分析。移植后24个月内的CNS并发症发生的累积概率用Kaplan-Meier方法分析。对有统计学意义的CNS并发症相关危险因素进行单变量分析;当事件数量不足够大时,采用Fisher精确检验进行分类变量分析。检验水准(α)为0.05。
2 结 果
2.1 伴发NS并发症患者的原发病特点 白血病等恶性肿瘤性疾病和AA等非恶性肿瘤性疾病分别有69 例和18例发生NS并发症,发病率为79.3%和20.7%。其中,ALL占34.5%(30/87)、AML占23.0%(20/87)、CML占12.6%(11/87)、其他类型白血病和淋巴瘤占 9.2%(8/87);AA占13.8%(12/87)、MDS占6.9%(6/87)。
2.2 HSCT后NS并发症的HLA相合及原发病分析 87例患者中,HLA全相合占21.8%、半相合占60.9%、无关相合占17.2%,分别有16.1%、69.4%、14.5%发生CNS并发症,36.0%、40.0%、24.0%发生PNS并发症(χ2=6.682,P=0.034)。62例(71.3%)发生CNS并发症,其中颅内感染12例(13.8%):细菌感染3例、病毒感染6例、真菌感染3例;脑血管病13例(14.9%):脑出血7例、脑梗死6例;脑病10例(11.5%):CsA或 FK506致中毒性脑病6例、Wernicke脑病1例、肝性脑病3例;脱髓鞘脑炎9例 (10.3%);癫痫16例(18.4%);原发病NS复发2例(2.3%)。25例(28.7%)发生PNS并发症,其中神经根病4例、周围神经病12例和肌病 6例、其他3例。NS并发症的HLA相合分析见表1。

表1 与NS并发症的HLA相合分析 n(%)
2.3 HSCT后NS并发症患者的其他临床特点分析 结果(表2)表明:男性47例,女性40例;年龄≤14岁23例、>14岁64例,中位年龄22 (1~63)岁。外周与中枢NS并发症患者的性别(P=0.817)和年龄(P=0.435)差异均无统计学意义。87例发生NS并发症的患者中合并移植物抗宿主病(GVHD)60例(69%),合并感染52例(59.8%)。外周与中枢NS并发症患者的HLA配型、合并GVHD或感染发生率差异均有统计学意义(P<0.001)。

表2 87例HSCT后NS并发症的临床特点 n(%)
2.4 HSCT后NS并发症发病时间及患者的预后 NS并发症于HSCT后1 ~726 d发生,中位发病时间60 d。CNS并发症于HSCT后1~726 d发生,中位发病时间49 d;PNS并发症于HSCT后20~694 d发生,中位发病时间80 d。87例中有29例病死,病死率为33.3%(29/87),包括CNS并发症27例、PNS并发症2例,2例发生PNS并发症患者的死亡原因为严重肺部感染。CNS并发症(93.1%)与PNS并发症患者病死率(6.9%)差异有统计学意义(χ2=10.13,P=0.001)。HSCT后发生中枢和外周NS并发症患者24个月累积生存率分别为7.6%(95%CI 4.7%~10.6%)、19.8%(95%CI 15.4%~24.2%),差异有统计学意义(P<0.05,图1)。
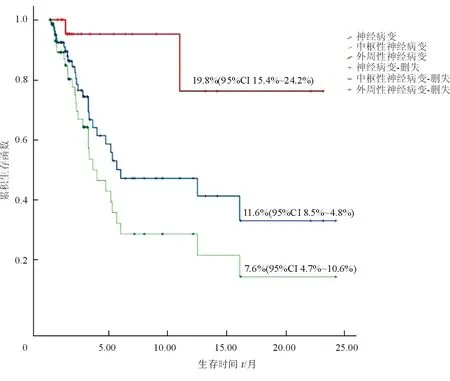
图1 HSCT后发生中枢和外周神经并发症患者的24个月累积生存率
3 讨 论
HSCT技术目前已成熟,但移植相关并发症较高,其中HSCT后NS并发症较常见。NS并发症通常发生在移植后急性期及移植后数月至数年内。国外临床研究显示,11%~59%的患者HSCT后会发生CNS并发症,并且HSCT后死亡患者尸检发现超过90%有NS病变[2];HSCT后17%主要死亡原因为中枢神经病变[3]。可见,HSCT后CNS并发症的实际发病率远高于临床诊断,并且有较高的病死率。
本研究中,原发病类型对HSCT后 NS并发症的发生率没有影响。但是不同原发病HSCT后NS并发症的组成有差异,白血病等恶性疾病以发生颅内感染、脑血管病变、脑病等为主,而AA等以发生PNS病变为主。这可能与恶性肿瘤患者使用化疗药物及抗排异药物有关。此外,本组病例中原发病CNS复发2例,均经多次治疗后才获得缓解。研究[4]表明,在CNS维持高浓度的药物如塞替哌或在CNS维持高活性的药物如达沙替尼有助于防止CNS复发。
非亲缘性移植[2]、脐带血移植[1]也与HSCT后NS并发症发生相关。本研究进一步证实,HLA相合程度是发生NS 并发症的高危因素之一,原因可能在于非血缘和单倍型HSCT往往采用更强的GVHD预防方案,特别ATG可使免疫重建延迟,导致机会感染增加;GVHD事件增多,导致发生颅内并发症的机会增多;放疗可引起血脑屏障破坏,增加其通透性,对NS有直接损伤作用,加之放疗对胸腺也有损伤作用,延迟免疫重建,导致中枢感染等并发症增多。
我们认为,CNS并发症(尤其是癫痫和脑病的发生)与常用的几种抗肿瘤药物有关。本研究中16例癫痫患者有14例使用马利兰(Bu)、10例脑病患者均使用环磷酰胺(Cy)或氟达拉宾(Flu)。资料显示白消安(马利兰)可引起癫痫发作[5],环磷酰胺可引起脑病, 氟达拉宾可引起延迟性脑病,顺铂、吉西他滨、阿糖胞苷和贝伐单抗均可引起后部可逆性脑病综合征(PRES)[6]。而CsA、FK506是预防GVHD的最常用药物。这些药物具有类似的神经毒性作用,特别是在相对大剂量治疗的前几个月内更易产生神经毒性作用。使用CsA的患者中有10%~40%出现神经毒性反应,接受FK506治疗的患者也有相近的神经毒性反应发生率[7]。所有伴发NS并发症的单倍型、非血缘和脐带血或同胞相合HSCT均用CsA或FK506预防aGVHD。CsA与FK506引发脑病的机制相似,均引起血管内皮损伤,常见于全血或血浆药物浓度高的患者,预处理强度影响CsA或FK506相关脑病的发生[8]。此外,FK506还可诱发脑血管炎[9]。因此,应用CsA或 FK506时,可定期检测患者血药浓度,根据浓度调整剂量,可明显降低NS并发症。此外,HSCT后用碳青霉烯类等抗生素可诱发癫痫,可能与β-内酰胺环结合γ-氨基丁酸受体相关[10];阿昔洛韦和更昔洛韦会导致震颤、激动或嗜睡,有时导致全身性癫痫发作[11]。因此,在临床中使用这些药物的同时应当评估及预防NS并发症的发生。
感染是NS并发症发生的独立危险因素之一,最常见的病原体有真菌(特别是曲霉菌)、细菌、病毒(如单纯疱疹病毒、JC病毒、巨细胞病毒、人疱疹病毒6 型)、寄生虫[12]。本研究中颅内感染的发生率为13.8%,病原体类型分别为细菌、病毒、真菌,感染可能与预处理后黏膜屏障及血脑屏障的保护作用降低,免疫功能低下,致病菌易透通过血脑屏障有关。
本研究中脑出血7例,其中EB病毒DNA阳性3例。Aisa等[13]报道,HSCT后脑出血归因于EB病毒相关的移植后淋巴组织增生,且尸检发现非典型淋巴细胞浸润大脑和脑膜,同时EB病毒RNA及B细胞相关的抗原均为阳性。本研究中脱髓鞘性脑炎9例,经移植免疫排斥及神经功能症状综合评价,用不同剂量激素和(或)免疫球蛋白治疗后,7例症状明显缓解,与Delios等[14]的报告相似。Delios等[14]回顾性分析了7例免疫介导的脱髓鞘疾病,包括3例急性脱髓鞘性脑脊髓炎、3例急性炎症性脱髓鞘性多发性神经病和1例自主神经病变,给予免疫球蛋白、高剂量激素和(或)利妥昔单抗治疗后,其中5例患者症状明显改善。因此认为,该NS并发症可能与免疫相关。也有研究[15]显示,高血压、高液体负荷、低血脂、低镁血症等都可通过影响相关钙调蛋白抑制剂(calcineurin inhibitors,CNIs)的神经毒性产生NS并发症。
NS并发症可发生于HSCT后各个时段,CNS病变常见于HSCT后急性期及急性GVHD期间,而HSCT后PNS并发症发生率低于CNS,PNS常出现在慢性GVHD期间[16]。本研究结果显示,CNS并发症占71.3%,发病中位时间约为HSCT后2个月;PNS病变占28.7%,发病中位时间约为HSCT后3个月。本研究CNS和PNS并发症发生率与研究[17-18]基本一致。本研究还显示,CNS并发症患者的死亡率高于PNS并发症,伴PNS病变患者多因其他原因死亡,提示CNS并发症更应受到重视。
综上所述,HSCT 后NS并发症相关的危险因素包括移植类型、GVHD、药物毒性、感染等。临床医师应在临床工作中对上述相关因素进行评估,注意观察患者的前驱症状,尤其是对于发生CNS并发症的患者,可以通过实验室检查、影像学检查、电生理等辅助检查进行诊断,并明确引起NS并发症的原因,以利于干预和防治,从而降低患者死亡率,改善预后。
[1] UCKAN D, CETIN M, YIGITKANLI I, et al.Life-threatening neurological complications after bone marrow transplantation in children[J].Bone Marrow Transplant, 2005,35(1):71-76.
[2] WEBER C, SCHAPER J, TIBUSSEK D, et al.Diagnostic and therapeutic implications of neurological complications following paediatric haematopoietic stem cell transplantation[J].Bone Marrow Transplant, 2008,41(3):253-259.
[3] NORDAL R A, WONG C S.Molecular targets in radiation-induced blood-brain barrier disruption[J].Int J Radiat Oncol Biol Phys,2005,62(1):279-287.
[4] PORKKA K, KOSKENVESA P, LUNDN T, et al.Dasatinib crosses the blood-brain barrier and is an efficient therapy for central nervous system Philadelphia chromosome-positive leukemia[J].Blood,2008,112(4):1005-1012.
[5] UCKAN D, CETIN M, YIGITKANLI I, et al.Life-threatening neurological complications after bone marrow transplantation in children[J].Bone Marrow Transplant,2005, 35(1):71-76.
[6] LA MORGIA C, MONDINI S, GUARIDNO M, et al.Busulfan neurotoxicity and EEG abnormalities: a case report[J].Neurol sci,2004,25(2):95-97.
[7] CONNOLLY R M,DOHERTY C P,BEDDY P, et al.Chemotherapy induced reversible posterior leukoencephalopathy syndrome[J].Lung Cancer,2007,56(3):459-463.
[8] DE SOUZA FRANCESCHI F L, GREEN J, CAYCI Z, et al.Human herpesvirus 6 is associated with status epilepticus and hyponatremia after umbilical cord blood transplantation[J].Can J Infect Dis Med Microbiol,2014,25(3):170-172.
[9] BARTYNSKI W S, ZEIGLER Z R , SHADDUCK R K, et al.Pretransplantation conditioning influence on the occurrence of cyclosporine or FK-506 neurotoxicity in allogeneic bone marrow transplantation[J].AJNR Am J Neuroradiol, 2004, 25(2):261-269.
[10] EGLI A, INFANTI L, DUMOULIN A, et al.Prevalence of polyomavirus BK and JC infection and replication in 400 healthy blood donors[J].J Infect Dis,2009,199(6):837-846.
[11] MILLER A D, BALL A M, BOOKSTAVER P B,et al.Epileptogenic potential of carbapenem agents: mechanism of action, seizure rates, and clinical considerations[J].Pharmacotherapy, 2011, 31(4):408-423.
[12] VON EULER M, AXELSSON G, HELLDÉN A.Differential diagnosis of central nervous system involvement in a patient treated with acyclovir[J].Ther Drug Monit, 2013, 35(4):417-419.
[13] AISA Y, MORI T, NAKAZATO T, et al.Primary central nervous system post-transplant lymphoproliferative disorder presenting as cerebral hemorrhage after unrelated bone marrow transplantation[J].Transpl Infect Dis, 2009, 11(5):438-441.
[14] DELIOS A M, ROSENBLUM M, JAKUBOWSKI A A, et al.Central and peripheral nervous system immune mediated demyelinating disease after allogeneic hemopoietic stem cell transplantation for hematologic disease[J].J Neurooncol, 2012, 110(2):251-256.
[15] PUSTAVOITAU A, BHARDWAJ A, Stevens R.Neurological complications of transplantation[J].J Intensive Care Med, 2011, 26(26):209-222.
[16] SUZUKI S, MORI T, MIHARA A, et al.Immune-mediated motor polyneuropathy after hematopoietic stem cell transplantation[J].Bone Marrow Transplant, 2007, 40(3):289-291.
[17] SIEGAL D, KELLER A, XU W, et al.Central nervous system complications after allogeneic hematopoietic stem cell transplantation: incidence, manifestations, and clinical significance[J].Biol Blood Marrow Transplant, 2007, 13(11):1369-1379.
[18] KISHI Y, MIYAKOSHI S,KAMI M, et al.Early central nervous system complications after reduced-intensity stem cell transplantation[J].Biol Blood Marrow Transplant, 2004,10(8):561-568.
[本文编辑] 姬静芳
Clinical study of the nervous system complications after hematopoietic stem cell transplantation
YIN Zhou1, ZHANG Ping2, ZHANG Ying1, TANG Xiao-wen2*, FU Zheng-zheng2, CHEN Feng2, XUE Sheng-li2, YU Ziqiang2, SUN Ai-ning2, WU De-pei2, DONG Wan-li1, XUE Qun1*
1.Department of Neurology, The First Affiliated Hospital of Soochow University, Suzhou 215006, Jiangsu, China 2.Department of Hematology, The First Affiliated Hospital of Soochow University, Suzhou 215006, Jiangsu, China
Objective:Analyze the characteristics of nervous system (NS)complications after hematopoietic stem cell transplantation(HSCT) ,and evaluate risk factors in order to reduce its occurrence, provide better diagnosis and treatment and improve the prognosis of the patients.Methods:The clinical outcomes of the patients who developed NS complications after HSCT were collected in our hospital from August 2012 to August 2015, and retrospective analysis was used.Results:A total of 87 patients with NS complications after HSCT include central nervous system complications was 71.3% (62/87) and peripheral nerve complications was 28.7% (25/87).The types of primary disease included acute lymphoblastic leukemia (ALL) 34.5% (30/87), acute myelogenous leukemia (AML) 23.0% (20/87), chronic myelogenous leukemia (CML ) 12.6% (11/87), other types of leukemia by 9.2% (8/87), aplastic anemia 13.8% (12/87), myelodysplastic syndrome 6.9% (6/87); HLA matched 19 cases (21.8%), HLA mismatched 53 cases (60.9%), unrelated donors 15 cases (17.2%), central nervous system complication rate was 16.1%, 69.4% and 14.5%, respectively; peripheral nerve complication rate was 36.0%, 40.0% and 24.0% respectively (χ2=6.682,P=0.034).The incidences of NS complications were 26.4% (23/87) in children and 73.6% (64/87)in adults respectively,and there was no significant difference in the types of NS complications (P=0.435).The cases accompanied with GVHD or infection respectively account for 69.0% (60/87) and 59.8% (52/87), and there were significant difference in the incidences of types of NS complications (P<0.05).The onset time of 87 patients with nervous system complications or peripheral nerve complications was 1-726 days (median 49 days) and 20-694 days (median 80 days), respectively.The overall mortality rate was 33.3% (29/87), with central nervous system complications was 93.1% (27/29), with peripheral nerve complications was 6.9% (2/29,P<0.05).Conclusions:The patients with central nervous system complications have higher incidence, higher mortality,and shorter onset time than the patients with peripheral nerve complications, and related with HLA types, GVHD and infection risk factors.
hematopoietic stem cell transplantation;nervous system complications;risk factors
2016-05-23[接受日期]2016-07-25
江苏省“六大人才高峰”高层次人才选拔培养人选资助项目(WSN-064),江苏省自然科学基金面上项目(BK2011267).Supported by Six Talent Peak Project of Jiangsu Province (WSN-064) and Natural Science Foundation of Jiangsu Province (BK2011267).
尹 周,硕士生.E-mail: yin.gzhou@163.com
*通信作者(Corresponding authors).Tel: 021-67781820, E-mail: xwtang1020@163.com; Tel: 021-67780307, E-mail: qxue_sz@163.com
10.12025/j.issn.1008-6358.2016.20160604
R 73-35+2
A

