原发性肝细胞肝癌射频消融术前血清HBeAg水平与术后复发的相关性
周颖婷, 谢晓莺, 干育红, 葛宁灵, 陈 漪, 任正刚, 张 岚
复旦大学附属中山医院肝肿瘤内科,上海 200032
论 著
原发性肝细胞肝癌射频消融术前血清HBeAg水平与术后复发的相关性
周颖婷, 谢晓莺, 干育红, 葛宁灵, 陈 漪, 任正刚, 张 岚*
复旦大学附属中山医院肝肿瘤内科,上海 200032
目的:探讨具有乙肝背景的肝细胞肝癌(hepatocellular carcinoma,HCC)患者射频消融术(radiofrequency ablation,RFA)术前血清乙型肝炎e抗原(HBeAg)水平与术后肿瘤复发的相关性。方法:回顾性分析 2006年6月至2012年6月复旦大学附属中山医院收治的具有乙肝背景的小HCC行RFA治疗的391例患者的临床资料。根据术前HBeAg水平,将患者分为HBeAg阳性组(n=112)和HBeAg阴性组(n=279)。术后定期规律随访,分析RFA术前HBeAg水平和RFA术后肿瘤复发的相关性。结果:HBeAg阳性组术后中位无复发生存期(recurrence-free survival time,RFS)为(23.00±1.99)个月,HBeAg阴性组术后中位RFS为(31.00±3.49)个月,差异有统计学意义(P=0.002)。多因素Cox风险回归分析显示,术前甲胎蛋白(alpha fetal protein,AFP)水平(HR 1.393,95% CI 1.052~1.845,P=0.021)、血清HBV-DNA水平分级(HR 1.402,95% CI 1.013~1.939,P= 0.041)和HBeAg水平(HR 1.389,95% CI 1.017~1.896,P= 0.039)是影响乙肝背景小HCC RFA术后无瘤生存时间的独立危险因素。结论:原发性HCC RFA术前血清HBeAg水平与术后肿瘤复发密切相关,是原发性HCC RFA术后复发的独立危险因素。
原发性肝细胞肝癌;射频消融术;HBeAg
原发性肝细胞肝癌(primary hepatocellular carcinoma,HCC)是临床上最常见的恶性肿瘤之一,全球发病率呈逐年增长趋势,居于恶性肿瘤的第5位,死亡人数位居肿瘤相关死亡的第3位[1-2]。我国HCC发病率达 50/10万人,每年发病人数约占全球的55%[3],在肿瘤相关死亡中位居第2位。在我国,乙肝病毒感染是HCC发生的主要病因之一。乙型肝炎e抗原(HBeAg)是乙肝病毒核心颗粒中的一种可溶性蛋白质。乙肝活动期检出率升高,表明肝细胞有较严重的损伤,患者有很强的传染性。病毒复制现已被认为是引起慢性肝病病情进展的关键因素[4-5]。而且,对于慢性乙肝患者,即使没有发生肝硬化,发生HCC的风险仍然存在[6]。HBeAg不仅与肿瘤的发生有关,而且与手术切除后肿瘤的复发有关。流行病学研究[7]表明,HBeAg阳性的乙肝患者发生HCC的危险性增加。有研究[8-9]显示,HBeAg阳性的HCC患者行根治性切除术后其肿瘤复发率高于HBeAg阴性患者。Yang等[10]的一项前瞻性研究显示,乙型肝炎表面抗原(HBsAg)阳性、HBeAg阴性的患者HCC的发病风险是HBsAg和HBeAg均阴性患者的9.2倍,而HBsAg、HBeAg均阳性患者HCC的发病风险是HBsAg和HBeAg均阴性患者的60.2倍,提示HBeAg能够增加HCC的发病率。此外,Chen等[11]进行了一项前瞻性队列研究,入组3 653例患者,均为HBeAg阳性,平均随访时间11.4年,结果发现血清HBeAg水平能显著增加HCC的发病风险。
HCC主要有手术治疗和非手术治疗。手术治疗包括局部肝肿瘤切除术及肝移植手术[12]。非手术治疗包括介入治疗、射频消融术(radiofrequency ablation,RFA)、放射治疗、化学治疗、分子靶向治疗、综合治疗等。经皮RFA是近年来治疗肝恶性肿瘤特别是小肝癌(单个肿瘤直径≤3 cm,或2个肿瘤直径之和≤3 cm)及早期HCC的根治性手段之一[13-14],具有疗效确切、操作简便、安全性好等优势。但是目前关于HCC RFA术前HBeAg与术后肿瘤复发的相关性研究较少。因此,本研究通过回顾性分析具有乙肝背景接受RFA术HCC患者的临床资料,探讨RFA术前HBeAg水平与患者预后的相关性。
1 资料与方法
1.1 一般资料 选取2006年6月至2012年6月在复旦大学附属中山医院行RFA治疗的具有乙肝背景的HCC患者391例为研究对象。所有患者的诊断符合美国肝病研究协会年会(AASLD)诊断标准或组织学证实为HCC。其中,男性312例、女性79例;年龄22~85岁,平均(55.47±11.12)岁。消融肿瘤数目单发者339例,2枚者45例,3枚者7例。肿瘤最大径均≤3 cm,平均直径(1.98±0.59) cm。患者肝功能状况Child-Pugh评分A级377例,B级14例。患者一般资料见表1。
所有患者在术前均行胸部X线正侧位片,腹部彩超及增强CT或MRI检查。血液标本的实验室检查包括HBsAg、HBeAg、HBeAb、乙型肝炎核心抗体(HBcAb)、HBV-DNA、丙型肝炎病毒(HCV)抗体、甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原19-9(CA19-9)及血常规、肝肾功能、凝血功能等血生化检查。所有患者术后1 d复查肝肾功能、血常规、凝血功能等。如果无严重并发症,一般在RFA术后第3天出院。
1.2 RFA治疗 按照复旦大学附属中山医院肝肿瘤内科RFA治疗常规,分别采用RITA(RITA,美国)、Cool-tip(Valley Lab,美国)射频系统进行肝癌射频消融。仪器的选择根据肿瘤的大小和位置决定。所用患者均采用B超引导下经皮RFA。治疗范围须完全覆盖并超出癌灶周边0.5~1 cm。允许术中监护患者生命体征。术前静脉注射止血药,术后常规应用止血药物1~3 d。术中使用预防性抗生素1次。
1.3 随 访 术后1个月复查增强磁共振、肝肾功能、血常规、AFP等肿瘤标志物及HBV-DNA等肝炎指标,判断肿瘤病灶消融情况。对于病灶达到完全消融毁损的患者,此后每2个月复查1次腹部彩超及肿瘤标志物和血生化检查,每6个月复查1次增强磁共振检查。随访中如果发现病灶进展或者复发,根据病情行手术切除、RFA或者肝动脉栓塞化疗(transcatheter arterial chemoembolization,TACE)等治疗。在原射频坏死区域2 cm内出现新发肿瘤定义为肿瘤局部进展,其他部位或肝叶出现新的肿瘤病灶则为远处复发,肝脏以外其他器官出现肿瘤转移为肝外转移。
2 结 果
2.1 HBeAg阴性组和阳性组基本资料比较 391例患者中,HBeAg阳性患者112例,其中男性83例、女性29例,年龄22~79岁,平均(52.54±11.30)岁,94例患者为单个肿瘤、2枚者15例、3枚者3例;HBeAg阴性患者279例,其中男性229例、女性50例,年龄27~85岁,平均(56.65±10.85)岁,245例患者为单个肿瘤、2枚者30例、3枚者4例。所有患者肿瘤直径均≤3 cm。两组患者术前肝功能状况和肿瘤情况无显著差异,但HBeAg阳性组患者RFA术前HBV-DNA水平明显高于阴性组(P<0.001,表1)。
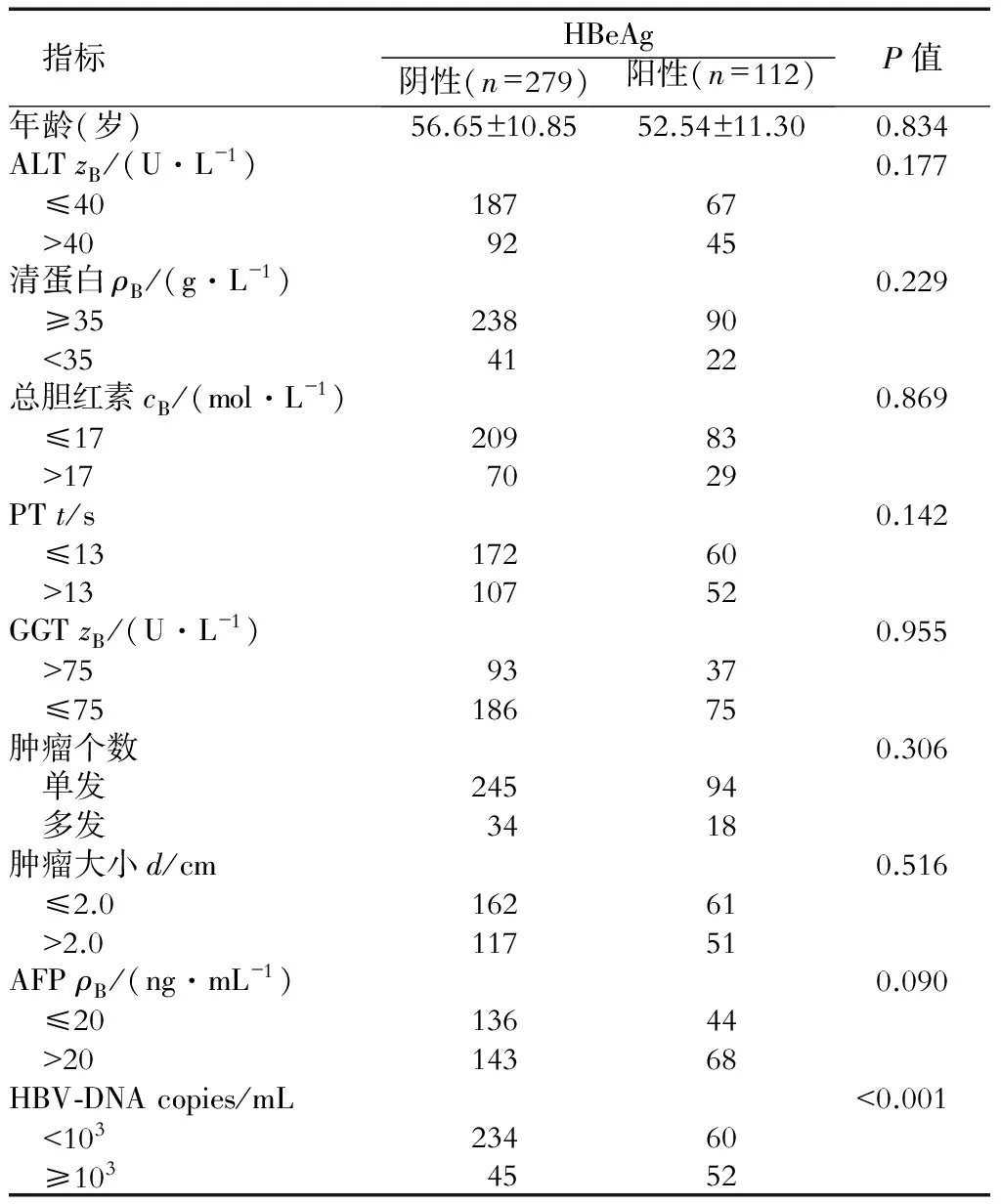
表1 患者术前基本情况
ALT: 谷氨酸氨基转移酶;PT:凝血酶原时间;GGT:谷氨酰转肽酶
2.2 生存随访 391例患者经RFA共治疗450个肿瘤病灶。所有患者均有完整的随访资料,中位随访时间为(43.2±20.8)个月。HBV-DNA检出患者若既往未抗病毒治疗,均给予抗病毒药物。随访期间共有212例患者肿瘤复发。其中,原位复发23例;肝内其他部位复发180例;另有9例发生肝外转移,包括2例腹腔淋巴结转移、5例肺转移和2例骨转移。中位无瘤生存期(DFS)为(28.00±2.03)个月。患者1、3、5年的无瘤生存率分别为 78%、40%和23%。
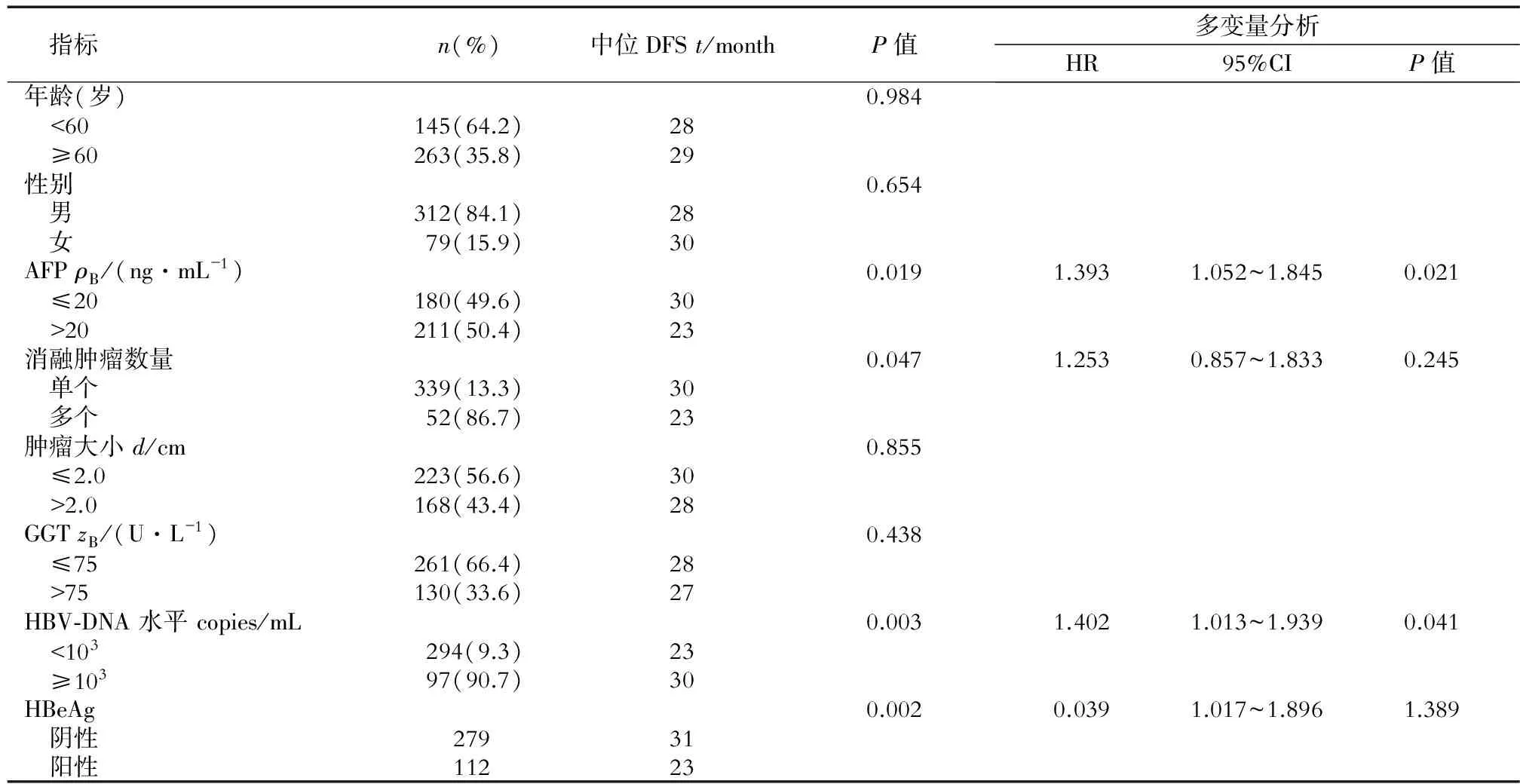
对可能影响具有乙肝背景HCC RFA后肿瘤复发的因素进行单因素Cox风险回归模型分析,结果显示:术前AFP水平(P=0.019)、肿瘤个数(P=0.047)、血清HBV-DNA水平分级(P=0.003)、HBeAg水平(P=0.002)是影响具有乙肝背景小HCC RFA术后DFS的主要因素。多因素分析显示:术前AFP水平(HR 1.393,95% CI 1.052~1.845,P=0.021)、HBV-DNA水平分级(HR 1.402,95% CI 1.013~1.939,P=0.041)、HBeAg水平(HR 1.389,95% CI 1.017~1.896,P=0.039)是影响乙肝背景小HCC RFA后DFS的独立危险因素(表2)。
2.3 HBeAg与具有乙肝背景HCC患者RFA术后肿瘤复发的关系 HBeAg阳性患者中,随访期间共有68例出现肿瘤复发,中位无复发生存期(RFS)为(23.00±1.99)个月。HBeAg阴性患者共有144例出现肿瘤复发,60例死亡,中位RFS为(31.00±3.49)个月。HBeAg阴性患者RFA术后RFS明显优于HBeAg阳性患者(P=0.002,图1)。
表2 小HCC患者RFA术后DFS危险因素N=391
指标n(%)中位DFSt/monthP值多变量分析HR95%CIP值年龄(岁)0.984 <60145(64.2)28 ≥60263(35.8)29性别0.654 男312(84.1)28 女79(15.9)30AFPρB/(ng·mL-1)0.0191.3931.052~1.8450.021 ≤20180(49.6)30 >20211(50.4)23消融肿瘤数量0.0471.2530.857~1.8330.245 单个339(13.3)30 多个52(86.7)23肿瘤大小d/cm0.855 ≤2.0223(56.6)30 >2.0168(43.4)28GGTzB/(U·L-1)0.438 ≤75261(66.4)28 >75130(33.6)27HBV⁃DNA水平copies/mL0.0031.4021.013~1.9390.041 <103294(9.3)23 ≥10397(90.7)30HBeAg0.0020.0391.017~1.8961.389 阴性27931 阳性11223
ALT: 谷氨酸氨基转移酶;PT:凝血酶原时间;GGT:谷氨酰转肽酶; DFS: 无瘤生存时间
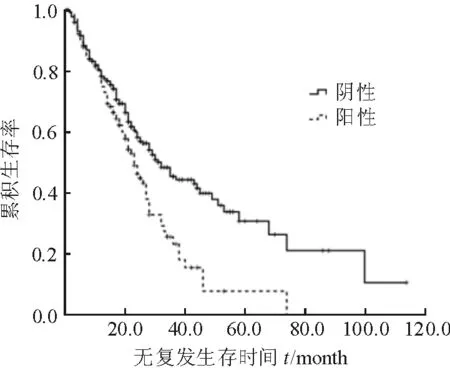
图1 术前血清HBeAg水平与乙肝背景HCC患者RFA术后肿瘤复发的关系
3 讨 论
近年来,影响HCC患者RFA术后预后的风险因素得到了广泛研究。研究[15]表明,影响HCC RFA预后的因素包括女性、多个肿瘤、肿瘤分级、微血管侵犯、肿瘤直径大于3 cm及血清蛋白小于35 g/L等。但目前对HBV相关因素对RFA预后影响的研究较少。
HBeAg在乙肝病毒活跃时可检出,表明肝细胞有较严重的损伤[16]。作为衡量病毒活动的主要指标,血HBeAg的水平可反映肝内HBV的复制情况,同时被认为是引起肝脏损害及病情进展的关键因素。研究[17]发现,在慢性HBV感染患者中,血清中HBeAg的水平与肝脏损害、肝纤维化的进展及肝衰竭的发生相关,而HBeAg水平较高的患者HCC的发生风险也较高,说明HBeAg可能直接或间接参与了HBV相关HCC的发生。一方面,持续复制导致HBV的DNA片段直接插入肝细胞基因组中的可能性增加,引起基因突变,导致肝细胞向肿瘤细胞转化;另一方面,高病毒载量可引起慢性肝炎和肝纤维化的进展,并介导转化生长因子β1(TGF-β1)的产生,从而发挥致癌作用[18-20]。
Sun等[21]的研究中,203例肿瘤直径<3 cm的HCC患者的中位随访时间为32.9个月,HBeAg阴性组5年生存率和5年无病生存率均较HBeAg阳性组高;多因素分析显示:HBeAg阳性是影响术后生存率和无病生存率的独立危险因素,且和早期复发相关,认为血清HBeAg阳性是影响HCC术后总体生存期和无瘤生存期的独立危险因素。Kubo等[8]研究发现,HBeAg阳性病例伴肝内播散者比例高。病毒的活跃状态对RFA疗效会产生重要的影响,而HBeAg阳性是影响术后复发和远期生存的独立危险因素。Choi等[22]研究了190例接受肝切除的乙肝HCC患者,中位随访时间为38个月,发现HBeAg阳性是影响患者晚期复发的因素。
本研究回顾性分析了2006年6月至2012年6月在复旦大学附属中山医院行RFA治疗后HCC患者的预后情况,提示HBeAg水平与HCC患者RFA治疗后复发情况相关(P=0.002)。多因素分析显示:术前AFP水平、血清HBV-DNA水平和HBeAg水平是影响乙肝背景小HCC患者RFA术后RFS的独立危险因素。术前HBeAg阳性对HCC复发的可能影响有两种:一是活动性肝炎时,肿瘤局部的炎症因子多,这可能增加肿瘤的侵袭性;二是活动性肝炎可能伴有活跃的肝细胞损伤及修复,使HCC复发的机会增加。
因此,HCC合并乙肝患者,应予以积极的抗病毒治疗,同时应密切监测HBV相关患者病毒载量的变化,使患者乙肝病毒复制维持在较低水平,以改善其远期预后。抑制病毒复制的过程中,可能同时抑制了某些肿瘤进展相关因子,抑制或延缓了肿瘤的发生发展,从而改善远期生存预后,但相关分子机制方面的研究较少,后续研究应予以关注。
[1] 张清华, 刘景丰.原发性肝癌治疗进展[J].医学综述, 2008, 14(10): 1479-1481.
[2] BRUIX J, COLOMBO M.Hepatocellular carcinoma: Current state of the art in diagnosis and treatment[J].Best Pract Res Clin Gastroenterol, 2014, 28(5): 751.
[3] European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer.EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma[J].J Hepatol, 2012, 56(4): 908-943.
[4] YANG D, HANNA D L, USHER J, et al.Impact of sex on the survival of patients with hepatocellular carcinoma: a surveillance, epidemiology, and end results analysis[J].Cancer, 2014, 120(23): 3707-3716.
[6] GONZALEZ S A, KEEFFE E B.Risk assessment for hepatocellular carcinoma in chronic hepatitis B: scores and surveillance[J].Int J Clin Pract, 2012, 66(1): 7-10.
[7] ZHAO Y M, WANG L, DAI Z, et al.Validity of plasma macrophage migration inhibitory factor for diagnosis and prognosis of hepatocellular carcinoma[J].Int J Cancer, 2011, 129(10): 2463-2472.
[8] KUBO S, HIROHASHI K, YAMAZAKI O, et al.Effect of the presence of hepatitis B e antigen on prognosis after liver resection for hepatocellular carcinoma in patients with chronic hepatitis B[J].World J Surg, 2002, 26(5): 555-560.
[9] SUN H C, TANG Z Y, MA Z C, et al.The prognostic factor for outcome following second resection for intrahepatic recurrence of hepatocellular carcinoma with a hepatitis B virus infection background[J].J Cancer Res Clin Oncol, 2005, 131(5): 284-288.
[10] YANG H I, LU S N, LIAW Y F, et al.Hepatitis B e antigen and the risk of hepatocellular carcinoma[J].N Engl J Med, 2002, 347(3): 168-174.
[11] CHEN M S, LIANG H H, XUE P, et al.Risk factors of survival for recurrent hepatocellular carcinoma treated by percutaneous radiofrequency ablation[J].Zhonghua Wai Ke Za Zhi, 2010, 48(10): 738-742.
[12] IMAMURA H, MATSUYAMA Y, TANAKA E, et al.Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy[J].J Hepatol, 2003, 38(2): 200-207.
[13] AMARAPURKAR D N, DHAROD M V, CHHABRA D.Attack of the clone: HCC tract seeding following RFA[J].J Clin Exp Hepatol, 2015, 5(3): 262-263.
[14] ZHU X D, ZHANG J B, ZHUANG P Y, et al.High expression of macrophage colony-stimulating factor in peritumoral liver tissue is associated with poor survival after curative resection of hepatocellular carcinoma[J].J Clin Oncol, 2008, 26(16): 2707-2716.
[15] ZHOU Y, SUI C, LI B, et al.Repeat hepatectomy for recurrent hepatocellular carcinoma: A local experience and a systematic review[J].World J Surg Oncol, 2010, 8: 55.
[16] HADZIYANNIS S J, SEVASTIANOS V, RAPTI I, et al.Sustained responses and loss of HBsAg in HBeAg-negative patients with chronic hepatitis B who stop long-term treatment with adefovir[J].Gastroenterology, 2012, 143(3): 629-636,e1.
[17] ILOEJE U H, YANG H I, CHEN C J.Natural history of chronic hepatitis B: What exactly has REVEAL revealed[J].Liver Int, 2012, 32(9): 1333-1341.
[18] KIM B K, REVILL P A, Ahn S H.HBV genotypes: Relevance to natural history, pathogenesis and treatment of chronic hepatitis B[J].Antivir Ther,2011,16(8): 1169-1186.
[19] FARES N, PÉRON J M.Epidemiology, natural history, and risk factors of hepatocellular carcinoma[J].Rev Prat, 2013, 63(2): 216-217, 220-222.
[20] NAULT J C.Pathogenesis of hepatocellular carcinoma according to aetiology[J].Best Pract Res Clin Gastroenterol, 2014, 28(5): 937-947.
[21] SUN H C, ZHANG W, QIN L X, et al.Positive serum hepatitis B e antigen is associated with higher risk of early recurrence and poorer survival in patients after curative resection of hepatitis B-related hepatocellular carcinoma[J].J Hepatol, 2007, 47(5): 684-690.
[22] CHOI G H, KIM D H, CHOI S B, et al.The preoperative positivity for serum hepatitis B e antigen did not affect overall survival after curative resection of hepatitis B virus-related hepatocellular carcinoma[J].J Gastroenterol Hepatol, 2009, 24(3): 391-398.
[本文编辑] 叶 婷, 晓 璐
Correlationship between preoperative serum HBeAg level and tumor recurrence after radiofrequency ablation in patients with hepatocellular carcinoma
ZHOU Ying-ting, XIE Xiao-ying, GAN Yu-hong, GE Ning-ling, CHEN Yi, REN Zheng-gang, ZHANG Lan*
Department of Liver Neoplasms, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective:To investigate the correlation between preoperative serum HBeAg level and tumor recurrence after radiofrequency ablation (RFA) in patients with hepatocellular carcinoma (HCC).Methods:Clinical data of 391 cases with hepatitis B background of HCC underwent RFA from June 2006 to June 2012 in Zhongshan Hospital, Fudan University were analyzed retrospectively.According to preoperative levels of HBeAg, patients were divided into HBeAg positive group (n=112) and HBeAg negative group (n=279), with regular followed-up after operation.The correlationship between HBeAg before RFA and tumor recurrence after RFA was analyzed.Results:The median recurrence-free survival time (RFS) was (23.00±1.99) months in HBeAg positive group, and the median RFS was (31.00±3.49) months in HBeAg negative group (P=0.002).Cox proportional hazard regression analysis showed that preoperative AFP level (HR 139.3, 95%CI 1.052-1.845,P=0.021), serum HBV-DNA level (HR 1.402, 95%CI 1.013-1.939,P=0.041), and HBeAg levels (HR 1.389, 95%CI 1.017-1.896,P=0.039) were the independent risk factors for survival in hepatitis B background HCC patients after RFA.Conclusions:Preoperative serum HBeAg level in patients with primary HCC is closely related to postoperative tumor recurrence.It is an independent risk factor for recurrence of HCC after RFA.
primary hepatocellular carcinoma; radiofrequency ablation; HBeAg
2016-08-22[接受日期]2016-11-16
周颖婷,博士,住院医师.E-mail: mercury06062003@163.com
*通信作者(Corresponding author).Tel: 021-64041990, E-mail: zhang.lan@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2016.20160832
R 735.7
A

