水杨酸对低温胁迫下棉花种子萌发及幼苗生理特性的影响
蔡 肖,江振兴,甄军波,刘琳琳,张香云,迟吉娜*
(1.河北省农林科学院 棉花研究所/农业部黄淮海半干旱区棉花生物学与遗传育种重点实验室,河北 石家庄 050051; 2.河北行政学院,河北 石家庄 050031)
水杨酸对低温胁迫下棉花种子萌发及幼苗生理特性的影响
蔡 肖1,江振兴2,甄军波1,刘琳琳1,张香云1,迟吉娜1*
(1.河北省农林科学院 棉花研究所/农业部黄淮海半干旱区棉花生物学与遗传育种重点实验室,河北 石家庄 050051; 2.河北行政学院,河北 石家庄 050031)
为探讨水杨酸对低温下棉花耐寒性的影响,采用水杨酸浸种和叶面喷施的方法,研究了低温胁迫下外源施加水杨酸对中棉所36种子萌发和幼苗生理特性的影响。结果表明,低温胁迫下,0.25 mmol/L和0.5 mmol/L水杨酸浸种处理可以提高中棉所36种子的发芽率、发芽势和发芽指数,浸种浓度大于0.5 mmol/L时反而不利于低温种子萌发。叶面喷施水杨酸后,棉花幼苗叶片相对电导率和丙二醛(MDA)含量随水杨酸浓度升高呈先降低后升高的趋势,而超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和可溶性蛋白含量则表现出先升高后降低的趋势。水杨酸喷施浓度为0.5 mmol/L时,叶片相对电导率和MDA含量最低,同时SOD活性、POD活性和可溶性蛋白含量最高。可见,采用0.5 mmol/L水杨酸处理棉花种子和幼苗,最有利于促进种子低温萌发,减轻低温下叶片细胞膜损伤,抑制叶片MDA含量的增加,提高SOD、POD活性,增加渗透调节物质可溶性蛋白的含量。
棉花; 水杨酸; 低温胁迫; 抗寒性; 生理特性
水杨酸(salicylic acid,SA)是一种普遍存在于高等植物体内的小分子酚类物质,参与调节植物的生长发育和抵御逆境胁迫的反应[1-2]。研究者们发现,适宜浓度的SA可通过提高植物细胞保护酶活性、减少膜脂过氧化物积累等方式提高多种植物对病害[3]、盐害[4-5]、干旱[6]、高温[7-8]、低温[9-10]等逆境的抗性。
棉花是我国关系国计民生的重要经济作物。低温常常导致棉花苗期生长发育受挫,严重影响棉花的产量和品质。提高棉苗抗寒性、避免苗期冷害对于稳定棉花生产具有重要意义。有关SA对棉花的影响已有一些报道。研究发现,喷施SA有助于盐胁迫下棉花抗盐能力的提高[11-12]。袁超等[13]报道,SA能缓解低温和盐胁迫对棉花种子萌发的抑制作用。SA还能诱导棉花黄萎病抗性的产生[14]。SA浸种对棉花的抗旱性也有一定的影响[15]。然而,有关外源SA对低温下棉花种子萌发和幼苗抗寒性的影响尚不清楚。鉴于此,本试验以中棉所36为材料,选用一定浓度的外源SA对棉花种子和幼苗分别进行浸种及叶面喷施处理,通过测定相关指标,以探讨外源施加SA对低温胁迫下棉花种子萌发及幼苗生理特性的影响,筛选出提高棉苗耐低温的适宜SA浓度,为利用外源SA提高棉花的耐低温能力、服务棉花生产提供依据。
1 材料和方法
1.1 材料
供试材料为中棉所36,种子由中国农业科学院棉花研究所提供。
1.2 方法
1.2.1 SA对低温胁迫下棉花种子萌发的影响试验 棉花种子经粒选,用10% NaClO消毒20 min,无菌蒸馏水漂洗3次,分别用0、0.25、0.5、1.0、1.5 mmol/L的SA溶液(分别标记为T0、T1、T2、T3、T4)浸种24 h,然后在12 ℃下进行发芽试验。在直径9 cm的培养皿中铺2层滤纸,将无菌蒸馏水加入培养皿内至滤纸饱和,整齐排入40粒种子后加盖,在12 ℃的恒温培养箱内暗萌发。每个处理重复3次,及时补充蒸发的水分保持滤纸湿度,每日观察并记录发芽种子数(以胚根伸出达到种皮1/2长度作为发芽标准),4 d时测发芽势,7 d时测定发芽率和发芽指数。
1.2.2 SA对低温胁迫下棉花幼苗生理的影响试验 棉花种子经粒选后,播种于塑料营养钵,基质为蛭石∶珍珠岩=3∶1,浇灌Hogland营养液,置于人工气候室培养,温度28 ℃/18 ℃,相对湿度75%。试验共设0、0.25、0.5、1.0、1.5 mmol/L 5个SA处理浓度(分别标记为T0、T1、T2、T3、T4)。每处理播种12盆,每盆播10粒,子叶平展时选择长势一致的植株每盆定苗5株,待2叶1心时进行SA喷洒处理和低温胁迫处理。2叶1心时首次叶面喷施SA,2 d后第2次喷施SA,喷施时以叶片上液滴欲滴为度。强化喷施后2 d进行低温胁迫处理,温度为10 ℃,低温处理0、12、24、48 h后测定叶片的相对电导率、丙二酮(MDA)含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和可溶性蛋白含量。每个处理5株,重复3次。
相对电导率采用雷磁DDS-11A数显电导率仪(上海雷磁·创益仪器仪表有限公司)测定,MDA含量采用硫代巴比妥酸法测定,SOD活性采用氮蓝四唑(NBT)显色法测定,POD活性采用愈创木酚法测定,可溶性蛋白含量采用考马斯亮蓝G-250法测定[16]。
1.3 数据分析
数据采用Excel进行分析处理,采用单因素方差分析和最小显著差异法(LSD)比较不同处理间的差异,显著性水平为α=0.05。
2 结果与分析
2.1 外源SA对低温胁迫下棉花种子萌发的影响
发芽势、发芽率和发芽指数是反映种子生命力的重要指标。由表1可以看出,在低温条件下,经不同浓度SA浸种后,棉花种子发芽势、发芽率和发芽指数均随SA浓度的不断增高呈现先升高后降低的趋势,较低浓度的SA浸种对于低温下棉花种子萌发有一定的促进作用,较高浓度则表现出抑制作用。本研究结果表明,T2处理,即0.5 mmol/L SA浸种,最有利于棉花种子低温下萌发。
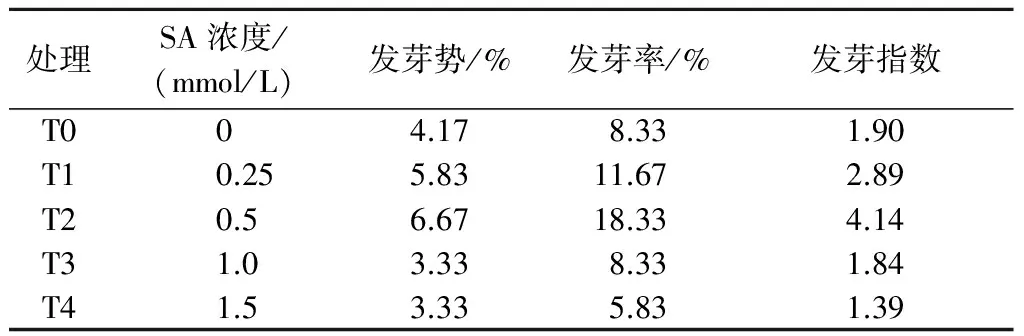
表1 SA处理对棉花种子低温下萌发的影响
2.2 外源SA对低温胁迫下棉花幼苗叶片相对电导率和MDA含量的影响
相对电导率是衡量细胞膜透性的重要指标,它能反映细胞膜的损伤程度。其值越大,表示电解质的渗漏量越多,细胞膜完整性受损害的程度越重。从图1A可以看出,低温胁迫不同时间下,各处理棉花幼苗叶片的相对电导率均随SA浓度的增加表现为先降低后升高。胁迫处理24 h时,不同SA浓度处理棉花幼苗叶片的相对电导率差异最明显,且0.5 mmol/L SA 处理下棉花叶片的相对电导率最小。低温胁迫0 h,0.5 mmol/L SA处理(T2)棉花幼苗叶片的相对电导率与对照(T0)差异不显著,而低温胁迫12~48 h二者差异均达显著水平,说明0.5 mmol/L SA处理对电解质的渗漏起到了有效的缓解作用。
植物在逆境下遭受伤害与活性氧积累诱发的膜质过氧化作用密切相关。MDA是膜脂过氧化最重要的产物之一,其含量高低常作为衡量膜脂过氧化程度的标志。SA可通过降低MDA含量来保护膜的稳定性,从而提高植物的抗寒性。由图1B可见,各处理棉花叶片MDA含量随低温处理时间的延长而升高。低温处理不同时间下,随着喷施SA浓度的增高,MDA含量表现为先降低再升高的趋势,SA处理组(T1、T2、T3和T4)的MDA含量均低于对照(T0),其中0.5 mmol/L SA处理(T2)的棉苗叶片MDA含量降幅最大,与对照相比均达到了显著水平。由此可见,0.5 mmol/L外源SA处理对于各低温胁迫下叶片MDA积累的抑制效果最好。
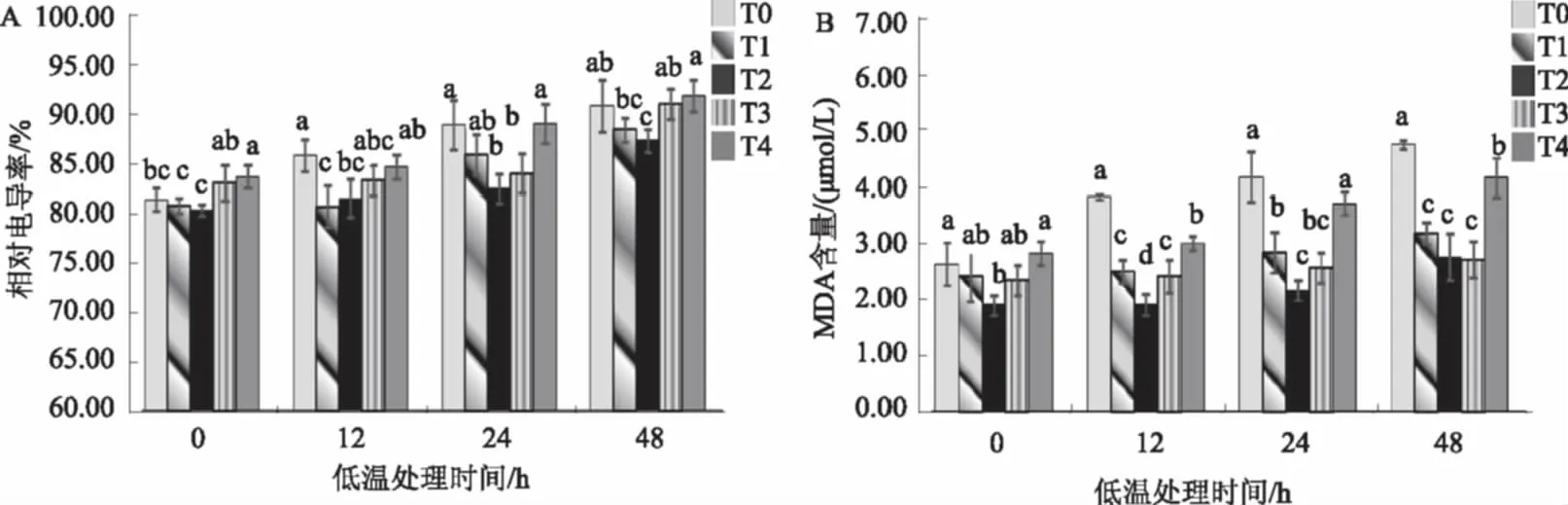
图1 SA对低温胁迫下棉花幼苗叶片相对电导率和MDA含量的影响
2.3 外源SA对低温胁迫下棉花幼苗叶片SOD和POD活性的影响
抗氧化酶活性可间接反映植物抗低温胁迫的能力。SOD是植物体内超氧阴离子自由基的专一清除剂,它歧化超氧阴离子自由基为H2O2和O2,减少膜系统的伤害。POD是清除细胞质和质膜H2O2的主要酶之一,可把H2O2分解为H2O,减轻H2O2积累的伤害。
图2A表明,随着低温胁迫时间的延长,棉花幼苗叶片SOD活性呈先升高后降低趋势,胁迫处理12 h时最高;低温胁迫不同时间,各处理棉花幼苗叶片SOD活性均随SA浓度的升高呈现先升后降的变化趋势,除低温胁迫0 h以外,0.5 mmol/L SA处理显著高于其他浓度处理,说明0.5 mmol/L SA对低温胁迫下的棉花幼苗叶片SOD活性提高效果最好。
随着低温胁迫时间的延长,棉花幼苗叶片POD活性呈先升高后降低趋势,胁迫处理24 h时最高(图2B)。低温胁迫12 h,不同浓度SA处理棉花叶片POD活性差异明显,其中,SA浓度在0~0.5 mmol/L,POD活性不断升高;SA浓度大于0.5 mmol/L,POD活性则下降,较0.5 mmol/L SA处理下降33.31%以上。
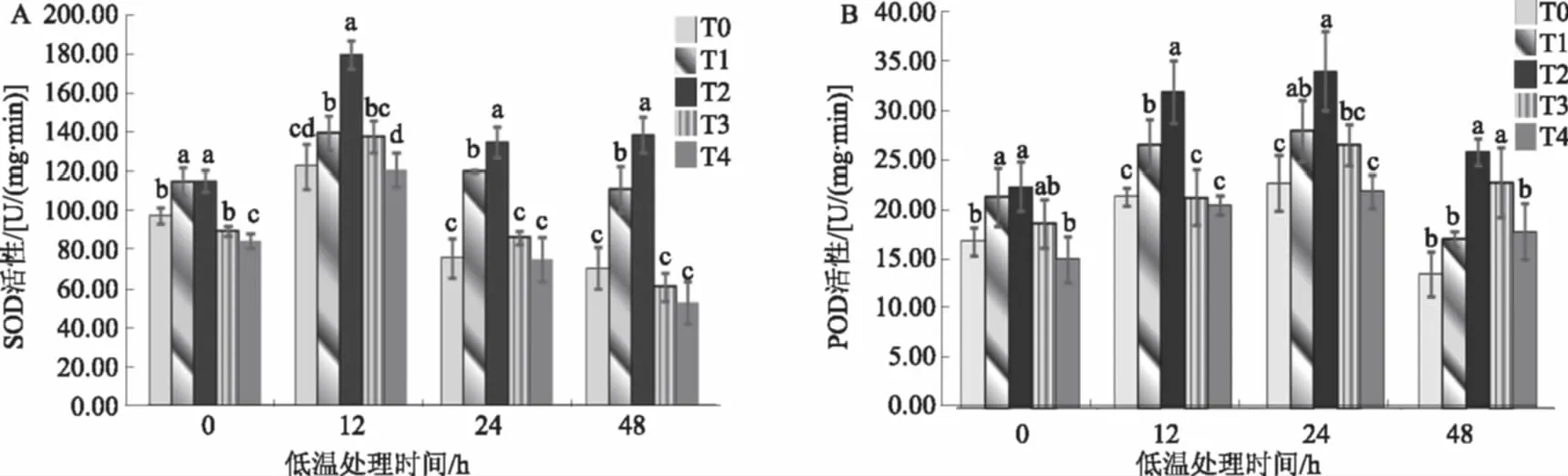
图2 SA对低温胁迫下棉花幼苗叶片SOD、POD活性的影响
2.4 外源SA对低温胁迫下棉花幼苗叶片可溶性蛋白含量的影响
可溶性蛋白是重要的渗透调节物质和营养物质,其含量增加能提高细胞的保水能力,对维持细胞的膨压、抵御逆境伤害具有一定的作用,常用作筛选抗性的指标之一。低温胁迫不同时间,经SA处理的棉花幼苗叶片可溶性蛋白含量均高于T0(图3)。随着低温胁迫时间的延长,各处理棉花幼苗叶片的可溶性蛋白含量逐渐升高,低温胁迫24 h后变化趋缓。低温胁迫不同时间,0.5 mmol/L SA处理的可溶性蛋白含量均显著高于T0处理。喷施0.5 mmol/L SA,低温处理24 h的叶片可溶性蛋白含量较未低温时高62.57%。综上所述,SA处理可以提高低温胁迫下棉花叶片可溶性蛋白含量,适宜的SA处理浓度为0.5 mmol/L。
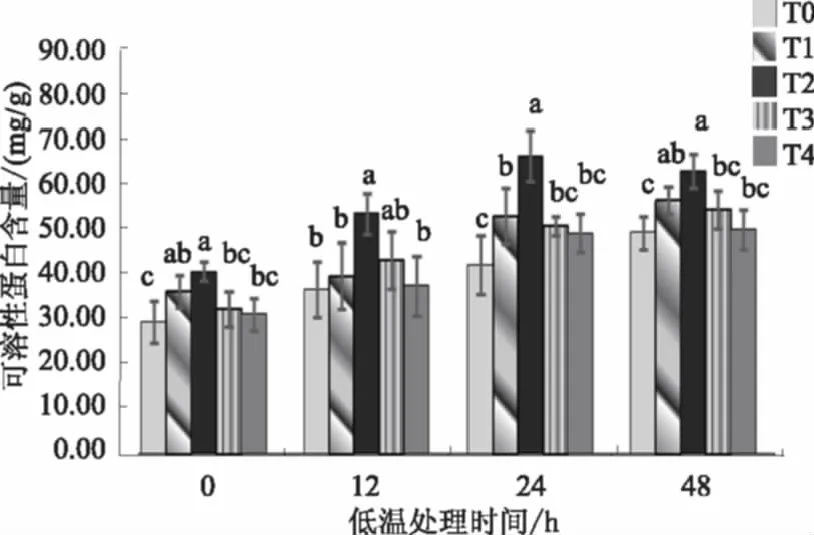
图3 SA对低温胁迫下棉花幼苗叶片可溶性蛋白含量的影响
3 结论与讨论
近年来,SA处理有利于提高植物抗寒性已经在玉米、小麦、番茄和黄瓜等[9,17-20]许多植物中得到证实。外源施加SA能够减轻植物受胁迫的毒害症状,提高其抗寒性,这可能与SA处理直接或间接地激活了氧化还原酶活性,加速了活性氧的代谢有关[21]。在本研究中,对棉苗叶片施加0.25~0.5 mmol/L SA后,SOD、POD活性均较未经SA处理的对照显著升高,说明SA处理增强了低温胁迫下棉花的抗氧化酶活性,抑制了活性氧积累对细胞造成的损伤,从而提高抗寒能力。
SA是一种酚类物质,适宜浓度的SA预处理可通过调节相应的代谢途径,在一定程度上增强细胞对低温胁迫的抵抗能力,而高浓度的SA可能对植物造成重度胁迫,进而降低其抵御低温胁迫的能力。本研究通过分析0.25~1.5 mmol/L SA处理后的棉花种子萌发和幼苗相关生理特性发现,SA处理可缓解低温胁迫对棉花种子和幼苗的伤害,并表现出低促高抑的浓度效应,且以0.5 mmol/L SA处理的效果最好。这与在小麦[22]、青稞[23]和花椰菜[24]中的研究结果一致。
SA对植物抵御逆境胁迫有一定的促进作用,但不同植物材料所需的适宜外源SA浓度却有所不同。周旋等[25]报道,1.0 mmol/L SA处理最有利于缓解盐胁迫对茶树的伤害,而小麦则以0.1 g/L处理为宜[26]。红掌耐寒性的提高以喷施300 mg/L SA最适宜[27],而藜豆则以喷施1.5 mmol/L SA为宜[28]。这可能是由于植物本身内源SA水平的差异造成的。因此,有必要针对不同植物品种选择适宜的SA处理浓度,以便更有效地提高植物的抗逆能力[29]。本研究表明,0.5 mmol/L外源SA能显著降低低温胁迫下棉花幼苗叶片的相对电导率和MDA含量以减轻膜脂过氧化,激活SOD、POD活性以清除活性氧自由基,诱导叶片可溶性蛋白含量上升以调节细胞渗透势,从而保护细胞膜结构的稳定,提高棉花抗寒性。
综上,在本试验条件下,施加0.5 mmol/L SA最有利于促进中棉所36种子低温萌发,提高其幼苗抵御低温伤害的能力。
[1] 王辉,刘国顺,云菲,等.逆境条件下外源水杨酸对植物光合特性的影响研究进展[J].河南农业科学,2014,43(3):1-4,11.
[2] Raskin I.Role of salicylicacid in plants[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43(1):439-463.
[3] Rivas-San V M,Plasencia J.Salicylic acid beyond defence:Its role in plant growth and development[J].Journal of Experimental Botany,2011,62(10):3321-3338.
[4] Idress M,Naeem M,Aftab T,etal.Salicylic acid mitigates salinity stress by improving antioxidant system and enhances vincristine and vinblastine alkaloids production in periwinkle[Catharanthusroseus(L.) G.Don][J].Acta Physiologiae Plantarum,2011,33(3):987-999.
[5] 孟长军.外源水杨酸对樱桃番茄幼苗盐伤害的缓解效应[J].河南农业科学,2011,40(8):160-163.
[6] Farooq M,Basra S M A,Wahid A,etal.Improving the drought tolerance in rice(OryzasativaL.) by exogenous application of salicylic acid[J].Journal of Agronomy and Crop Science,2009,195(4):237-246.
[7] Dat J F,Lopez-Delgado H,Foyer C H,etal.Effects of salicylic acid on oxidative stress and thermotolerance in tobacco[J].Journal of Plant Physiology,2000,156(5/6):659-665.
[8] 许桂芳,张朝阳.高温胁迫对4种珍珠菜属植物抗性生理生化指标的影响[J].中国生态农业学报,2009,17(3):565-569.
[9] 赵敏,杜彩云,王俊英,等.水杨酸对番茄幼苗抗冷性的影响[J].河南农业科学,2013,42(8):89-91.
[10] Wang D H,Li X X,Su Z K,etal.The role of salicylic acid in response of two rice cultivars to chilling stress[J].Biologia Plantarum,2009,53(3):545-552.
[11] 朱伟,袁超,马宗斌,等.水杨酸对盐胁迫下棉花种子萌发和幼苗生长的影响[J].江西农业学报,2009,21(10):17-19.
[12] 刘庆,董元杰,刘双,等.外源水杨酸SA对NaCl胁迫下棉花幼苗生理生化特性的影响[J].水土保持学报,2014,28(2):165-168,174.
[13] 袁超,郑宝周,朱伟,等.水杨酸浸种对不同温度和盐浓度下棉花种子萌发的影响[J].江西农业学报,2010,22(5):28-30.
[14] 高峰,李国英,王钦英.水杨酸诱导棉花耐黄萎病的效应[J].新疆农业科学,2004,41(5):333-336.
[15] 牟筱铃,张子学.水杨酸浸种对棉花幼苗抗旱性的影响[J].种子,2008,27(11):50-52,56.
[16] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[17] Janda T,Szalai G,Tari I,etal.Hydroponic treatment with salicylic acid decreases the effects of chilling injury in maize(ZeamaysL.) plants[J].Planta,1999,208(2):175-180.
[18] Tasgín E,Atící Ö,Nalbantoglu B.Effects of salicylic acid and cold on freezing tolerance in winter wheat leaves[J].Plant Growth Regulation,2003,41(3):231-236.
[19] Kang H M,Saltveit M E.Chilling tolerance of maize,cucumber and rice seedling leaves and roots are differentially affected by salicylic acid[J].Physiologia Plantarum,2002,115(4):571-576.
[20] 杨楠,刘培培,白小梅,等.脱落酸、水杨酸和钙对黄瓜幼苗抗冷性的诱导效应[J].西北农业学报,2012,21(8):164-170.
[21] Kang G,Wang Z,Sun G.Rarticipation of H2O2in enhancement of cold chilling by salicylic acid in banana seedlings[J].Acta Botanica Sinica,2003,45(5):567-573.
[22] 黄希莲,陈菊.水杨酸对盐胁迫下小麦种子萌发及幼苗生长的影响[J].黔南民族师范学院学报,2012,32(2):116-119.
[23] 段辉国,谢玉华,倪祥银,等.水杨酸浸种对NaCl胁迫下青稞种子活力及抗盐性的影响[J].河南农业科学,2012,41(7):27-30.
[24] 吴晓丽,罗立津,黄丽岚,等.水杨酸和油菜素内酯对花椰菜幼苗生长及抗旱性的影响[J].干旱地区农业研究,2011,29(2):168-172.
[25] 周旋,申璐,金媛,等.外源水杨酸对盐胁迫下茶树生长及主要生理特性的影响[J].西北农林科技大学学报,2015,43(7):1-7.
[26] 华智锐,李小玲.水杨酸浸种对小麦品种‘商麦5226’盐胁迫的缓解效应[J].西北农业学报,2015,24(9):29-35.
[27] 田丹青,葛亚英,刘晓静,等.叶面喷施水杨酸对红掌植株抗寒性的影响[J].浙江农业学报,2011,23(2):304-308.
[28] 张凤银,雷刚,张萍,等.水杨酸对低温胁迫下藜豆种子萌发和幼苗生理特性的影响[J].西北农林科技大学学报,2012,40(4):205-216.
[29] Rao M V,Davis K R.Ozone-induced cell death occurs via two distinct mechanisms inArabidopsis:The role of salicylic acid[J].The Plant Journal,1999,17(6):603-614.
Effects of Salicylic Acid on Seed Germination and Seedling Physiological Characteristics of Cotton under Low Temperature Stress
CAI Xiao1,JIANG Zhenxing2,ZHEN Junbo1,LIU Linlin1,ZHANG Xiangyun1,CHI Ji’na1*
(1.Institute of Cotton,Hebei Academy of Agriculture and Forestry Sciences/Key Laboratory of Biology and Genetic Improvemet of Cotton in Huanghuaihai Semiarid Area,Ministry of Agriculture,Shijiazhuang 050051,China; 2.Hebei Academy of Governance,Shijiazhuang 050031,China)
In order to investigate the effect of salicylic acid on cold tolerance of cotton,the effects of exogenous salicylic acid(SA) on seed germination and seedling physiological characteristics under low temperature stress were studied by seed soaking and leaf spraying of CCRI 36.The results showed that soaking seeds in 0.25 mmol/L,0.5 mmol/L SA resulted in higher seed germination rate,germination potential and germination index,soaking seeds in SA more than 0.5 mmol/L had bad effects on germination under low temperature stress.With the increase of SA spraying concentrations,the relative conductivity and malondialdehyde(MDA) content of cotton leaf decreased first and then increased,while the superoxide dismutase(SOD) activity,peroxidase(POD) activity and soluble protein content increased first and then decreased.When the spraying concentration was 0.5 mmol/L,the relative conductivity and MDA content reached the minimum value,while the SOD activity,POD activity and soluble protein content reached the maximum value.Therefore,treating with 0.5 mmol/L SA was the most beneficial to promote the seed germination,and reduce the cell membrane damage of cotton by inhibiting the content of MDA,and increasing the activities of SOD and POD,soluble protein content.
cotton; salicylic acid; low temperature stress; cold resistance; physiological characteristics
2015-12-28
河北省自然科学基金青年项目(C2015301047);河北省财政专项(F15R2015043758)
蔡 肖(1982-),女,河北石家庄人,副研究员,博士,主要从事棉花抗逆育种相关工作。 E-mail:caixiaoziji@163.com
*通讯作者:迟吉娜(1977-),女,山东掖县人,副研究员,博士,主要从事棉花功能基因组和资源创新研究工作。 E-mail:chi-jina@126.com
S562
A
1004-3268(2016)07-0039-05

