外源H2S对干旱胁迫下小麦旗叶生理特性及籽粒产量的影响
丁会纳,马冬云,秦海霞,侯俊峰,王晨阳,谢迎新,郭天财
(河南农业大学 农学院/国家小麦工程技术研究中心/河南省粮食作物协同创新中心/小麦玉米作物学国家重点实验室,河南 郑州 450002)
外源H2S对干旱胁迫下小麦旗叶生理特性及籽粒产量的影响
丁会纳,马冬云*,秦海霞,侯俊峰,王晨阳,谢迎新,郭天财*
(河南农业大学 农学院/国家小麦工程技术研究中心/河南省粮食作物协同创新中心/小麦玉米作物学国家重点实验室,河南 郑州 450002)
为了探讨外源H2S供体NaHS能否在小麦生育后期提高其抗旱性,在大田盆栽条件下,以豫麦49-198为材料,于小麦挑旗期设置干旱处理,并在叶面喷施不同浓度(0、0.05、0.10 mmol/L)NaHS,测定不同处理下小麦旗叶叶绿素、丙二醛(MDA)、过氧化氢(H2O2)含量及抗氧化酶活性和籽粒产量。结果表明,叶面喷施NaHS可以显著提高干旱胁迫下小麦旗叶叶绿素含量,降低旗叶MDA和H2O2含量,提高旗叶中SOD、POD、CAT活性,进而提高干旱胁迫下小麦单株有效穗数、百粒质量和籽粒产量。其中,干旱胁迫下叶面喷施0.05、0.10 mmol/L NaHS处理小麦籽粒产量分别较不喷施NaHS处理显著提高17.9%、21.4%。综上,外源H2S 可以通过提高小麦旗叶的抗氧化酶活性降低MDA等有害物质积累,提高小麦植株的抗旱性,进而增加籽粒产量。
小麦; 硫化氢; 干旱胁迫; 生理指标; 产量
干旱是植物生长过程中经常遭受的重要逆境胁迫,严重影响植物的生长发育,造成农作物减产,甚至绝收[1-2]。干旱是我国粮食生产的首要灾害[3]。小麦是我国主要的粮食作物,是国民经济的基础[4],对我国的粮食安全具有重要作用。因此,研究干旱胁迫下小麦的生理反应和抗旱机制是缓解干旱胁迫的重要途径,对未来农业的发展有重要意义[5]。
H2S是近年来发现的继NO和CO之后的第3种内源气体信号分子,可调解气孔运动,促进根的发育,增强光合作用,缓解干旱、渗透和金属离子等多种非生物胁迫造成的伤害等,在植物生长发育及抗御逆境胁迫中起重要作用[6-8]。研究发现,干旱条件下,H2S参与干旱诱导拟南芥气孔关闭的信号转导过程[9];在干旱胁迫条件下,在大豆的培养液中添加H2S供体硫氢化钠(NaHS)能够缓解干旱胁迫对大豆幼苗根部膜系统的伤害,且NaHS浓度为40 μmol/L时效果最好[10];外源H2S可以抑制干旱胁迫下甘薯的叶绿体氧化,提高光合作用,增加地上部和地下部的生物量[11];适宜浓度的H2S在一定程度上可以提高干旱胁迫下玉米幼苗的渗透调节物质含量和抗氧化能力,从而提高对干旱环境的适应能力[12-13]。H2S在缓解小麦干旱胁迫中也起到了积极作用。吴单华等[14]研究发现,在高温和干旱胁迫下,NaHS灌根可提高小麦幼苗叶片中脯氨酸和可溶性糖含量,减轻膜脂过氧化产物的积累,从而提高小麦幼苗的存活率。目前,关于H2S在小麦生长后期干旱胁迫条件下的作用研究较少,而小麦生育后期由于高温干旱天气的增多,更容易遭受干旱胁迫而影响籽粒产量。为此,在小麦生育后期设置干旱处理,采用叶面喷施不同浓度H2S供体NaHS,研究其对小麦干旱胁迫的缓解作用,以期为小麦抗旱栽培提供理论依据与技术参考。
1 材料和方法
1.1 研究区概况
试验于2014—2015年在河南农业大学科教示范园区进行,试验地土壤为潮土,土壤含有机质10.8 g/kg、 全氮0.93 g/kg、速效磷25.1 mg/kg、速效钾124.9 mg/kg。
1.2 试验设计
供试材料为冬小麦品种豫麦49-198,采用盆栽种植。盆高25 cm、直径20 cm,土过筛后装盆。每盆装土10 kg,基施N(尿素,含N 46%)2.1 g、K2O(氯化钾,含K2O 62%)0.8 g、P2O5(过磷酸钙,含P2O512%)0.9 g,拔节期追施0.3 g尿素。在小麦挑旗期开始进行干旱胁迫和叶面喷施处理,共设置4个处理:对照(土壤相对含水量75%±5%,CK)、中度干旱(土壤相对含水量55%±5%,T1)、中度干旱+叶面喷施0.05 mmol/L NaHS(T2)、中度干旱+叶面喷施0.10 mmol/L NaHS(T3)。NaHS在小麦进行干旱处理时开始喷施,每7 d喷施一次,每次喷施浓度参照上面4个处理,共喷施4次。每个处理10盆,3叶期定苗,每盆留苗10株。管理同一般大田。
1.3 测定项目与方法
1.3.1 生理指标 分别于干旱处理14、21 d取样,随机选取长势一致的小麦旗叶20片,迅速放入液氮中,带回实验室放于-80 ℃冰箱,用于测定叶绿素、丙二醛(MDA)、过氧化氢(H2O2)含量及抗氧化酶(SOD、POD、CAT)活性。其中,叶绿素含量采用分光光度法测定[15];MDA含量采用硫代巴比妥酸比色法测定[15];H2O2含量参照Jessup等[16]的方法测定;SOD活性采用NBT光化还原法测定[17],POD活性采用愈创木酚法测定[18],CAT活性采用钼酸盐方法测定[19]。
1.3.2 籽粒产量 成熟期收获整盆小麦有效穗,考种后脱粒、风干并测定其总质量。
1.4 数据统计及分析
采用统计分析软件DPS V7.05进行数据统计及差异显著性分析,利用Excel 2007进行作图。
2 结果与分析
2.1 外源H2S对干旱胁迫下小麦旗叶叶绿素含量的影响
由表1可知,干旱胁迫下,小麦旗叶内叶绿素含量均较对照显著下降,但叶面喷施适宜浓度的NaHS使叶绿素含量较干旱胁迫未喷施NaHS处理显著提高。在干旱胁迫14 d时,叶面喷施0.05、0.10 mmol/L NaHS处理小麦旗叶中叶绿素a含量和总叶绿素含量分别较T1处理提高19.5%、31.9%和 10.7%、20.4%,叶绿素b含量显著降低。干旱胁迫21 d时,小麦旗叶叶绿素a、b及总含量在0.05 mmol/L和0.10 mmol/L NaHS处理之间没有显著差异,但均较T1处理显著提高。其中,叶面喷施0.05 mmol/L和0.10 mmol/L NaHS处理小麦旗叶叶绿素a、叶绿素b、总叶绿素含量分别较T1处理提高了85.4%、54.5%、74.8%和93.3%、54.5%、82.2%。综上,叶面喷施NaHS可以提高干旱胁迫下小麦叶片叶绿素含量,缓解干旱胁迫对小麦的伤害。
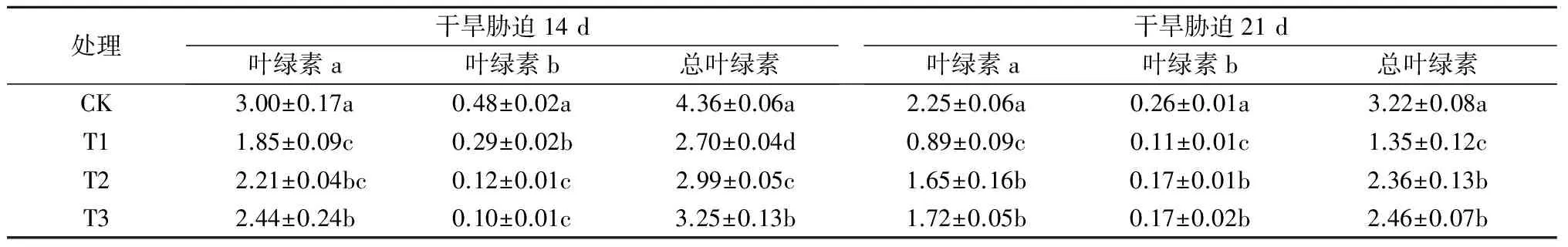
表1 外源H2S对干旱胁迫下小麦旗叶叶绿素含量的影响 mg/g
注:同列数据后不同字母表示处理间差异显著(P<0.05),下同。
2.2 外源H2S对干旱胁迫下小麦旗叶H2O2和MDA含量的影响
由表2可知,在干旱胁迫下,小麦旗叶中H2O2和MDA含量较对照显著提高,表明干旱胁迫造成了小麦叶片中细胞膜的损伤以及过氧化物的累积;而叶面喷施NaHS后可以降低旗叶H2O2和MDA含量,减少干旱胁迫对植株的伤害。在干旱胁迫14 d时,叶面喷施0.10 mmol/L NaHS处理旗叶中H2O2含量较T1处理显著降低16.6%,MDA含量较T1处理降低,但差异不显著;0.05 mmol/L NaHS处理旗叶中H2O2、MDA含量均较T1处理下降,但差异不显著。在干旱胁迫21 d时,喷施0.05 mmol/L NaHS处理小麦旗叶中H2O2、MDA含量分别较T1处理显著降低14.1%、7.9%,而喷施0.10 mmol/L NaHS处理小麦旗叶中H2O2、MDA含量分别较T1处理显著降低52.2%、7.9%。综上,喷施NaHS可以降低小麦旗叶中H2O2和MDA等有害物质的积累,减少干旱胁迫对植株的伤害。
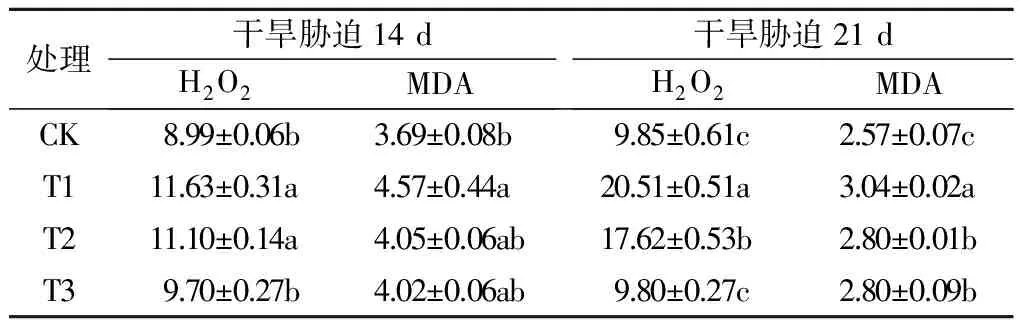
表2 外源H2S对干旱胁迫下小麦旗叶H2O2和MDA含量的影响 μmol/g
2.3 外源H2S对干旱胁迫下小麦旗叶抗氧化酶活性的影响
2.3.1 SOD 由图1可知,与对照相比,干旱胁迫显著抑制小麦旗叶SOD活性,而叶面喷施NaHS后可以缓解这种抑制作用,提高SOD活性。干旱胁迫14 d时,叶面喷施0.05、0.10 mmol/L NaHS处理小麦旗叶SOD活性分别较T1处理显著提高15.5%、22.0%,接近对照水平。干旱胁迫21 d时,叶面喷施0.10 mmol/L NaHS处理小麦旗叶SOD活性较T1处理显著提高27.0%;但0.05 mmol/L NaHS处理小麦旗叶SOD活性与T1处理之间差异不显著。综上,喷施适宜浓度的NaHS可提高小麦叶片SOD活性,进而增强小麦的抗旱性。
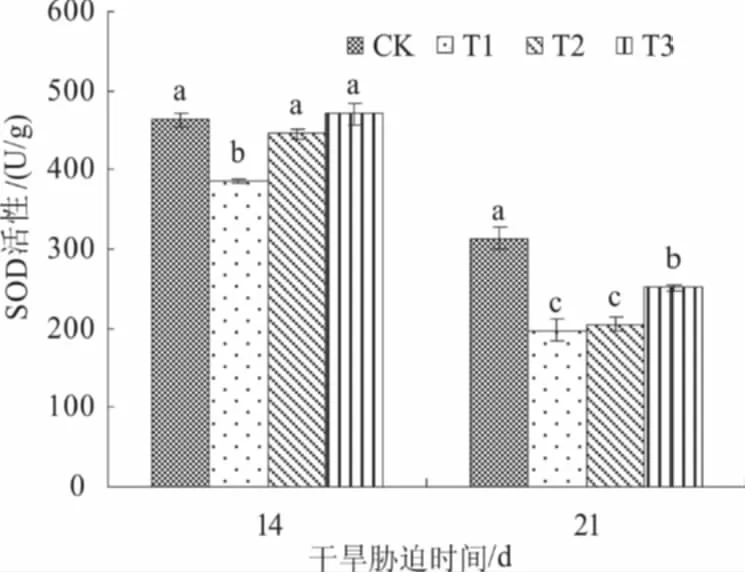
不同字母表示处理间差异显著(P<0.05),下同
2.3.2 POD 由图2可知,与对照相比,干旱胁迫显著抑制小麦旗叶POD活性,而叶面喷施NaHS后可以消除这种抑制作用,显著提高POD活性。干旱胁迫14 d时,叶面喷施0.05、0.10 mmol/L NaHS处理小麦旗叶POD活性分别较T1处理显著提高22.3%、30.0%,且0.10 mmol/L NaHS处理显著高于0.05 mmol/L NaHS处理。干旱胁迫21 d时,叶面喷施0.05、0.10 mmol/L NaHS处理小麦旗叶POD活性分别较T1处理显著提高32.1%、34.8%,0.05、0.10 mmol/L NaHS处理之间差异不显著。
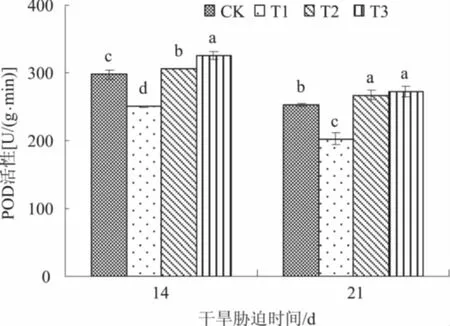
图2 外源H2S对干旱胁迫下小麦旗叶POD活性的影响
2.3.3 CAT 由图3可知,与对照相比,干旱胁迫显著抑制小麦旗叶CAT活性,叶面喷施NaHS后这种抑制作用得到缓解。干旱胁迫14 d时,叶面喷施NaHS处理小麦旗叶CAT活性较T1处理提高,但差异不显著。干旱胁迫21 d时,喷施0.05、0.10 mmol/L NaHS处理小麦旗叶CAT活性分别较T1处理显著提高13.6%、10.1%,表明叶面喷施NaHS可提高小麦旗叶内CAT活性,减少干旱胁迫对植株造成的伤害,提高小麦的抗旱性。
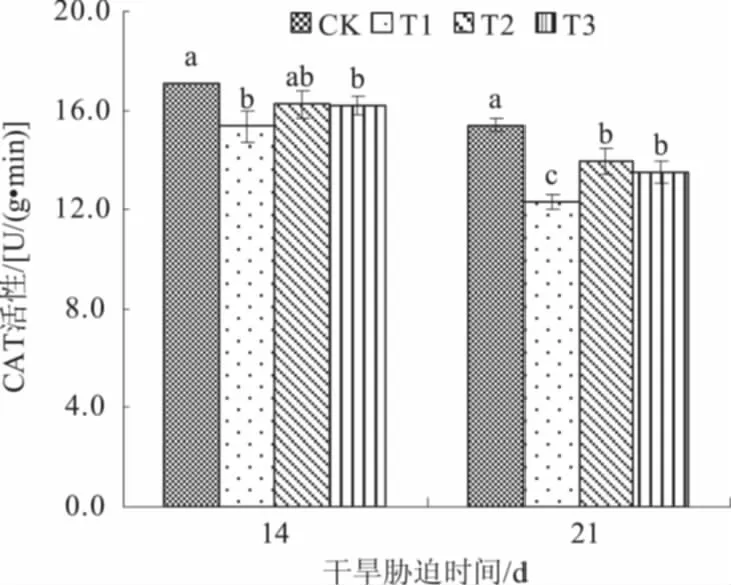
图3 外源H2S对干旱胁迫下小麦旗叶CAT活性的影响
2.4 外源H2S对干旱胁迫下小麦籽粒产量的影响
由表3可知,干旱胁迫下,小麦单株有效穗数、百粒质量、籽粒产量均较对照显著下降,叶面喷施NaHS后单株有效穗数、百粒质量、籽粒产量均有所提高。其中,喷施0.05、0.10 mmol/L NaHS处理单株有效穗数均较T1处理显著提高,但喷施0.05、0.10 mmol/L NaHS处理之间无显著差异;叶面喷施0.10 mmol/L NaHS处理百粒质量较T1处理显著增加0.13 g;叶面喷施0.05、0.10 mmol/L NaHS处理小麦籽粒产量分别较T1处理显著提高17.9%、21.4%。综上,干旱条件下叶面喷施NaHS可以提高小麦抗旱性,从而增加籽粒产量。
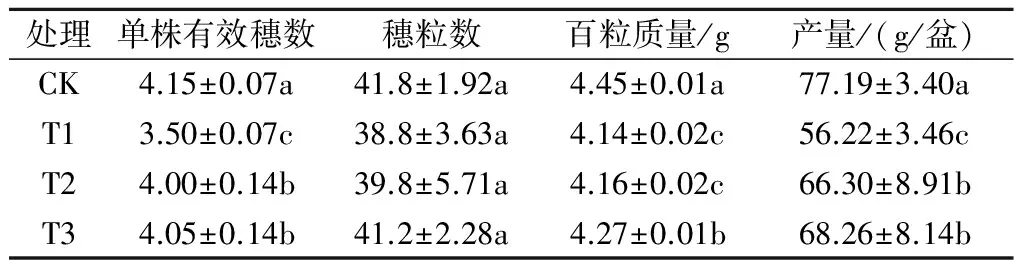
表3 外源H2S对干旱胁迫下小麦产量及其构成因素的影响
3 结论与讨论
旗叶是小麦植株生育后期重要的光合器官,叶绿素含量高低反映了植株光合能力的高低,一定程度上反映植物的抗旱能力。本研究结果表明,在干旱胁迫下,小麦旗叶叶绿素含量显著降低,严重影响光合产物的积累;而叶面喷施NaHS后小麦旗叶叶绿素含量显著提高,这与Zhang等[20]采用NaHS喷施渗透胁迫下的甘薯叶片可以显著减弱其失绿程度,增加植物叶片叶绿素含量的结果相一致。上述结果表明,叶面喷施NaHS可以提高小麦旗叶叶绿素含量,减缓干旱胁迫对小麦造成的伤害。
植物在逆境条件下,细胞内活性氧的不断积累加速质膜过氧化反应,引起MDA等有害物质的积累,而SOD、POD、CAT等抗氧化酶活性的增加可以降低活性氧积累及有害物质的产生。研究表明,NaHS可以提高铝胁迫下种子胚乳β-淀粉酶和酯酶活性,同时减少铝胁迫对植物细胞质膜均一性的损坏,MDA和H2O2水平也相应降低[21]。在本研究中,干旱胁迫下,SOD、POD和CAT活性显著下降,同时H2O2和MDA含量显著上升;而叶面喷施NaHS后,SOD、POD和CAT活性显著增加,且MDA、H2O2含量显著下降,表明NaHS可通过增加小麦旗叶抗氧化酶活性来降低细胞内活性氧及MDA等有害物质的积累,提高小麦的抗旱性。在大豆的研究中也发现,喷洒NaHS可缓解干旱降低幼苗叶绿素含量的现象,且可显著提高SOD、CAT活性,降低LOX活性,延缓MDA和H2O2的过量积累[22]。前人研究表明,植株生长对NaHS有浓度依赖性,NaHS浓度低于4.2 μmol/L时,可以促进水稻幼苗生长,而浓度高于8.5 μmol/L时则抑制水稻幼苗的生长[23]。在本研究中,没有发现与此一致的结论,在小麦生育后期叶面喷施0.05、0.10 mmol/L NaHS均可以增加小麦抗氧化酶活性,减少旗叶叶绿素分解,降低MDA、H2O2的积累,增强植株的抗旱性,从而增加小麦籽粒产量,且这2种NaHS浓度处理之间籽粒产量没有显著差异。
[1] 张军,刘红,李晓萍,等.干旱对小麦孕穗期叶片生理特性及产量的影响[J].干旱地区农业研究,2014,32(3):1-6.
[2] 张建平,赵艳霞,王春乙,等.不同发育期干旱对冬小麦灌浆和产量影响的模拟[J].中国生态农业学报,2012,20(9):1158-1165.
[3] 王春乙.重大农业气象灾害研究进展[M].北京:气象出版社,2007:10-19.
[4] 于振文,王月福,王东,等.优质专用小麦品种与栽培[M].北京:中国农业出版社,2001:137.
[5] Vinocur B,Altman A.Recent advances in engineering plant tolerance to a biotic stress:Achievements and limitations[J].Current Opinion in Biotechnology,2005,16(2):123-132.
[6] Shan C,liu H,Zhao L,etal.Effects of exogenous hydrogen sulfide on the redox states of ascorbate and glutathione in maize leaves under salt stress[J].Biologia Plantarum,2014,58(1):169-173.
[7] Bharwana S A,Ali S,Farooq M A,etal.Hydrogen sulfide ameliorates lead induced morphological,photosynthetic,oxidative damages and biochemical changes in cotton[J].Environ Sci Pollut Res,2014,21(1):717-731.
[8] Christou A,Manganaris G A,Papadopoulos I,etal.Hydrogen sulfide induces systemic tolerance to salinity and noni-onic osmotic stress in strawberry plants through mo-dification of reactive species biosynthesis and transcriptional regulation of multiple defence pathways[J].Journal of Experimental Botany,2013,64(7):1953-1966.
[9] 王兰香,侯智慧,侯丽霞,等.H2O2介导的H2S产生参与干旱诱导的拟南芥气孔关闭[J].植物学报,2012,47(3):217-225.
[10] 史程圆.硫化氢在大豆抗旱适应中的保护作用[D].北京:中央民族大学,2012.
[11] Zhang H,Ye Y K,Wang S H,etal.Hydrogen sulfide counteracts chlorophyll loss in sweetpotato seedling lea-ves and alleviates oxidative damage against osmotic stress[J].Plant Growth Regulation,2009,58(3):243-250.
[12] 单长卷,赵元增.外源硫化氢对干旱胁迫下玉米幼苗水分生理特性的影响[J].干旱地区农业研究,2015,3(5): 80-84,231.
[13] 单长卷,周岩,赵元增.外源硫化氢对干旱条件下玉米幼苗抗氧化特性的影响[J].干旱地区农业研究,2015,33(6):161-166.
[14] 吴单华,李应林,夏眴,等.硫化氢供体硫氢化钠处理提高小麦对高温和干旱胁迫的综合抵抗能力[J].云南师范大学学报(自然科学版),2013,33(6):29-35.
[15] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[16] Jessup W,Deean R,Gebicki J.Iodometric determination of hydroperoxides in lipid and proteins[J].Methods Enzymol,1994,233:289-298.
[17] Stewart R R C,Bewley J D.Lipid peroxidation associated with accelerated aging of soybean axes[J].Plant Physiol,1980, 5(2):245-248.
[18] Maehiy A C.Plant peroxidase[J].Method Enzymol,1955,2:801-813.
[19] Karsten U,Franklin L A,Luning K,etal.Natural ultrav-iolet radiation and photosynthetically active radiation induce form ation of my cosporine like amino acids in the marine macrolgaChondruscrispus(Rhodophyta)[J].Planta,1998,205(2):257-262.
[20] Zhang H,Ye Y K,Wang S H,etal.Hydrogen sulfide counteracts chlorophyll loss in sweetpotato seedling lea-ves and alleviates oxidative damage against osmotic stress[J].Plant Growth Regul,2009,58(3):243-250.
[21] Zhang H,Dou W,Jiang C X,etal.Hydrogen sulfide stimulates β-amylase activity during early stages of wheat grain germination[J].Plant Signal Behavior,2010,5(8):1031-1033.
[22] Zhang H,Jiao H,Jiang C X,etal.Hydrogen sulfide protects soybean seedlings against drought induced oxidative stress[J].Acta Physiol Plant,2010,32(5):849-857.
[23] 梁峥,汤佩松.硫化氢和低温对水稻幼苗生长和呼吸的影响[J].植物生理学通讯,1980(6):19-23.
Effect of Exogenous Hydrogen Sulfide on Physiological Characteristics of Flag Leaf and Grain Yield of Wheat under Drought Stress
DING Huina,MA Dongyun*,QIN Haixia,HOU Junfeng,WANG Chenyang, XIE Yingxin,GUO Tiancai*
(College of Agronomy,Henan Agricultural University/National Engineering Research Center for Wheat/Collaborative Innovation Center of Henan Grain Crops/State Key Laboratory of Wheat and Maize Crop Science,Zhengzhou 450002,China)
In order to investigate whether the exogenous hydrogen sulfide donor sodium hydrosulfide(NaHS) can improve the drought resistance at late growth stages of wheat,the experiments were carried out to study the the contents of chlorophyll,malondialdehyde(MDA),hydrogen peroxide(H2O2)and antioxidant enzymes activities of flag leaf and grain yield of wheat with foliar spraying exogenous different concentrations(0,0.05,0.10 mmol/L)of NaHS under drought stress.The results showed that foliar spraying NaHS could significantly increase the concent of chlorophyll,reduce the contents of MDA and H2O2,and increase the SOD,POD and CAT activities of flag leaf,sequentially improving panicle number per plant,hundred-grain weight and grain yield of wheat under drought stress.Compared with the treatment without NaHS,the yield of the treatments with 0.05 mmol/L NaHS and 0.10 mmol/L NaHS significantly increased by 17.9% and 21.4%,respectively.These results showed that exogenous H2S could improve the drought resistance of wheat plant,and increase grain yield by increasing the activity of antioxidant enzymes of flag leaf and reducing harmful substance accumulation.
wheat; hydrogen sulfide; drought stress; physiological indexes; yield
2016-01-30
国家科技支撑计划项目(2015BAD26B00);农业公益性行业科研专项(201203031);河南省高校重点项目 (15A210004)
丁会纳(1992-),女,河南濮阳人,在读硕士研究生,研究方向:作物栽培。E-mail:1124936854@qq.com
*通讯作者:马冬云(1972-),女,河南修武人,副研究员,博士,主要从事小麦品质生理研究。E-mail:xmzxmdy@126.com 郭天财同为通讯作者。
S512.1
A
1004-3268(2016)07-0013-05

