退耕还林对地面蜘蛛种群的影响
姚润枝,周在豹,闫国增,*,田作宝,王 朔,李 凯
1 北京林业大学自然保护区学院,北京 100083 2 北京市林业保护站, 北京 100029 3 北京市顺义区林业保护站,北京 101300 4 北京大东流苗圃,北京 102211
退耕还林对地面蜘蛛种群的影响
姚润枝1,周在豹2,闫国增2,*,田作宝3,王 朔4,李 凯1
1 北京林业大学自然保护区学院,北京 100083 2 北京市林业保护站, 北京 100029 3 北京市顺义区林业保护站,北京 101300 4 北京大东流苗圃,北京 102211
为探究退耕还林对地面蜘蛛群落的影响,分别于2014和2015年3月—9月期间,采用陷阱法对北京市顺义区南彩镇退耕还林已2a和3a的林带及相邻原非作物生境林带中地面蜘蛛的活动密度进行了系统调查和分析。结果,2014年在调查区域共采集地面蜘蛛1465头,隶属8科18属32种,2015年共收集地面蜘蛛2186头,隶属10科25属45种;退耕还林以后蜘蛛类群发生改变,地面蜘蛛丰富度增加,而部分农田蜘蛛消失;2014年原非作物生境林带中地面蜘蛛的多样性指数、丰富度都极显著高于退耕还林林带(P<0.01),均匀性指数不存在显著差异,2015年两个林带的多样性指数仍存在极显著差异(P<0.01),丰富度存在显著差异(P<0.05),均匀性指数之间不存在显著差异;退耕还林以后第3年新建林带和原非作物生境林带中地面蜘蛛的活动密度随时间的变化趋势相近。研究结果表明:顺义地区退耕还林工程实施3a以后,新建人工林仍处于生境重建阶段,未完全达到稳定状态,退耕还林以后第3年新建林带中地面蜘蛛群落的稳定性高于第2年。退耕还林通过改变原有农田生态系统的植被种类、结构、人为管理等方式,使原有农田生态系统发生了根本性的改变。持续研究退耕还林对地面蜘蛛的类群变化的影响对生境受到干扰后生物群落变化过程的认识有理论意义。
退耕还林;陷阱法;地面蜘蛛;活动密度;群落稳定性
我国退耕还林工程(Grain for Green Project,GGP)于1999年开始试点,2002年1月全面启动。从1999年到2008年,全国累计实施退耕还林超过2万km2[1]。从2012年开始,北京市用3a左右的时间,在平原地区新增森林667km2[2],其中1/3的林地来自退耕还林。退耕还林带来的耕地性质的改变导致生态系统也随之变化,这种土地覆被类型的变化首先会引起生态系统生物多样性的变化,进而演化出具有新的生态功能的生物系统。
天然林因具有丰富的植物资源和复杂的生境格局,具有保护生物多样性的潜力。而生境改造后营建的人工林对生物多样性的保护潜力,至今为止仍存在许多争议:一种观点认为相较于生境复杂、植物种类繁多的天然林,人造纯林很难维持生物的多样性[3- 4];另一种观点认为,人工林已经是陆生森林生态系统的重要组成部分,是天然林的重要补充,在生物多样性的保护中也起到了重要的作用[5- 7]。在国内外对人工造林生态效应研究中,学者们更多的探讨了人工造林对植物多样性的影响[4,8- 9],而对鸟类多样性[5- 6,10]、昆虫群落[7]、真菌菌落[11]和土壤环境[12]的影响的研究仍然较少。
过去的研究表明,多年生的农田草地带可以提高农田中蜘蛛的数量[13],植被结构是影响蜘蛛种群的重要因素之一,植被的高度、密度、覆盖度和蜘蛛的多度有明显的相关性[14],同时,蜘蛛和其它无脊椎动物类群相比,能被有效的捕捉和鉴定[15- 19],因此蜘蛛可以作为研究生境调整对生态系统造成影响的生物指示物种[20- 21]。本研究旨在了解北京地区退耕还林对地面蜘蛛种群的影响,进而推测人工造林以后林带生态系统恢复情况,为生态系统修复提供更多的理论依据。
本项目组曾于2011年在北京市顺义区南彩镇开展过关于农林复合系统蜘蛛群落结构及其与环境关系的研究,该区域于2012年实施退耕还林,退耕还林以前由轮作种植冬小麦、玉米的农作物田和毗邻农田北边的非作物生境林带——毛白杨Populustomentosa-圆柏Sabinachinensis-旱柳SalixmatsudanaKoidz间种混交林组成,退耕还林将原有耕地转变为山桃林PrunusdavidianaFranch(退耕还林林带)。本研究采用陷阱法对退耕还林2年和3年后的地面蜘蛛种群密度和种群多样性进行调查,以从该层面评价退耕还林对生态系统生物多样性的影响进程及特点。
1 材料与方法
1.1 试验地概况
北京市顺义区位于北京市东北部,顺义城区距北京市中心30 km。全境属温带大陆性半湿润季风气候,四季分明。年平均气温11.5℃,年日照时数达2746 h,无霜期195 d左右,年相对湿度58%,年均降雨量610 mm。顺义所处平原为河流洪水携带沉积物质造成,表面堆积物主要是砂、亚砂土,面积占95.7%[22]。
1.2 试验设计
试验于2014、2015年3月下旬到9月中旬在北京市顺义区南彩镇(116°40′E,40°14′ N)进行,试验区域总面积约10 hm2(东西向宽200 m×南北向长500 m),其中退耕还林林带东西向宽200 m×南北向长450 m;非作物生境林带东西向长200 m×南北向宽50 m。
原非作物生境林带(林带a)南北行距5 m,东西株距2 m,林龄15a,由毛白杨、圆柏、旱柳组成,毛白杨平均高度12 m,平均胸径0.35 m;圆柏平均高度4 m;旱柳平均高度10 m,平均胸径0.25 m。陷阱设置9组,按3×3布局均匀排布在林带内,每组陷阱由4个单独的容器排在1 m×1 m样方内。
退耕还林林带(林带b),林龄为3a,种植山桃,山桃平均高度2.5 m,平均胸径0.13 m,东西株距3.5 m,南北株距2.5 m。陷阱排列及数量与林带a相同。
1.3 地面蜘蛛采集方法
对地面蜘蛛的调查采用陷阱法,将一次性塑料杯埋入地下,塑料杯杯口与地面持平,每个陷阱的上方用铁丝固定另外一只塑料杯作为顶棚以遮挡雨水;杯口直径为7cm,杯底直径5cm,杯深8cm,容积约为200ml。陷阱溶液为白糖、食醋、酒精与水其重量比例约为1∶2∶2∶20。
每10天收集1次陷阱容器中的蜘蛛,并转移到75%的酒精中保存,根据相关资料[23- 24]进行鉴定,所有成年蜘蛛鉴定到种,幼蛛鉴定到属。统计其种类与数量。
1.4 数据统计与分析
根据Berger-Parker的优势度指数(D)[25]的计算结果对物种的优势等级进行划分,计算公式为:
D=Nmax/N
将其划分为5个等级:D≥0.1时为优势种;0.05≤D<0.1时为丰盛种;0.01≤D<0.05时为常见种;当0.001 ≤D<0.01时为偶见种;当D<0.001时为稀少或罕见种。
用记录到的地面蜘蛛物种数表示地面蜘蛛群落丰富度。
使用Shannon-Wiener(1949)的多样性指数(H′)[26- 27]评估每个林带内地面蜘蛛群落的多样性程度,计算公式为:
式中,n为群落中的物种数,Pi为群落中第i个物种的数量(Ni)与所有物种总数(N0)的比值,在此基础上,使用Pielou的均匀性指数(E)[28]反映林带地面蜘蛛群落的均匀度,公式如下:
以每平方米内4个陷阱采集到的地面蜘蛛总数进行数据分析,使用SPSS 20.0对分析数据进行正态检验,当数据满足正态分布时对数据进行独立样本T检验,当数据不符合正态分布时,使用非参数独立样本Mann-Whitney U检验;显著性标准为P<0.05。用GraphPad Prism 5进行图表绘制。
2 结果与分析
2.1 退耕还林后地面蜘蛛类群组成
2014年在调查样地内共采集蜘蛛标本1465头,经鉴定,分别隶属于8科18属32种。其中白纹舞蛛AlopecosaalbostriataGrube(40.41%)、星豹蛛PardosaastrigeraL.Koch(20.89%)、利氏平腹蛛GnaphosalicentiSchenkel(10.10%)是优势种,赫氏豹蛛P.hediniSchenkel(9.42%)为丰盛种,鞍形花蟹蛛XysticusephippiafusSimon(4.64%)、三斑花蟹蛛X.pseudobliteusSimon(2.32%)、奇异獾蛛TrochosaruricolaDegeer(1.77%)、中华平腹蛛G.sinensisSimon(1.64%)、亚洲狂蛛ZelotesasiaticusBoes.et Str(1.02%)、利氏舞蛛A.licentiSchenkel(1.02%)、赫氏花蟹蛛X.hediniSchenkel(1.02%)为常见种。
2015年调查样地内共采集蜘蛛标本2186头,经鉴定,分别隶属于10科25属45种。其中白纹舞蛛(33.76%)、利氏平腹蛛(15.23%)、赫氏豹蛛(10.84%)、星豹蛛(10.80%)是优势种,鞍形花蟹蛛(4.43%)、奇异獾蛛(3.84%)、利氏舞蛛(3.34%)、三斑花蟹蛛(2.83%)、阴沟瘤蛛OedothoraxfemineaBoes. et Str(2.10%)、亚洲狂蛛(1.69%)、中华平腹蛛(1.69%)、赫氏花蟹蛛(1.24%)、大卫狂蛛Z.davidiSchenkel(1.19%)为常见种。各样地内不同林带采集到的地面蜘蛛的种类及数量见表1。
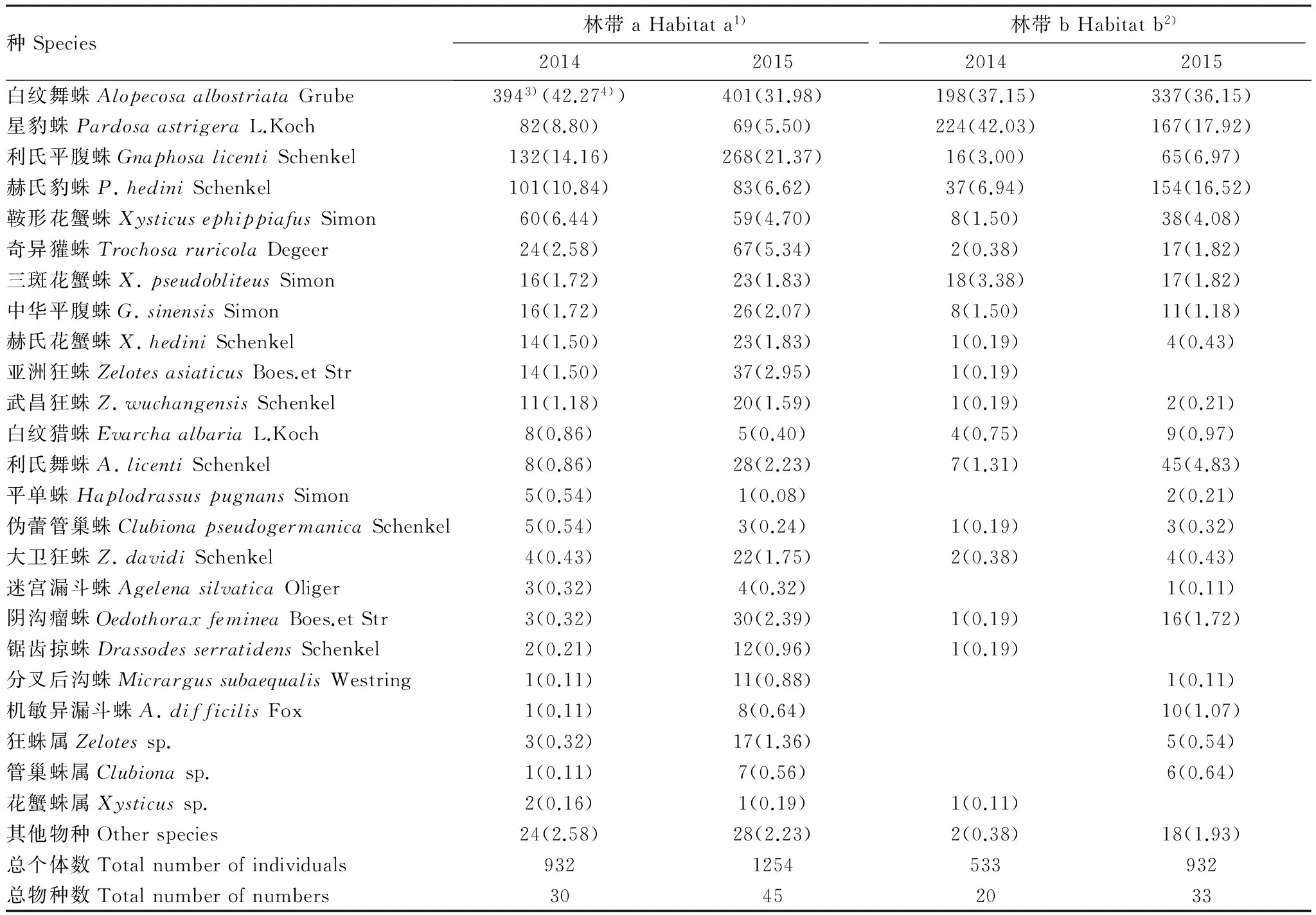
表1 2014—2015年原非作物生境林带和退耕还林林带地面蜘蛛物种组成
1)林带a:原非作物生境林带;2)林带b:退耕还林林带;3) 每年林带a和林带b在调查期间所有样点捕获的每个蜘蛛物种的个体数量;4)括号内的数表示每个物种的数量在每年调查期间捕获蜘蛛总量中所占的百分比对退耕还林前[29]和退耕还林后在该样地采集到的地面蜘蛛种类数量进行比较,在退耕还林初期,采集到的地面蜘蛛的科、属数量先减少后增加,而地面蜘蛛的种类数量则逐年增加(表2)。

表2 退耕还林前后采集到的地面蜘蛛科、属、种数量统计表
2.2 退耕还林前后地面蜘蛛群落相似度
分别对退耕还林以前(2011年)和退耕还林以后第2年(2014年)、第3年(2015年),在林带a和林带b两种生境中采集到的地面蜘蛛的丰富度、多样性指数和均匀度指数进行比较,结果显示:2011年非作物生境林带和农田中地面蜘蛛类群的丰富度不存在显著差异,2014年林带a中地面蜘蛛的丰富度极显著高于林带b(P<0.01),2015年林带a中蜘蛛的丰富度显著高于林带b(P<0.05)。对多样性指数进行比较,2011年中两个林带的多样性指数不存在显著性差异,2014和2015年林带a中地面蜘蛛的多样性指数极显著高于林带b(P<0.01)。退耕还林前后,3a中两个林带的均匀性指数都不存在显著性差异(图1)。
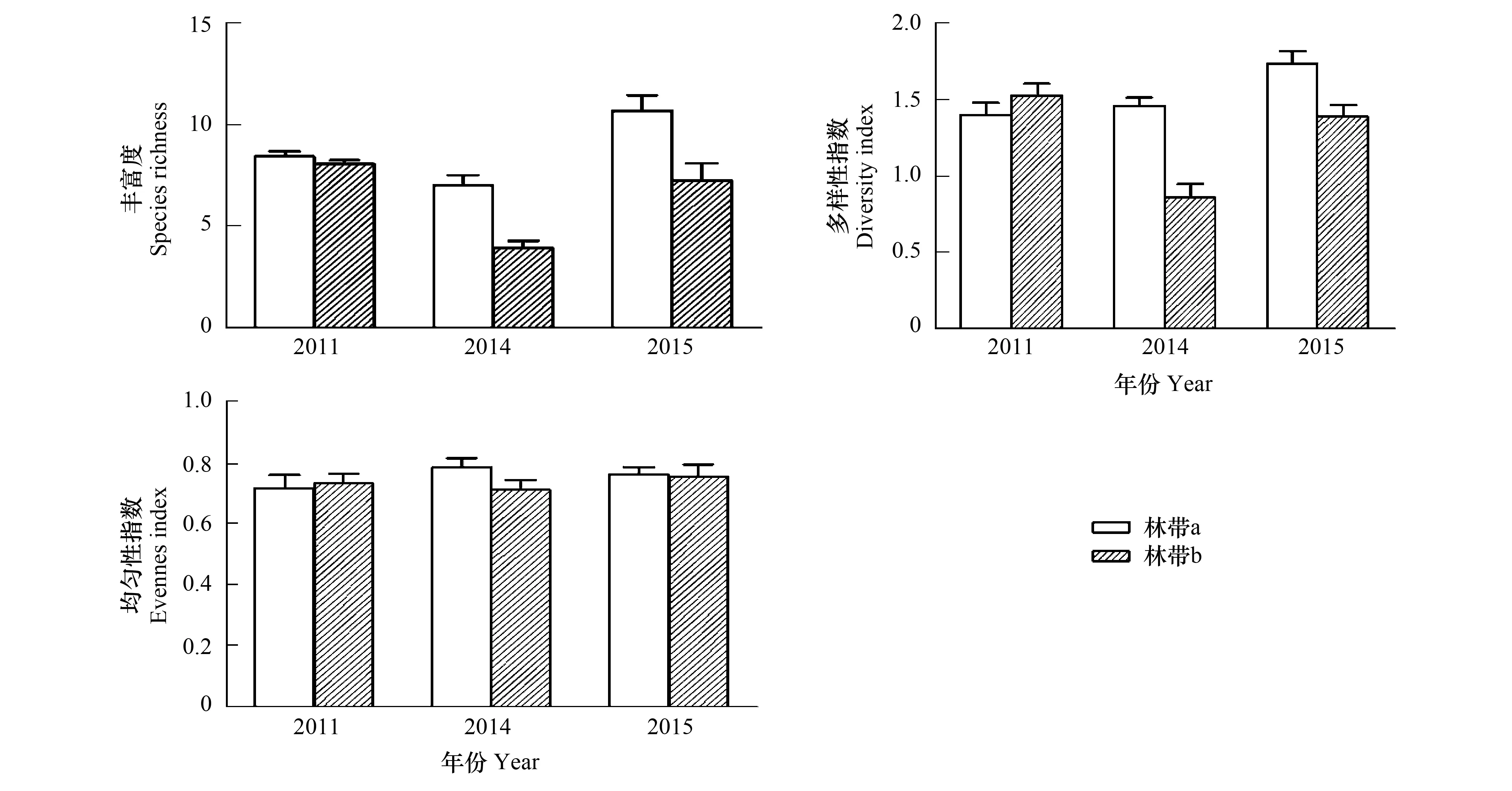
图1 退耕还林前后两种生境中采集到的地面蜘蛛丰富度、多样性指数和均匀性指数(Mean±SE)Fig.1 Average values of ground-dwelling spider species richness, diversity index and evenness index in the studied habitats before and after GGP(Mean±SE)
2.3 退耕还林后地面蜘蛛种群动态
2014年3月底到9月中旬地面蜘蛛在林带a的平均活动密度显著高于林带b(P<0.05)。在调查期间,5月30日、6月10日和6月20日林带a中收集到的蜘蛛数量显著高于林带b(P<0.05)。从5月10日开始,林带a中蜘蛛的密度逐渐增加,并且在6月中旬达到峰值(20.41±3.10)头/m2,达到峰值以后林带a中蜘蛛的活动密度逐渐降低;林带b中蜘蛛的活动密度从6月10日以后开始逐渐升高,在7月中上旬达到峰值(12.00±1.91)头/m2,随后密度也逐渐降低。7月30日的调查中发现陷阱受到了严重的人为破坏,所以林带a和林带b中收集到的蜘蛛的数量出现了明显的波动(图2)。

图2 2014年两种林带中地面蜘蛛的活动密度变化(Mean±SE)Fig.2 Ground-dwelling spider density variation in two types of forests in 2014(Mean±SE)
2015年3月底到9月中旬地面蜘蛛在林带a中的平均活动密度显著高于林带b(P<0.05)。在每一次调查中,林带a和林带b的地面蜘蛛活动密度没有显著性差异。自3月开始两个林带中地面蜘蛛活动密度变化趋势相近,从5月13日开始,两个林带中蜘蛛的密度逐渐增加,并且同时在7月中旬达到峰值(林带a:(21.09±4.10)头/m2;林带b:(17.87±5.00)头/m2),达到峰值以后林带b中地面蜘蛛的活动密度逐渐降低,林带a中地面蜘蛛的活动密度在7月下旬出现波动,在8月上旬,新建林带中山桃第一次结果,大量山桃掉落,腐烂变质并且堵塞陷阱,退耕还林林带中采集到的地面蜘蛛数量很少,两个林带中地面蜘蛛的活动密度降到最低(林带a:(1.25±0.36)头/m2;林带b:(0.68±0.09)头/m2),地面蜘蛛在8月下旬、9月上旬在林带a中的活动密度回升,在林带b中维持较低活动密度(图3)。
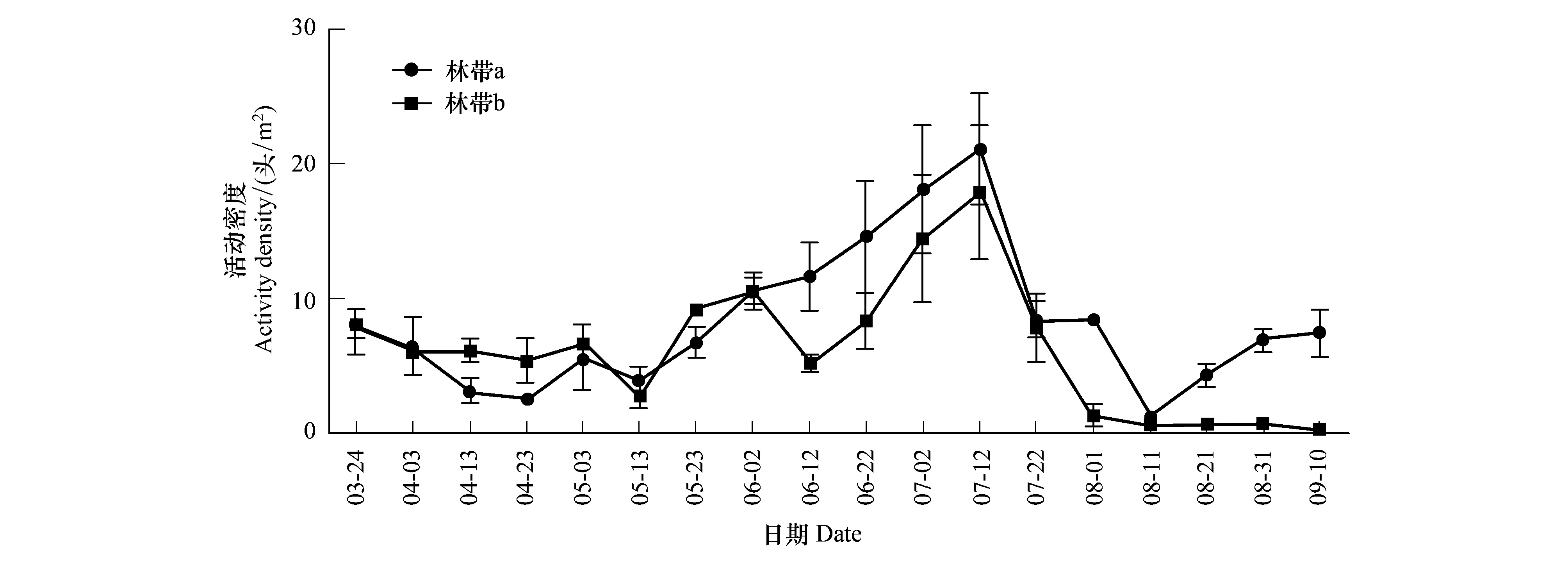
图3 2015年两种林带中地面蜘蛛的活动密度变化(Mean±SE)Fig.3 Ground-dwelling spider density variation in two types of forests in 2015(Mean±SE)
3 讨论
退耕还林对生境的改变是深刻的,其对景观改变的同时相关的动物类群也受到影响。2012年退耕还林以后,原有的蜘蛛类群发生了改变。园蛛科、卷叶蛛科、肖蛸蛛科和球腹蛛科在2014和2015年没有被采集到,这类蜘蛛因在作物的枝叶间结网而具有农田蜘蛛属性[30]。退耕还林以后新采集到并且数量较多的皿蛛科蜘蛛,该类群多出现在山区灌木丛或山坡的杂草间[30]。与Fuller等[31]对退耕还林7a以后地面蜘蛛的研究结果一致,退耕还林初期,生境调整使地面蜘蛛的种类数量增加。
在地面蜘蛛种群丰富度、多样性指数、均匀度指数方面,退耕还林以后第2年多样性指数和丰富度都存在极显著差异,退耕还林以后第3年多样性指数仍存在极显著差异,但丰富度变为显著性差异。这个结果反映了退耕还林初期,随着年份的增加地面蜘蛛群落稳定性的变化。退耕还林以后第2年和第3年新建林带中地面蜘蛛类群都仍处于群落重建阶段,但相较于退耕还林以后第2年,退耕还林第3年地面蜘蛛群落稳定性增加。
退耕还林后第2年,两个林带中地面蜘蛛种群动态的峰值存在近1个月的时间差,但退耕还林后第3年两个林带中地面蜘蛛的活动密度变化趋势相近,大部分时间都呈现 “同增同减”,并且峰值相重合。在农田生态系统中,非作物生境对维持天敌种类和数量所发挥着重要的功能和作用[32- 34],对局部农田进行生境调整以后,单一作物生境的消失,农田害虫失去了适宜的生存环境,森林害虫逐渐通过迁移在新的林带中定殖,原非作物生境在不同生态系统中的生态功能也逐渐发生变化。退耕还林后第3年,成熟林带和新建林带相互作用,两个林带的异质性逐渐降低,地面蜘蛛活动密度时间动态逐渐趋于一致,新建林带的成熟度增加。
本研究显示,退耕还林以后,地面蜘蛛对生境变化表现出了较大的适应性差异。虽然部分农田蜘蛛消失,但地面蜘蛛种类数量增加。退耕还林后第3年,新建林带中的地面蜘蛛虽然仍处于种群重建阶段,但较退耕还林后第2年地面蜘蛛在新建林带的种群稳定性增加。针对退耕还林对地面蜘蛛类群变化的持续研究有助于了解平原地区生物群落应对变化的过程和变化趋势,对于农区生态系统生态学的研究具有积极作用。
[1] 张秀斌, 赵玉涛, 胡琴. 地减粮增不是梦——写在退耕还林工程建设10周年之际. 中国林业, 2009, (18): 30-33.
[2] 李晓梅, 李树一, 王琪. 25万亩森林环绕北京城——北京市平原造林绿化工程初现近自然森林景观. 国土绿化, 2012, (6): 30-33.
[3] Fahy O, Gormally M. A comparison of plant and carabid beetle communities in an Irish oak woodland with a nearby conifer plantation and clearfelled site. Forest Ecology and Management, 1998, 110(1/3): 263-273.
[4] Souza A F, Ramos N P, Pizo M A, Hübel I, Crossetti L O. Afforestation effects on vegetation structure and diversity of grasslands in southern Brazil: The first years. Journal for Nature Conservation, 2013, 21(1): 56-62.
[5] Santos T, Tellería J L, Díiaz M, Carbonell R. Evaluating the benefits of CAP reforms: Can afforestations restore bird diversity in Mediterranean Spain?. Basic and Applied Ecology, 2006, 7(6): 483-495.
[6] Lachance D, Lavoie C, Desrochers A. The impact of peatland afforestation on plant and bird diversity in southeastern Québec. Ecoscience, 2005, 12(2): 161-171.
[7] Plath M, Dorn S, Barrios H, Mody K. Diversity and composition of arboreal beetle assemblages in tropical pasture afforestations: effects of planting schemes and tree species identity. Biodiversity and Conservation, 2012, 21(13): 3423-3444.
[8] 王树森, 余新晓, 罗于洋, 赵广亮, 杨君, 海龙. 人工造林对八达岭森林植被木本植物生物多样性的影响. 北京林业大学学报, 2008. 30(S2): 155-159.
[9] Ginsberg P. Restoring biodiversity to pine afforestations in Israel. Journal for Nature Conservation, 2006. 14(3/4): 207-216.
[10] Wilson M W, Gittings T, Pithon J, Kelly T C, Irwin S, O′Halloran J. Bird diversity of afforestation habitats in Ireland: current trends and likely impacts. Biology and Environment-Proceedings of the Royal Irish Academy, 2012, 112B(1): 55-68.
[11] Krpata D, Mühlmann O, Kuhnert R, Ladurner H, Göbl F, Peintner U. High diversity of ectomycorrhizal fungi associated withArctostaphylosuva-ursiin subalpine and alpine zones: Potential inoculum for afforestation. Forest Ecology and Management, 2007, 250(3): 167-175.
[12] De Keersmaeker L, Martens L, Verheyen K, Hermy M, De Schrijver A, Lust N. Impact of soil fertility and insolation on diversity of herbaceous woodland species colonizing afforestations in Muizen forest (Belgium). Forest Ecology and Management, 2004, 188(1/3): 291-304.
[13] Huusela-Veistola E. Effects of perennial grass strips on spiders (Araneae) in cereal fields and impact on pesticide side-effects. Journal of Applied Entomology, 1998. 122(1/5): 575-583.
[14] Rypstra A L, Carter P E, Balfour R A, Marshall S D. Architectural features of agricultural habitats and their impact on the spider inhabitants. The Journal of Arachnology, 1999, 27(1): 371-377.
[15] Wise D H. Wandering spiders limit densities of a major microbi-detritivore in the forest-floor food web. Pedobiologia, 2004, 48(2): 181-188.
[16] Oxbrough A G, Gittings T, O′Halloran J, Giller P S, Smith G F. Structural indicators of spider communities across the forest plantation cycle. Forest Ecology and Management, 2005, 212(1/3): 171-183.
[17] Shochat E, Stefanov W L, Whitehouse M E A, Faeth S H. Urbanization and spider diversity: Influences of human modification of habitat structure and productivity. Ecological Applications, 2004, 14(1): 268-280.
[18] Marc P, Canard A, Ysnel F. Spiders (Araneae) useful for pest limitation and bioindication. Agriculture, Ecosystems & Environment, 1999, 74(1/3): 229-273.
[19] Hore U, Uniyal V P. Diversity and composition of spider assemblages in five vegetation types of the Terai Conservation Area, India. Journal of Arachnology, 2008, 36(2): 251-258.
[20] Pearce J L, Venier L A. The use of ground beetles (Coleoptera: Carabidae) and spiders (Araneae) as bioindicators of sustainable forest management: A review. Ecological Indicators, 2006, 6(4): 780-793.
[21] Maleque M A, Maeto K, Ishii H T. Arthropods as bioindicators of sustainable forest management, with a focus on plantation forests. Applied Entomology and Zoology, 2009, 44(1): 1-11.
[22] 顺义区人民政府办公室. 顺义概况——自然概况.(2016- 5- 12) [2016- 6- 2]. http://www.bjshy.gov.cn/Item/42454.aspx
[23] 宋大祥, 朱明生, 陈军. 河北动物志·蜘蛛类. 石家庄: 河北科学技术出版社, 2001.
[24] 朱明生, 张保石. 河南蜘蛛志·蛛形纲:蜘蛛目. 北京: 科学出版社, 2011.
[25] 钱迎春, 马克平. 生物多样性研究的原理与方法. 北京: 中国科学技术出版社, 1994.
[26] Peet R K. The measurement of species diversity. Annual Review of Ecology and Systematics, 1974, 5: 285-307.
[27] 马克平, 刘玉明. 生物群落多样性的测度方法 Ⅰα多样性的测度方法(下). 生物多样性, 1994, (4): 231-239.
[28] Pielou E C. 数学生态学引论//卢泽愚, 译. 1版. 北京: 科学出版社, 1978.
[29] 张欣颖. 北京农林复合系统蜘蛛群落结构及其与环境关系研究[D]. 北京: 北京林业大学, 2012.
[30] 胡金林. 中国农林蜘蛛: 天津: 天津科学技术出版社, 1984.
[31] Fuller L, Oxbrough A, Gittings T, Irwin S, Kelly T C, O′Halloran J. The response of ground-dwelling spiders (Araneae) and hoverflies (Diptera: Syrphidae) to afforestation assessed using within-site tracking. Forestry, 2014, 87(2): 301-312.
[32] 赵紫华, 欧阳芳, 贺达汉. 农业景观中不同生境界面麦蚜天敌的边缘效应与溢出效应. 中国科学:生命科学, 2012. 42(10): 825-840.
[33] Macfadyen S, Muller W. Edges in Agricultural Landscapes: Species Interactions and Movement of Natural Enemies. PLoS One, 2013, 8(3): e59659.
Effects of returning farmland to forests on a ground-dwelling spider (Araneae)community
YAO Runzhi1, ZHOU Zaibao2, YAN Guozeng2,*, TIAN Zuobao3, WANG Shuo4, LI Kai1
1SchoolofNatureConservation,BeijingForestryUniversity,Beijing100083,China2BeijingMunicipalForestryProtectionStation,Beijing100029,China3ShunyiForestryProtectionStation,BeijingForestryBureau,Beijing101300,China4BeijingDadongliuNursery,Beijing102211,China
The spatial extent of plantation forests continued to increase after the Grain for Green Project (GGP) started in January 2002 in China, with more than 20 thousand km2forests developed from 1999 to 2008 throughout the entire country. From 2012 to 2014, the purpose of Beijing′s plain reforestation project was to increase the spatial extent of the forest area in the administrative sub-units that make up the city of Beijing with a plains habitat. In the GGP, one third of the farmland in this region has been replanted with trees to increase the extent of the green area and improve the environment. However, considerable controversy remains related to whether afforestation can effectively result in the conservation of biological diversity. The objective of this study is to explore the effects of afforestation on the ground-dwelling spider community and evaluate the effects of the GGP on the ecosystem and biodiversity during afforestation. From March to September 2014 and 2015, pitfall traps were used to collect ground-dwelling spiders every 10 days in habitats that had been returned to forests from farmland for 2 and 3 years, respectively, in Shunyi District, Beijing. Ground-dwelling spider communities were compared between two adjacent habitats, a former non-crop habitat and an afforested habitat. A total of 18 pitfall traps were placed in the same randomly selected pattern in both habitats. During the investigations, we collected a total of 1465 individuals from eight families, 18 genera and 32 species in 2014, and a total of 2186 individuals from 10 families, 25 genera and 45 species in 2015. Afforestation within the study sites had a positive effect on ground-dwelling spider diversity over the first 3 years. The species of ground-dwelling spiders present changed with afforestation; total species richness increased and some of the farmland spiders were not found in afforested habitats. In 2014, species richness and a diversity index of ground-dwelling spiders in former non-crop habitats were significantly higher than in afforested habitats (P<0.01). In 2015, the diversity index in former non-crop habitats was still significantly higher than in afforested habitats (P<0.01), while species richness in former non-crop habitats was significantly higher than in afforested habitats (P<0.05). An evenness index in the two habitats was not significantly different in both 2014 and 2015. In the second year after afforestation, the peak of the ground-dwelling spider activity density in former non-crop habitats occurred in mid-June, which was 1 month earlier than that in the afforested habitat. In the third year after afforestation, the ground-dwelling spider activity density exhibited similar trends in both habitats; that is, in both habitats the peak of activity density occurred at the same time in early July. The results show that in the first years of habitat alteration, the ground-dwelling spider community in the afforested habitat was still in a stage of community reconstruction, and the community′s stability increased year by year. Returning farmland to forests influenced the original farmland ecosystem through changes in the vegetation type, structure and management practices. As the forests mature, additional effects on spider species at the site are expected because of changes in light conditions, microclimate, vegetation and so on. Therefore, the effects of returning farmland to forests on the ground-dwelling spider community will need further study over time. The aim of this study is to determine whether afforestation contributed to enhancing biodiversity and conservation. Studying the process of change in biological communities after habitat alteration is of great theoretical significance.
activity density; community stability; ground-dwelling spider; pitfall trap; returning farmland to forests
北京市林业有害生物天敌新技术研究与应用(2016-HXFWBHQ-LK-01)
2016- 01- 06;
2016- 06- 12
10.5846/stxb201601060036
*通讯作者Corresponding author.E-mail: linbaozhankjk@126.com
姚润枝,周在豹,闫国增,田作宝,王朔,李凯.退耕还林对地面蜘蛛种群的影响.生态学报,2016,36(22):7393- 7400.
Yao R Z, Zhou Z B, Yan G Z, Tian Z B, Wang S, Li K.Effects of returning farmland to forests on a ground-dwelling spider (Araneae) community .Acta Ecologica Sinica,2016,36(22):7393- 7400.

