子宫腺肌病患者增生期及分泌期子宫结合带组织中GPR30、EGFR的表达观察
周俊杰,孔红霞,刘燕,陈雁南,杨立
(郑州大学第三附属医院,郑州450052)
子宫腺肌病患者增生期及分泌期子宫结合带组织中GPR30、EGFR的表达观察
周俊杰,孔红霞,刘燕,陈雁南,杨立
(郑州大学第三附属医院,郑州450052)
目的 观察子宫腺肌病患者增生期及分泌期子宫结合带(JZ)组织中G蛋白偶联受体30(GPR30)和表皮生长因子受体(EGFR) mRNA和蛋白的表达变化,并探讨其与子宫腺肌病发病的关系。方法 42例行子宫全切术或子宫次全切术的患者中,25例子宫腺肌病患者(病例组,14例留取增殖期组织、11例留取分泌期组织),17例宫颈病变或卵巢良性肿瘤患者(对照组,9例留取增殖期组织、8例留取分泌期组织)。获取两组JZ组织,采用实时荧光定量PCR法检测GPR30、EGFR mRNA,采用免疫组化二步法检测GPR30、EGFR蛋白。结果 对照组增生期JZ组织中GPR30、EGFR mRNA相对表达量及GPR30、EGFR蛋白阳性表达率均高于分泌期组织(P均<0.05);病例组增生期、分泌期JZ组织中GPR30、EGFR mRNA相对表达量及GPR30、EGFR蛋白阳性表达率差异均无统计学意义;病例组分泌期JZ组织中EGFR mRNA相对表达量、GPR30蛋白阳性表达率高于对照组(P均<0.05)。结论 子宫腺肌病患者增生期和分泌期JZ组织中GPR30、EGFR mRNA及蛋白表达差异无统计学意义,GPR30、EGFR mRNA及蛋白的无周期性规律表达可能与子宫腺肌病的发病有关。
子宫腺肌病;子宫结合带;G蛋白耦联受体30;表皮生长因子受体
子宫结合带(JZ)是由子宫基底层内膜和内1/3肌层构成的区域。子宫内膜和内膜下肌层是在物种进化中保守的结构功能单位,均为副中肾管起源,属于“古子宫”;与之对应的,内膜下肌层之外的非副中肾管起源的平滑肌层构成了“新子宫”。子宫腺肌病是子宫内膜向子宫肌层生长导致的,其发病机制尚未明确。研究[1]认为子宫腺肌病是“古子宫”全层结构或功能异常的疾病。子宫腺肌病作为激素依赖性疾病,其发生与雌激素调节紊乱有关。G蛋白偶联受体30(GPR30)作为功能性的膜受体参与雌激素的非基因组信号转导,可作为独立的雌激素膜受体在雌激素信号转导及细胞生长、增殖和凋亡中发挥重要作用。表皮生长因子受体(EGFR)是G蛋白、细胞因子受体和整合素等多种信号通路的交汇点,介导细胞的生长、增殖、分化、黏附等生命活动,在机体的发育过程中起重要作用[2]本研究观察了子宫腺肌病患者增生期及分泌期JZ组织中GPR30、EGFR mRNA和蛋白的表达变化,并探讨其与子宫腺肌病发病的关系,现报告如下。
1 资料与方法
1.1 临床资料 选择2015年6月~2016年2月在郑州大学第三附属医院行子宫全切术或子宫次全切术的患者42例,排除合并内异症、子宫内膜息肉及子宫肌瘤者,排除合并内分泌、免疫系统疾病和代谢性疾病者,术前3个月均未行激素类药物治疗。其中,25例子宫腺肌病患者(除外合并子宫肌瘤)为病例组,患者年龄35~52(44.7±0.8)岁,14例留取增殖期组织、11例留取分泌期组织;17例宫颈病变或卵巢良性肿瘤为对照组,患者年龄37~53(46.0±1.2)岁,9例留取增殖期组织、8例留取分泌期组织。两组患者均月经周期规律,一般资料具有可比性。本研究经本院伦理委员会批准。患者术前均签署知情同意书。
1.2 JZ组织取材方法 参考文献[3]方法将术中切下的子宫腔Y字形剖开,先轻轻刮取子宫内膜,在内膜基底层下5~8 mm内取材作为JZ层。取1 cm3的组织标本,分为两部分,一部分立即置入液氮罐中保存,用于实时荧光定量PCR检测;余下部分用甲醛常规固定,用于免疫组化染色。
1.3 JZ组织中GPR30、EGFR mRNA检测 将JZ组织剪碎,参照TRIzol法抽提RNA,经逆转录反应生成cDNA。引物序列由奥科鼎盛生物公司合成。GPR30 mRNA上游引物序列为5′-CCTCACGGGCCACATTGTCA-3′,下游引物序列为5′-ACTGCTCGGTGCTGTCTGGAAT-3′;EGFR mRNA上游引物序列为5′-GCCAAGGCACGAGTAACAAG-3′,下游引物序列为5′-AGGGCAATGAGGACATAACCA-3′;内参β-actin基因上游引物序列为5′-GCGGGAACTGCCTGACT-3′,下游引物序列为5′-CTCGTTGCCGATGGTGAT-3′。将生成的cDNA加入20 μL SYBR Green I实时荧光定量PCR的混合体系采用ABI7500荧光定量PCR仪进行扩增。参考文献[4]方法,以2-ΔΔCt表示目的基因相对表达量。
1.4 JZ组织中GPR30、EGFR蛋白检测 将JZ组织标本常规包埋、脱蜡和水化。分别加入GPR30抗体(1∶80)和EGFR抗体(1∶50)过夜。采用免疫组化二步反应法进行染色,以PBS代替一抗作阴性对照,高倍镜(400×)下观察染色结果。每张切片至少观察5个高倍镜视野,以细胞质和(或)细胞膜呈棕黄色或棕褐色为阳性细胞染色。按染色强度和阳性细胞百分比进行结果判定:无色计0分,轻度着色计1分,中度着色计2分,重度着色计3分;阳性细胞百分比<5%计0分,5%~<25%计1分,25%~<50%计2分,≥50%计3分;上述两项评分乘积>3为蛋白表达阳性,≤3为蛋白表达阴性。
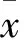
2 结果
2.1 两组增生期及分泌期JZ组织中GPR30、EGFR mRNA表达比较 对照组增生期JZ组织中GPR30、EGFR mRNA相对表达量高于分泌期组织(P均<0.05);病例组增生期、分泌期JZ组织中GPR30、EGFR mRNA相对表达量相比,P均>0.05;病例组分泌期JZ组织中EGFR mRNA相对表达量高于对照组(P<0.05)。详见表1。

表1 两组增生期及分泌期JZ组织中GPR30、EGFR mRNA相对表达量比较±s)
2.2 两组增生期及分泌期JZ组织中GPR30、EGFR蛋白表达比较 GPR30、EGFR蛋白在JZ组织中均有表达,GPR30主要定位于细胞膜、部分表达于细胞质,EGFR在细胞膜和细胞质中均有表达。病例组增生期、分泌期JZ组织中GPR30蛋白阳性表达分别为13、8例,EGFR蛋白阳性表达分别为12、10例;对照组增生期、分泌期JZ组织中GPR30蛋白阳性表达分别为7、1例,EGFR蛋白阳性表达分别为8、1例。对照组增生期JZ组织中GPR30、EGFR蛋白阳性表达率高于分泌期组织(P均<0.05);病例组增生期、分泌期JZ组织中GPR30、EGFR蛋白阳性表达率相比,P均>0.05;病例组分泌期JZ组织中GPR30蛋白阳性表达率高于对照组(P<0.05)。
3 讨论
子宫腺肌病是由于JZ缺少子宫内膜下层组织的保护作用,内膜直接侵入与之紧密相连的子宫肌层,使JZ组织排列紊乱,同时伴有子宫平滑肌细胞反应性增生所致。JZ结构及功能破坏是子宫腺肌病发病的病理生理基础。子宫腺肌病患者的JZ存在组织形态改变。MRI检查示JZ弥漫性增厚超过12 mm则高度怀疑子宫腺肌病。子宫腺肌病患者的JZ在MRI图像呈现弥漫性增厚的低信号强度区域,目前认为JZ增厚是平滑肌细胞过度增生引起[3]。1983年,Hricak等[5]首次借助MRI检查提出“古子宫”的概念。研究证实,子宫腺肌病存在“古子宫”全层结构或功能异常。JZ作为“古子宫”的一个重要区域,是子宫内膜层和肌层间的重要连接组织。与“新子宫”相比,JZ对局部雌激素变化非常敏感。
一直以来,人们对雌激素作用途径的研究主要集中在雌激素核受体通路上,认为雌二醇(E2)引起的转录应答完全由雌激素受体(ER)介导,即雌激素通过基因组效应,激活细胞内信号级联反应,引起细胞生物学改变(如影响细胞周期),从而导致细胞结构和功能改变。正常情况下,细胞在多种机制下短暂激活EGFR对丝裂原活化蛋白激酶(MAPK)途径,可以防止因磷酸化激活下游产物ERK-1/2;而通过去磷酸化下调ERK-1/2表达,持续激活EGFR-MAPK通路则可能导致细胞过度增殖甚至发生癌变[6]。
越来越多的研究显示,雌激素可通过结合雌激素膜受体GPR30快速激活细胞信号转导通路及下游效应分子[7],介导雌激素的快速非基因组效应[8,9]。GPR30基因位于染色体7p22,其mRNA全长为2 604 bp,编码含375个氨基酸的蛋白。GPR30是7次跨膜G蛋白耦联受体超家族的成员之一,其与传统雌激素受体没有同源性[10],参与信号转导的途径主要有磷脂酰肌醇-3激酶(PI3K)途径和MAPK途径[11]。GPR30通过促使肝素结合表皮生长因子,反向激活EGFR,介导下游的EGFR家族激活蛋白激酶或脂质激酶的级联反应,促进细胞增殖与分化,最终导致细胞功能变化[12]。GPR30还能单独介导雌激素激活EGFR,使ER阴性的乳腺癌细胞对雌激素敏感[13]。在多种雌激素依赖性疾病中,GPR30呈高表达并参与E2介导的雌激素效应,如刺激细胞增生、增强细胞迁移能力、调控细胞凋亡等[14,15]。
本研究选取育龄妇女的JZ组织作为研究对象,证实了GPR30和EGFR在JZ组织均有表达,且主要位于细胞质和(或)细胞膜中,这与GPR30作为雌激素细胞外信号转导受体的理论相吻合[12]。研究发现,在正常妇女子宫内膜中,GPR30在增生期内膜的表达水平高于分泌期内膜,呈周期性变化,推测这种变化与其介导的雌激素效应刺激子宫内膜增生有关[8]。而本研究病例组中GPR30 mRNA及蛋白的表达无明显周期性变化,呈持续高表达,这一变化可能与子宫腺肌病患者的JZ组织失去了雌激素的正常调控有关。GPR30在JZ组织中持续高水平表达可能使局部组织出现高雌激素状态。GPR30可能通过雌激素介导的快速非基因效应诱导JZ组织异常增殖和分化,导致JZ组织稳定性遭到破坏,促进子宫腺肌病的发生。本研究发现病例组分泌期JZ组织中EGFR mRNA表达较对照组增强,说明EGFR对子宫腺肌病的发病有重要作用。近年来研究发现雌激素能促进EGFR的合成,提高EGFR的感受性,使得与其受体结合后,通过其促有丝分裂作用而促进细胞生长与增殖。
本研究结果显示,子宫腺肌病患者增生期和分泌期JZ组织中GPR30、EGFR mRNA及蛋白表达差异无统计学意义,GPR30、EGFR mRNA及蛋白的无周期性规律表达可能与子宫腺肌病的发病有关。这为研究GPR30信号转导通路与子宫腺肌病的关系提供了依据。但由于本研究纳入样本量有限,上述结论和推测尚待进一步证实。
[1] 李晓川,郎景和.古子宫与子宫内膜异位症[J].中华妇产科杂志,2011,46(3):219-221.
[2] Hackel PO, Zwick E, Prenzel N, et al. Epidermal growth factor receptors: critical mediators of multiple receptor pathways[J] . Curr Opin Cell Biol, 1999,11(2):184-189.
[3] 王珺,张恒辉.雌激素受体-α在子宫腺肌病子宫内膜肌层交界区中的表达[J].中华妇产科杂志,2010,90(27):1914-1917.
[4] 刘晶晶,段华.一氧化氮在子宫腺肌病患者子宫内膜-肌层交界区平滑肌细胞中的表达及意义[J].中华妇产科杂志,2013,48(7):504-507.
[5] Hricak H, Alpers C, Crooks LE, et al. Magnetic resonance imaging of the female pelvis: initial experience[J]. AJR Am J Roentgenol, 1983,141(6):1119-1128.
[6] 徐学麟,林俊,江秀秀,等.GPR30在子宫平滑肌瘤细胞增殖中的作用研究[J].实用肿瘤杂志,2014,29(3):234-238.
[7] Pandey DP, Lappano R, Albanito L, et al. Estrogenic GPR30 signalling induces proliferation and migration of breast cancer cells through CTGF[J]. EMBO J, 2009,28(5):523-532.
[8] Mehasseb MK, Taylor AH, Pringle JH, et al. Enhanced invasion of stromal cells from adenomyosis in a three-dimensional coculture model is augmented by the presence of myocytes from affected uteri[J]. Fertil Steril, 2010,94(7):2547-2551.
[9] Filardo EJ, Quinn JA, Bland KI, et al. Estrogen-induced activation of Erk-1 and Erk-2 requires the G protein-coupled receptor homolog,GPR30,and occurs via trans-activation of the epidermal growth factor receptor through release of HB-EGF[J]. Mol Endocrinol, 2000,14(10):1649-1660.
[10] 陈淑玲,王庭槐.新型雌激素受体GPR30/GPER1及其在乳腺癌中的作用[J].生理科学进展,2012,43(1):75-80.
[11] Revankar CM, Cimino DF, Sklar LA, et al. A transmembrane intracellular estrogen receptor mediates rapid cells ignaling [J]. Science, 2005,307(5715):1625-1630.
[12] Prossnitz ER, Maggiolini M. Non-genomic signaling by steroids[J]. Mol Cell Endocrinol, 2009,308(1-2):1-2.
[13] Vassart G, Costagliola S. G protein-coupled receptors:mutations and endorine dieases[J].Nat Rev Endocrinol, 2011,7(6):362-372.
[14] Chevalier N, Vega A, Bouskine A, et al. GPR30,the Non-Classical Membrance G protein Related Estrogen Receptor, Is Overexpressed in Human Seminoma and Promotes Seminoma Cell Proliferation[J]. PLoS One, 2012,7(4):e34672.
[15] Ruan SQ, Wang SW, Wang ZH, et al. Regulation of HRG-betal-induced proliferation,migration and invasion of MCF-7 cells by upregulation of GPR30 expression[J]. Mol Med Report, 2012,6(1):131-138.
10.3969/j.issn.1002-266X.2016.47.029
R711.74
B
1002-266X(2016)47-0092-03
2016-07-18)

