不同海拔高原环境下生存的小鼠脾脏T淋巴细胞亚群变化
张晓娜,高世兰,胡方杰,李积东,蒲小燕,永胜
(青海大学医学院,西宁 810001)
不同海拔高原环境下生存的小鼠脾脏T淋巴细胞亚群变化
张晓娜,高世兰,胡方杰,李积东,蒲小燕,永胜
(青海大学医学院,西宁 810001)
目的 观察不同海拔高原环境下生存的小鼠脾脏T淋巴细胞亚群变化。 方法 分别在400 m、2 200 m和4 200 m的不同海拔条件下饲养小鼠30 d,用流式细胞术(FCM)检测小鼠脾脏T淋巴细胞亚群分布及其表面活化共刺激分子的变化。 结果 海拔4 200 m和海拔2 200 m低氧暴露30 d后,小鼠脾脏CD3+、CD4+、CD8+T淋巴细胞比例较对照组(海拔400 m)显著下降(P均<0.05),其中,CD4+T细胞数较CD8+T细胞数下降水平高;CD4+CD28+T细胞比例也明显减少(P<0.05),而CD8+CD28+T细胞比例无显著变化。此外,海拔4 200 m低氧组与海拔2 200 m低氧组相比,小鼠脾脏CD3+、CD4+、CD4+CD28+T细胞数均明显下降(P<0.05)。 结论 高原环境饲养可以导致小鼠脾脏CD4+和CD8+T淋巴细胞数量减少,CD4+T淋巴细胞活化水平显著降低。海拔越高作用越明显。
高原环境;T淋巴细胞;淋巴细胞亚群;白细胞分化抗原;脾
高原地区自然环境恶劣,大气压低、氧分压低、气候寒冷、辐射强,可以导致高原病,低氧是其中最重要的因素[1,2]。免疫系统是机体的防御屏障。研究表明,高原低氧环境可改变机体免疫功能[3],表现为T细胞成熟延缓,增殖被抑制,分泌细胞因子的能力也发生改变[4,5]。脾脏作为最大的外周免疫器官,不仅是成熟T、B淋巴细胞等免疫细胞定居的部位,也是产生特异性体液免疫和细胞免疫的场所[11]。目前高原低氧环境对脾脏T细胞亚群分布的影响尚不明确。2016年3~10月,我们观察了不同海拔高原低氧环境对小鼠脾脏T细胞亚群分布的影响。现报告如下。
1 材料与方法
1.1 材料 雄性BALB/c小鼠30只,4~6周龄,体质量20~25 g,购于西安交通大学医学院动物实验中心。红细胞裂解液(Solarbio,北京);PBS(Hyclone,美国);anti-Mouse CD3PE、anti-Mouse CD4FITC、anti-Mouse CD8PerCP、anti-Mouse CD28FITC、anti-Mouse CD28PerCP(Ebioscienc,美国)。生物安全柜(Thermo Scientific 1300 SERIES A2,美国);小型台式离心机(Eppendorf 5148R,德国);FCM(BD FACS Calibur,美国)。
1.2 小鼠分组及饲养 将小鼠随机分为A、B、C组,每组10只。A组小鼠饲养于青海省果洛州甘德县青珍乡(海拔4 200 m),B组饲养于青海大学基础医学研究中心(位于青海省西宁市,海拔2 200 m),C组大鼠饲养于西安交通大学医学院(位于陕西省西安市,海拔400 m)。三组小鼠饲养环境相同。均喂养30 d。
1.3 小鼠脾脏T淋巴细胞亚群检测 脱颈处死小鼠,用75%乙醇浸泡5 min,超净工作台内打开腹部左侧皮肤,小心分离皮下组织和腹壁肌肉,露出脾脏,提起,剪去周围结缔组织。脾脏放入含2 mL PBS的无菌培养皿中,剪成三段,无菌镊子夹碎,挤压脾脏。将获得的细胞悬液经200目尼龙网过滤加入无菌试管,1 500 r/min离心5 min,弃上清,加入适量红细胞裂解液裂解红细胞,混匀后静置5 min,待红细胞完全破碎,1 500 r/min离心5 min,弃上清,PBS洗1~2遍。最后用1 mL PBS重悬细胞,调整浓度为1.5×106/mL。 将细胞悬液与荧光单抗混合,分别制备阴性对照管和样品管,混匀后避光放置25 min,离心弃上清,用2 mL PBS洗两遍,最后用500 μL PBS重新悬浮。用文献[12,13]中的方法行流式细胞术检测CD3+、CD4+、CD8+、CD4+CD28+、CD8+CD28+T细胞比例及CD4+/CD8+。
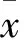
2 结果
饲养30 d时三组小鼠脾脏T淋巴细胞亚群分布见表1。饲养30 d时,与C组相比,A、B组小鼠脾脏CD3+、CD4+、CD8+、CD4+CD28+T细胞比例低(P均<0.05);与B组相比,A组小鼠上述指标低(P均<0.05);三组CD8+CD28+T细胞比例和CD4+/CD8+相比,P>0.05。

表1 饲养30 d时三组小鼠脾脏T淋巴细胞亚群比较±s)
注:与C组相比,*P<0.05;与B组相比,△P<0.05。
3 讨论
高原地区自然环境恶劣,大气压低、氧分压低、寒冷、辐射强等因素容易引起高原病,低氧为其最主要的特征。低氧不仅能改变机体的一系列生理机能,同时也是许多疾病,如休克、癌症、免疫性疾病等发生发展过程中的病理环节之一[1]。人在快速进入3 000 m以上高原后由于缺氧会发生急性高原反应,严重者可能发展为高原肺水肿和高原脑水肿[2],甚至危及生命。
免疫系统是机体的防御屏障。研究表明,高原低氧可使机体免疫功能发生改变[3]。Caldwell等[4]将小鼠脾脏淋巴细胞置于2.5%低氧环境中培养时,发现T细胞成熟延缓,其分泌细胞因子的能力也发生改变。在研究肿瘤免疫时发现,肿瘤无氧区的T淋巴细胞浸润数量虽然没有明显变化,其功能却显著下降[5]。低氧和寒冷均可在一定程度上抑制大鼠脾脏T细胞的增殖[6]。急性高原肺水肿患者外周血中血浆肿瘤坏死因子α(TNF-α)、IL-6、VEGF、内皮素-1(ET-1)、免疫球蛋及中性粒细胞比例明显增高[7,8]。Phan等[9]研究发现低氧可导致T细胞增殖能力下降且细胞周期延迟。多数研究认为,低氧对血浆免疫球蛋白影响不大,因而B淋巴细胞功能不受明显影响[10]。
脾脏作为最大的外周免疫器官,不仅是成熟T、B淋巴细胞等免疫细胞定居的部位,也是产生特异性体液免疫和细胞免疫的场所[11]。在脾脏的免疫反应中,T细胞是最重要的免疫细胞之一,在机体的免疫应答中处于核心地位,在固有免疫、获得性免疫、移植免疫、自身免疫性疾病的发病、肿瘤免疫及超敏反应中都发挥着重要作用。T淋巴细胞在淋巴细胞中占相当比例,根据其功能特征和表面标志,可分为CD4+和CD8+两个亚群。CD4+T细胞主要分化为Th1、Th2和Th17三类效应细胞,分别分泌不同的细胞因子,发挥不同的免疫效应[14]。CD8+T细胞为细胞毒性T(CTL)细胞,是机体抗肿瘤效应中起关键作用的效应细胞[15]。它能释放多种细胞因子和酶,如IL-6、穿孔素、溶细胞素等、通过溶细胞作用直接杀伤肿瘤细胞。本研究结果显示海拔2 200 m和海拔4 200 m高原低氧暴露30 d后,小鼠脾脏CD3+、CD4+、CD8+T细胞数均显著减少,其中,CD4+T细胞数较CD8+T细胞数下降水平高,整体下降趋势与大鼠实验基本相同[16]。提示高原低氧暴露可导致小鼠的细胞免疫功能降低。T细胞完全活化需要两个信号:第一信号由T细胞抗原受体和MHC/抗原肽结合提供,第二信号则由协同刺激受体与配体相互结合所介导。T细胞表面存在许多重要的共刺激分子,能够介导T细胞的增殖、活化以及效应功能的发挥。其中,CD28分子与抗原提呈细胞(APC)表面B7分子间相互作用是诱导T细胞活化的重要辅助信号[17]。根据是否表达CD28分子,可将T 细胞分为CD4+CD28+、CD8+CD28+、CD4+CD28-、CD8+CD28-共4个亚群。CD4+CD28+T细胞包括大多数辅助性T 细胞,CD8+CD28+T细胞为效应性杀伤(又称细胞毒性)T细胞。本研究结果显示,海拔2 200 m和海拔4 200 m高原低氧暴露30 d后,小鼠脾脏CD4+CD28+细胞数明显降低,而CD8+CD28+细胞数无明显变化,提示高原低氧暴露使小鼠脾脏CD4+T细胞活化水平降低,而CD8+T细胞活化水平无明显变化,这也可能是由于低氧暴露过程中先降低后增加而恢复所致[12]。低氧条件下,小鼠脾脏T淋巴细胞亚群的改变可能与低氧暴露后糖皮质激素、促肾上腺皮质激素以及前炎症因子显著增加有关[18,19]。
[1] Semenza GL, Agani F, Feldser D, et al. Hypoxia,HIF-1 and the pathophysiology of common human diseases[J]. Adv Exp Med Biol, 2000,475(2):123-130.
[2] Shukla D, Saxena S, Purushothaman J, et al. Hypoxic preconditioning with cobalt ameliorates hypobaric hypoxia induced pulmonary edema in rat[J]. Eur J Pharmacol, 2011,656(1-3):101-109.
[3] Mishra KP,Ganju L.Influence of high altitude exposure on the immune system[J].Immunol Invest,2010,39(3):219-234.
[4] Caldwell CC, Kojima H, Lukashev D,et al. Differential effects of physiologically relevant hypoxic conditions on T lymphocyte development and effector functions [J]. J Immunol, 2001,167(11):6140-6149.
[5] Loeffler DA, Keng PC, Baggs RB, et al. Lymphocytic infilteation and cytotoxicity under hypoxic conditions in the EMT6 mouse mammary tumor [J]. Int J Cancer, 1990,45(3):462-467.
[6] 黄庆愿,黄缄,蔡明春,等.寒冷缺氧降低大鼠脾脏T淋巴细胞的增殖反应[J].局解手术学杂志,2007,16(5):305-307.
[7] 师鹏,陈洁,陈露.急性高原肺水肿血浆TNFα、IL-6、ET-1的变化及临床意义[J].西藏科技,2004,24(4):40.
[8] 冉玉华,张东祥,汪海,等.急性高原肺水肿患者血清中VEGF,TNF-α,IL-6及NO的含量变化[J].中国应用生理学杂志,2011,34(2):201-203.
[9] Phan AT, Goldrath AW. Hypoxia-inducible factors regulate T cell metabolism and function[J]. Mol Immunol, 2015,68(2):527-535.
[10] Facco M, Zilli C,Siviero M,et al.Modulation of immune response by the acute and chronic exposure to high altitude[J].Med Sci Sports Exep, 2005,37(5):768-774.
[11] 郑国强,刘安军,滕安国,等.雌雄小鼠胸腺和脾脏的免疫比较[J].安徽农业科学,201l,39(16):9743-9745.
[12] 田云梅,聂鸿靖,刘嘉瀛,等.低氧暴露对大鼠外周血T淋巴细胞活化的影响[J].中国应用生理学杂志,2011,34(2):145-148.
[13] Sun Y, Lin G, Zhang R, et al. Multicolor flow cytometry analysis of the proliferations of T-lymphocyte subsets in vitro by EdU incorporation[J]. Cytometry A, 2012,81(10):901-909.
[14] Harrington LE, Mangan PR, Weaver CT. Expanding the effector CD4 T-cell repertoire:the Th17 lineage[J]. Curr Opin Immunol, 2006,18(3):349-356.
[15] Li C, Li W, Xiao J, et al. ADAP and SKAP55 deficiency suppresses PD-1 expression in CD8+cytotoxic T lymphocytes for enhanced anti-tumor immunotherapy[J]. EMBO Mol Med, 2015,7(6):754-769.
[16] 田云梅,聂鸿靖,刘嘉瀛,等.高原低氧免疫损伤及其干预措施的研究[J].中国应用生理学杂志,2010,33(4):404-410.
[17] Porciello N,Tuosto L. CD28 costimulatory signals in T lymphocyte activation:Emerging functions beyond a qualitative and quantitative support to TCR signalling[J]. Cytokine Growth Factor Rev, 2016,28(8):11-19.
[18] Kaur C, Singh J, Peng CM, et al. Upregulation of adrenocorticotrophic hormone in the corticotrophs and downregulation of surface receptors and antigens on the macrophages in the adenohypophysis following an exposure to high altitude[J]. Neurosci Lett,2002,318(3):125-128.
[19] Kubo K, Hanaoka M, Hayano T, et al. Inflammatory cytokines in BAL fluid and pulmonary hemodynamics in high altitude pulmonary edema[J].Respir Physiol, 1998,111(3):301-310.
10.3969/j.issn.1002-266X.2016.47.010
R392
A
1002-266X(2016)47-0036-03
2016-06-11)

