采用血液、羽毛等材料鉴别鸡性别PCR方法的应用研究*
孙嘉,杨树青,孙珂,党斌,鞠孜敬,孙淑红**
(1.山东农业大学,山东 泰安 271018;2.济南赛斯家禽科技有限公司,山东 济南 250000)
采用血液、羽毛等材料鉴别鸡性别PCR方法的应用研究*
孙嘉1,杨树青1,孙珂2,党斌2,鞠孜敬1,孙淑红1**
(1.山东农业大学,山东 泰安 271018;2.济南赛斯家禽科技有限公司,山东 济南 250000)
公母鸡染色体上的染色体螺旋蛋白基因(chromobox-he-licase-DNA binding gene,CHD 1基因)的内含子基因序列存在差异,通过PCR方法可扩增该基因内含子的保守序列,可对鸡等非平胸禽类的性别进行鉴定。本研究首先采集42只28日龄肉鸡抗凝血,完成血液DNA PCR鉴定性别,结果表明,42只商品肉鸡中22只公鸡、20只母鸡,与剖检结果相同;其次,采集20只90日龄SPF鸡(13只公鸡、7只母鸡)和15只2日龄SPF鸡的抗凝血和羽毛,完成其DNA的 PCR鉴定以及与微量血的PCR检测结果的比较。结果表明,90日龄、2日龄SPF鸡的微量血PCR与抗凝血、羽毛提取DNA的PCR鉴定结果均相同,其中,90日龄SPF鸡与其外观性别完全吻合;另外,采集12枚15日龄鸡胚的尿囊液、羽毛、肌肉,提取DNA后PCR方法可扩增出区分性别的特异性条带,鉴定结果一致,12枚15日龄鸡胚中均为7个雄性、5个雌性。本研究表明,微量血PCR和血液、羽毛等材料提取DNA后的 PCR方法均可准确快速鉴定鸡和鸡胚的性别,可作为家禽育种过程中常规鉴定方法的有力补充,适合大型养殖场规模化鉴定,也满足科研领域区分鸡和鸡胚性别的需求。
鸡;血液;羽毛;性别鉴定
鸡在我国畜牧饲养业中占据很大比重,而且它是进行科学研究的主要模型动物之一,在科学研究领域也占据重要地位。饲养繁育过程中,根据不同的生产需求,需要对鸡的性别进行区分。为使原有品种的主要生产性能能够整齐、稳定、规格化的提高,或者为了获得优良性状稳定的新品种,需要进行育种工作。育种过程中,由于雌雄个体的发育差异,对营养的需求有所不同,要求在早期就区分出雌雄个体,以便于分群饲养,不同品种的鸡在进行育种时,也需要合适的雌雄比例。PCR方法对鸡进行性别鉴定,生产上可作为传统鉴别方法的一种补充方法,在新品种的繁育上起到重要作用;科研方面,可满足形态学、内分泌学、遗传学等学科在早期区分性别的需求。
1 材料方法
1.1 主要仪器及试剂 DNA提取试剂盒购自天根生化科技有限公司,2×Taq Master Mix(含Taq DNA Polymerase,dNTP,优化的缓冲体系)购自诺唯赞生物科技有限公司,性别鉴定引物由铂尚生物科技有限公司合成,其它试剂均为国产分析纯。
1.2 试验动物 12枚SPF胚、15只2日龄SPF鸡、90日龄SPF鸡20只 (13只公鸡、7只母鸡),均购自济南赛斯家禽科技有限公司;28日龄商品肉鸡42只。
1.3 材料采集 SPF鸡胚孵化至15日龄,4℃放置10h冻死鸡胚,吸取尿囊液并采集胚体羽毛和腿部肌肉;心脏采血法采取2日龄雏鸡血液,翅根静脉采取28日龄商品肉鸡和90日龄SPF鸡血液,采取血液均为100μl/ml肝素抗凝血(肝素:血液=1:4);采集鸡翅膀或尾部羽毛囊内容物较多的羽毛。
1.4 材料中鸡基因组DNA的提取与PCR的扩增 本研究通过鸡ZW染色体上CHD 1基因内含子大小的差异,针对以羽毛等基因组DNA PCR扩增鉴定鸡性别的方法选取一对引物SF/SR[1],引物序列为:

另外,针对直接以鸡微量血液为模板进行PCR扩增选取另一对引物2550F/2718R[2],引物序列为:

1.4.1 材料中基因组DNA的提取 按照DNA提取试剂盒说明书,提取肝素抗凝血、尿囊液的基因组DNA;采用传统的苯酚氯方法提取肌肉组织和羽毛的DNA。羽毛含有大量的角质蛋白,苯酚氯仿法提取羽毛DNA时,取羽毛根部中空部位,剪成1cm长度小段,放入2ml离心管中,加入700μl组织抽提液、15μl胰蛋白酶 K,55~60℃消化8h。抽提 DNA时,Tris平衡酚和氯仿的用量加大至350μl。若经12000rpm离心10min,上清层和蛋白质层难以分离,可将上清层和蛋白质层一同吸出,用Tris平衡酚和氯仿进行第二次抽提。
1.4.2 基因组DNA的PCR扩增 PCR反应体系为 25μl:2×Taq Master Mix 12.5μl,上、下游引物(25μmol/ml)各1μl,基因组DNA 1μl。PCR反应程序:94℃预变性 5min;94℃变性 40s,55℃退火30s,72℃延伸 40s, 进行 30个循环;72℃延伸7min。PCR产物经1.5%琼脂糖凝胶电泳后,在紫外凝胶成像仪读取结果。
1.4.3 微量全血的PCR扩增 PCR反应体系25 μl:2×Taq Master Mix 12.5μl,ddH2O 9.9μl,上、下游引物(25μmol/ml)各1μl,抗凝血0.1μl。
根据文献报道[3],采用该PCR反应程序:在PCR反应管中加入上述PCR 反应体系中各物品,95℃ 3min,55℃ 3min,4个循环使红细胞模板的细胞膜变性裂解,释放出细胞核内的DNA。变性结束后,按如下程序进行PCR扩增反应:94℃预变性5min;93℃变性 40s,52℃退火 30s,72℃延伸 40s,进行35个循环;72℃延伸7min。PCR产物经1.5%琼脂糖凝胶电泳后,在紫外凝胶成像仪读取结果。
2 结果
2.1 90日龄SPF鸡血液DNA和羽毛DNA性别鉴定 通过PCR方法扩增鸡的血液和羽毛的基因组DNA,电泳结果见图1。20只90日龄SPF鸡(13只公鸡,7只母鸡)的PCR鉴定结果与表观性别吻合。

图1 90日龄SPF鸡血液DNA、羽毛DNA PCR扩增结果
2.2 28日龄商品肉鸡的性别鉴定 血液DNA为模板,PCR鉴定结果表明,42只28日龄商品肉鸡中有22只为公鸡,20只为母鸡,结果与剖检结果完全吻合,部分电泳结果见图2。

图2 商品肉鸡血液DNA PCR电泳结果
2.3 2日龄雏鸡的性别鉴定 以2日龄雏鸡的血液DNA和羽毛DNA为模板进行PCR扩增,电泳后出现区分性别的特异性条带,电泳结果见图3。结果显示,15只雏鸡中9只为公鸡,6只为母鸡。
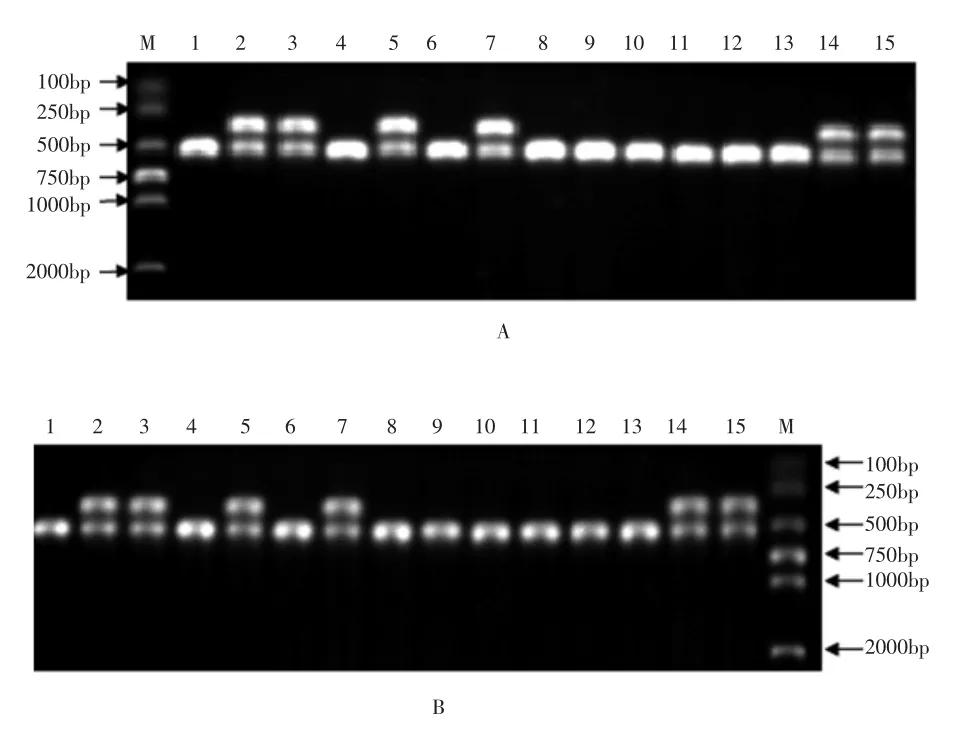
图3 雏鸡血液DNA和羽毛DNA PCR电泳结果
2.4 15日龄鸡胚的性别鉴定 以尿囊液、胚羽、腿肌的基因组DNA为模板进行PCR扩增,电泳后出现目的条带,同一鸡胚尿囊液、胚羽、腿肌提取的基因组DNA PCR扩增结果一致。部分电泳结果见图4。

图4 鸡胚各材料DNA PCR电泳结果
2.5 微量血方法 以微量血为模板进行性别鉴定,2日龄SPF鸡的微量血鉴定结果与血液DNA、羽毛DNA的鉴定结果一致,90日龄SPF鸡的微量血鉴定结果与鸡的性别一致。电泳结果见图5。
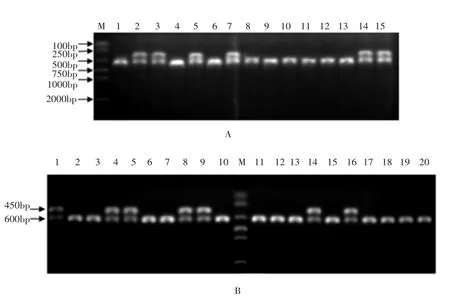
图5 微量血PCR扩增电泳结果
3 讨论
鸡性别由ZW染色体决定(雄性为ZZ,雌性为ZW),对性染色体上的CHD1、ATP5A1、EE0.6等特异性基因序列进行PCR扩增,任意一特异性基因序列的扩增产物都能够鉴定鸡的性别,其中CHD1基因在平胸鸟类的性别领域应用最为广泛,其扩增方法简单,扩增的片段本身就可作为对照,避免假阴性或假阳性结果。染色体螺旋蛋白基因(chromobox-he-licase-DNA bingding gene,CHD 1基因)是性染色体上编码调节整个染色体水平上转录活性蛋白的一个功能性基因[4],其在非平胸鸟类中存在两个同源拷贝基因,分别是与Z染色体连锁的CHD1-Z和与W染色体连锁的CHD1-W。1995年,Griffiths等[4]首次发现CHD1基因,并针对CHD1基因上的保守序列设计了一对引物(P2/ P3),展开了鸟类性别的分子鉴定工作。在非平胸鸟类的性别鉴定研究中,很多学者[5-10]采取粪便、羽毛等材料进行鸟类的性别鉴定工作,成功鉴定出了多种野生鸟类和来亨鸡的性别。Jensen等[11]利用卵壳膜提取基因组DNA,通过扩增CHD基因上的保守基因片段成功鉴定出鸟类的性别,李振刚等[12]对鸡胚血管的分布情况和形态制定了雄性鸡胚的标准血线判定方法。
目前,鸡一般是通过体貌特征和行为方式[13]、荷尔蒙水平测定[14]和腹腔剖检[15]等办法进行性别鉴定,但是这些方法存在一定的局限性。采用翻肛法对鸡进行性别鉴定,其成本低廉,鉴定速度较快,准确率可达95%以上,可应用于生产上鸡的大批量鉴定,但频繁的接触雏鸡会引起多种疾病的横向传播,并且翻出肛门会造成一定的机械损伤,也要求鉴定性别的工作人员积累充足的经验,该方法存在一定的局限性。翻肛法适用于生产上鸡的性别鉴定,其95%的准确率无法满足科研领域区分性别的需求。
随着对鸟类性别鉴定的不断研究以及分子生物学技术的不断发展,PCR扩增技术成为鉴定鸡性别的一种比较理想的方法。应用非伤害性取样法抽取血液、采集羽毛等材料,在不触及或损伤鸡的情况下采集材料,对鸡的应激小,结合普通PCR操作简便、周期短的特点,可对大量材料同时进行检测,即适用于小群育种时性别的鉴定,也可满足科研对鉴定准确率的要求。
根据CHD1基因的内含子基因序列在Z、W染色体上大小的差异,利用内含子两侧的保守序列设计特异性引物,用该引物进行PCR扩增后,雌性会出现450bp、600bp的两条带,雄性只会出现600bp大小的一条带,电泳后仅根据条带的数目就可判断鸡的雌雄。
本研究对鸡胚和不同日龄的鸡进行性别鉴定,采集鸡的羽毛、血液、肌肉以及鸡胚的尿囊液、胚体羽毛、肌肉组织,提取基因组DNA,PCR扩增后电泳均出现鉴别雌雄的特异性目的条带。同一鸡或鸡胚不同材料的基因组DNA经PCR方法鉴定性别的结果一致。另外,同一只鸡微量血PCR的鉴定结果与基因组DNA的PCR鉴定结果相同。在应用PCR方法鉴定鸡的性别时,鸡的羽毛、血液、肌肉均可作为雌雄鉴别的材料,尿囊液、胚体羽毛、肌肉组织可用于鸡胚的雌雄鉴别。
新生雏鸡的翅静脉和颈静脉细小,采血困难。通过心脏采血法可以采集到足够的雏鸡血液,但该采血方法对新生雏鸡的伤害极大,易致雏鸡死亡。羽毛的再生能力强,并且可通过非伤害性采样获得,对鸡的应激和伤害小,在应用PCR方法鉴定新生雏鸡的性别时,羽毛是最理想的材料。通过测定尿囊液中雌激素水平也可区分16~18日龄鸡胚的雌雄,但PCR方法鉴定性别可将鉴定时间提早至5~6胚龄。12.5日龄鸡胚的尿囊液中含有少量脱落的胚胎细胞,200μl尿囊液可提取足够的基因组DNA,避开血管及胚体抽取尿囊液后用石蜡封口仍可孵化出壳。PCR方法鉴定雏鸡和鸡胚的性别,灵敏准确,样品用量少且提取的DNA不需要纯化,适合在大型养鸡场进行规模化鉴定[16]。
[1]刘宏祥,姬改革,胡艳,等.基于性染色体CHD基因序列差异鉴定鸡的性别[J].中国家禽,2013,35(23):7-10.
[2]Fridolfsson A.K.,Ellegren H.Journal of Avian Biology [J].Journal of Avian Biology,1999,30:116-121.
[3]李智利,秦清明,施振旦,等.微量全血 PCR技术鉴定雏鸡及鸡胚性别[J].中国畜牧兽医,2012,39(9): 74-78.
[4]Griffiths R.,Tiwari B.Sex of the last wild Spix's macaw[J].Nature,1995,375(6531):454.
[5]Rebertson B.C.,Minot E.O.,Lambert D.M.Molecular sexing individual kakapo (Strigops habroptilus) Aves,from faeces[J].Molecular Ecology,1999,8: 1349-1350.
[6]Nota Y.,Takenaka O.DNA extraction from urine and sex identification ofbirds [J].Molecular Ecology, 1999,8:1235-1238.
[7]Trefil P.,Bruno M.M.,Mikus T.,et al.Sexing of chicken feather follicle, blastodermal and blood cells[J]. Folia Biologica Prague,1999,45(6):253-256.
[8]Bello N.,Francino O.,Sanchez A.Isolation of genomic DNA from feathers [J].J Vet Diagnost Invest,2001, 13(2):162-164.
[9]Horvath M.B.,Martinez-Cruz B.,Negro J.J.,et al.An overlooked DNA Source fornon-invasive genetic analysis in birds[J].J Avian Biol,2005,36(1): 84-88.
[10]胡飞,张红霞,包文献,等.黑冠鹤性别的分子鉴定方法[J].中国畜牧兽医,2008,34(11):61-63.
[11]Jensen T.,Pernasetti F.M.,Durrant B.Conditions for rapid sex determination in 47 avian speciesby PCR ofgenomic DNA from blood,shellmembrane blood vessels,and feathers [J].Zoo Biology,2003,22(6):561-571.
[12]李振刚,王涛宽,李瑞仁,等.鸡胚蛋血线方向与性别关系的统计研究[J].天津师大学学报:自然科学版,2000,20(5):36-39.
[13]Gray C.M.,Hamer K.C.2001.Food-provisioning behavior of male and female Manx shearwaters,Puffinus puffinus[J].Animal Behaviour,62(1):117-121.
[14]Bercovitz A.B.,Czekala N.M.,Lasley B.L.1978,A new meth-od ofsex determination in monomorphic birds[J].The journal of Zoo Animal medicine,9(4): 114-124.
[15]Maron J.L.,Myers J.P.1984.A description and evaluation of two techniques for sexing wintering sanderlings[J].journal of Field Ornithology,55(3): 336-342.
[16]林金杏.鸡和鸡胚性别鉴定技术的研究概况[A].中国黄羽肉鸡行业发展大会会刊[C],2008:141-144.
Sex Identification of Chicken with Blood,Feathers and Other Materials by PCR
SUN Jia1,YANG Shu-qing1,SUN Ke2,DANG Bin2,JU Zi-jing1,SUN Shu-hong1
(1.Shanong Agricultural University,Shandong Tai'an 271018,China; 2.Jinan SAIS Poultry Co.,Ltd,Shandong Ji'nan 250000,China)
The intron gene sequence of CHD1 gene(chromobox-he-licase-DNA binding gene) was different between the chromosomes of hens and roosters.PCR(Polymerase Chain Reaction)was used to amplified the conserved sequence of the intron gene sequence in order to identified the sex of non-ratite birds such as chickens. First of all,we collected 42 anticoagulant blood samples of 28-day-old broilers,extracted DNA from the blood and used PCR to indentify the sex.Theresultsshowed that therewere22 roosters and 20 hens,thesameasthenecropsy result. Secondly,we collected anticoagulant blood and feathers samples of 20 90-day-old SPF chickens(13 roosters,7 hens)and 15 2-day-old SPF chickens,DNA was extracted and was used in PCR. Meanwhile,PCR amplification were taken on microscale blood samples and the result were identical to the PCR(with DNA)result.Among the result,all the 90-day-old SPF chickens' sex were identical to their appearance sex. Thirdly, we collected feathers, muscles and allantoic fluid samples of 12 15-day-old chicken embrysos and then extracted DNA. sexspecific bands were amplified by PCR and the result showed that there were 7 male embrysos and 5 female embrysos.In conclusion,both PCR with microscale blood samples and PCR with DNA extracted from blood and feathers could quickly and accurately identify the sex of embrysosand chickens. Itcould be a strong complementto conventionalmethodsofsex identification among poultry breeding process.
chicken;blood;feather;identified the sex
S814.7
B
1673-1085(2016)07-0011-05
2016-06-11
山东省科技发展计划。
孙嘉(1990-),男,执业兽医师,硕士研究生,主要从事禽病学研究,E-mail:416211484@qq.com。
**通讯作者。

