一种评估肱动脉内皮功能的电阻抗信号检测与分析系统
李思琦,申华,2,朱勇,梁舜,覃开蓉
1.大连理工大学 电信学部生物医学工程系,辽宁 大连 116024;2.大连东软信息学院 电子工程系,辽宁 大连 116023
一种评估肱动脉内皮功能的电阻抗信号检测与分析系统
李思琦1,申华1,2,朱勇1,梁舜1,覃开蓉1
1.大连理工大学 电信学部生物医学工程系,辽宁 大连 116024;2.大连东软信息学院 电子工程系,辽宁 大连 116023
动脉内皮功能受损或者功能障碍是动脉硬化早期的主要表现。定量评估肱动脉内皮功能有助于及时发现心血管功能异常,从而为心脑血管疾病的早期诊断和治疗提供一定的依据。目前临床上主要采用彩色超声多普勒技术检测肱动脉血流介导扩张(FMD)来评估肱动脉内皮功能。虽然这种检测方法精确度与分辨率更高,但设备相对昂贵,操作复杂。本文提出一种基于前臂电阻抗信号的肱动脉内皮功能检测与分析系统。该系统通过检测FMD实施前后前臂的生物电阻抗信号,并运用小波分析技术对前臂生物电阻抗信号的特征参数进行分析计算,包括特征频率、绝对能量、平均幅值,以及FMD实施前后这些特征量的相对变化率。由于FMD实施前后前臂电阻抗信号的变化主要由前臂动脉管径的变化引起,因此,本文提出的前臂电阻抗信号检测与分析系统为定量评估肱动脉内皮功能提供了一种新思路。与目前临床上使用的内皮功能检测方法相比,本文提出的电阻抗信号检测与分析系统具有操作简单、经济实用、快速便捷的特点,不仅能用于家庭或社区医疗的监测,并且可以实现在线检测,为进一步研制智能可穿戴电阻抗动脉功能监测仪器提供了一定的方法学基础。
肱动脉内皮功能;生物电阻抗信号;小波分析;特征频率;绝对能量;平均幅值
1 研究背景
近年来,因心脑血管疾病发病和死亡人数急剧增多,治疗费用也急剧增加,给患者家庭和社会带来了沉重的负担。动脉硬化作为一种全身性的病理变化过程,会直接导致重要脏器的损坏,已成为心脑血管疾病的独立危险因子之一[1-6]。动脉内皮功能受损或者功能障碍是动脉硬化早期的主要表现[7]。
动脉内皮作为血管流动和血管壁之间的功能性屏障,不仅维持血管结构的完整,还在调节血管细胞生长、调节抗凝及纤溶系统、介导炎症与免疫、调节白细胞与血小板在血管内皮粘附、调节脂质氧化、调节血管通透性等方面扮演十分重要的角色[7-9]。如果动脉内皮功能受损或者功能障碍,血液中的脂肪会进入血管壁,与中膜的平滑肌细胞相互作用,最终在动脉壁形成动脉粥样硬化斑块[10]。因此,正确评价动脉内皮功能、及时发现动脉内皮功能异常,对于心脑血管疾病的早期预警起着至关重要的作用[11-12]。
肱动脉不仅是测量血压的部位,也是检测全身动脉功能的一个重要“窗口”。Celermajer等[13]使用超声多普勒技术无创伤检测肱动脉血流介导性扩张(Flow-Mediated Dilation,FMD)引起的动脉管径扩张率评估动脉内皮功能。随后的一系列研究[11,14]表明通过FMD评估的肱动脉内皮功能与心脏冠状动脉的功能紧密相关。目前,利用高空间分辨率的超声多普勒技术测量肱动脉FMD评估内皮功能被美国心脏学会认为是一项“有前途的技术”,已成为临床诊断的“金标准”[8]。然而,用该方法检测动脉管径的变化需要对动脉管径进行精确定位,不仅操作程序烦琐、耗时,而且相关的仪器设备笨重、价格昂贵,不便于推广到社区或者家庭简单使用。
生物电阻抗(Electrical Bio-Impedance,EBI)技术[15]是利用生物组织与器官的电特性及其变化规律提取与人体生理、病理状况相关的生物医学信息的检测技术,基本测量方式是在体外(表)向检测对象施加安全的电磁激励(电流、电压、电磁场),在体外(表)检测相应电阻抗的变化获取相关的信息。其特点是无创、无害,廉价、操作简单和功能信息丰富,尽管精度较低,但易于被受试者接受。本文利用生物电阻抗技术测量肱动脉FMD实施前后前臂生物电阻抗信号,对检测的生物电阻抗信号进行小波分析,提出了一种能够分析肱动脉内皮功能的简便方法。基于该方法,设计出一种具有操作简单、价格低廉等优点的动脉内皮功能的电阻抗信号检测分析装置。
2 原理与方法
用气袖无创伤阻断肱动脉血流3~5 min后释放,将引起下游前臂动脉的血流动力学环境特别是作用于动脉内皮的壁面剪应力发生改变,改变的剪应力将诱发前臂动脉内皮释放血管舒张因子一氧化氮(NO),进一步引起前臂动脉的管径发生改变,这一过程称为FMD。在该过程中前臂动脉管径的变化引起前臂动脉的总电阻抗发生改变。通过检测静息状态和FMD实施后电阻抗信号的变化情况可以反映FMD引起的动脉管径变化,从而达到间接评估动脉内皮功能的目的。
前臂可看成一个电导体,其电阻抗由前臂内所有动脉、静脉、皮肤、肌肉、骨骼和其他组织的电导特性共同决定。由于FMD过程中只有动脉血流的电阻抗特性才发生明显变化,因此所测量的前臂电阻抗的改变就是前臂动脉段电阻抗的改变。将前臂内的动脉等效于一个纵向长度L不变的圆筒形腔室,其半径R则在动脉正常搏动和FMD实施过程中发生改变(图1),该动脉段的电阻抗Za表达为

式中,σ为血液电导率。
假定除动脉外的组织和器官总阻抗为常量Zp,则前臂总电阻抗Z为Zp和Za的并联,表示为

进一步假定外围组织和器官的阻抗Zp在FMD实施前后保持不变,则对公式(2)两边微分可得到
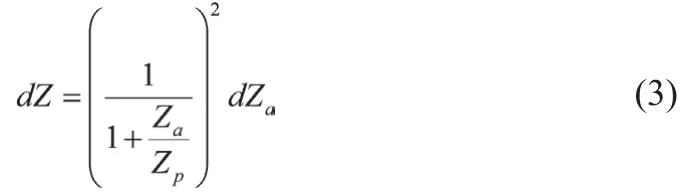
由于Zp>>Za,可近似为

即,前臂电阻抗Z的改变就是前臂内动脉电阻抗Za的改变。另外,从公式(1)可以看出,前臂动脉电阻抗Za的变化主要取决于动脉内半径R的变化。

图1 前臂动脉的等效圆筒模型
假定静息状态的前臂电阻抗信号为Z0(t),FMD实施后的前臂电阻抗信号为ZF(t),选择Morlet母小波对连续的电阻抗波形Z0(t)和ZF(t)进行小波分析,可得到具有五个特征峰的频谱图,频率区间为0.01~5.0 Hz,每个特征峰对应不同的频率区间,反映了五种不同的生理活动[16-17]。其中,频率区间0.01~0.1 Hz对应动脉内皮的生理活动[16-17],计算频谱图中该频率区间的特征频率fc,绝对能量Ec,平均幅值Ac。分别表达如下[18]
(1)特征频率fc

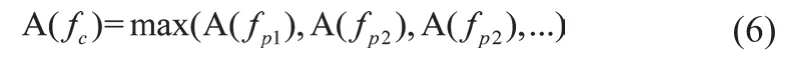
则fc为频率区间[fc1,fc2]内的特征频率。
(2)绝对能量Ec

(3)平均幅值Ac
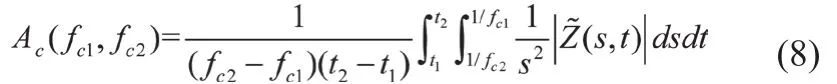
其中,Ec(fc1,fc2)表示信号在频率间隔[fc1,fc2]和时间间隔[t1,t2]内的能量。Ac(fc1,fc2)表示在频率间隔[fc1,fc2]和时间间隔[t1,t2]内的平均小波幅值。
这样,利用上述方法对FMD实施前的电阻抗信号Z0(t)进行分析,可得FMD实施前的3个特征参数:fc0,Ec0,Ac0,对FMD实施后的电阻抗信号ZF(t)进行类似分析,可得FMD实施后的另外3个特征参数:fcF,EcF,AcF,进一步,计算特征频率、绝对能量、平均幅值在FMD实施前后的相对变化百分比,分别表示为

3 系统设计与实现
基于以上所述的原理和方法,本文设计和实现的评估肱动脉内皮功能的电阻抗信号检测与分析装置,见图2。该装置包括检测系统和分析系统两部分(图3),其中检测系统主要用于检测前臂生物电阻抗信号;而分析系统主要基于小波分析技术分析计算各项生物电阻抗信号特征参数[18]。图3(a)用于检测前臂生物电阻抗信号的测量装置包括前臂上双电极、前臂下双电极、高频低幅恒流源发生器、交流电压检测电路、信号放大器、滤波电路、A/D转换电路和计算机。该测量装置的前臂上双电极置于待测手臂的上部,前臂下双电极置于待测手臂的下部见图3(b);高频低幅恒流源发生器和一对前臂上下电极构成电流回路;另一对前臂上下电极和交流电压检测电路构成回路检测电压变化。高频低幅恒流源发生器给前臂上电极和前臂下电极加一个一定频率ω的高频低幅的恒流电源,使前臂通过一个强度恒定的交流电流I,这样在前臂长度为L段两端就建立起一定的交流电压U。交流电压检测电路检测到的交流电压U经放大器、滤波、A/D转换将模拟的电压信号转换成数字信号输入计算机,并根据如下公式(12)计算电阻抗Z随时间的变化曲线:

由公式(12)计算的电阻抗信号存入计算机。

图2 评估肱动脉内皮功能的电阻抗信号检测与分析装置实物图
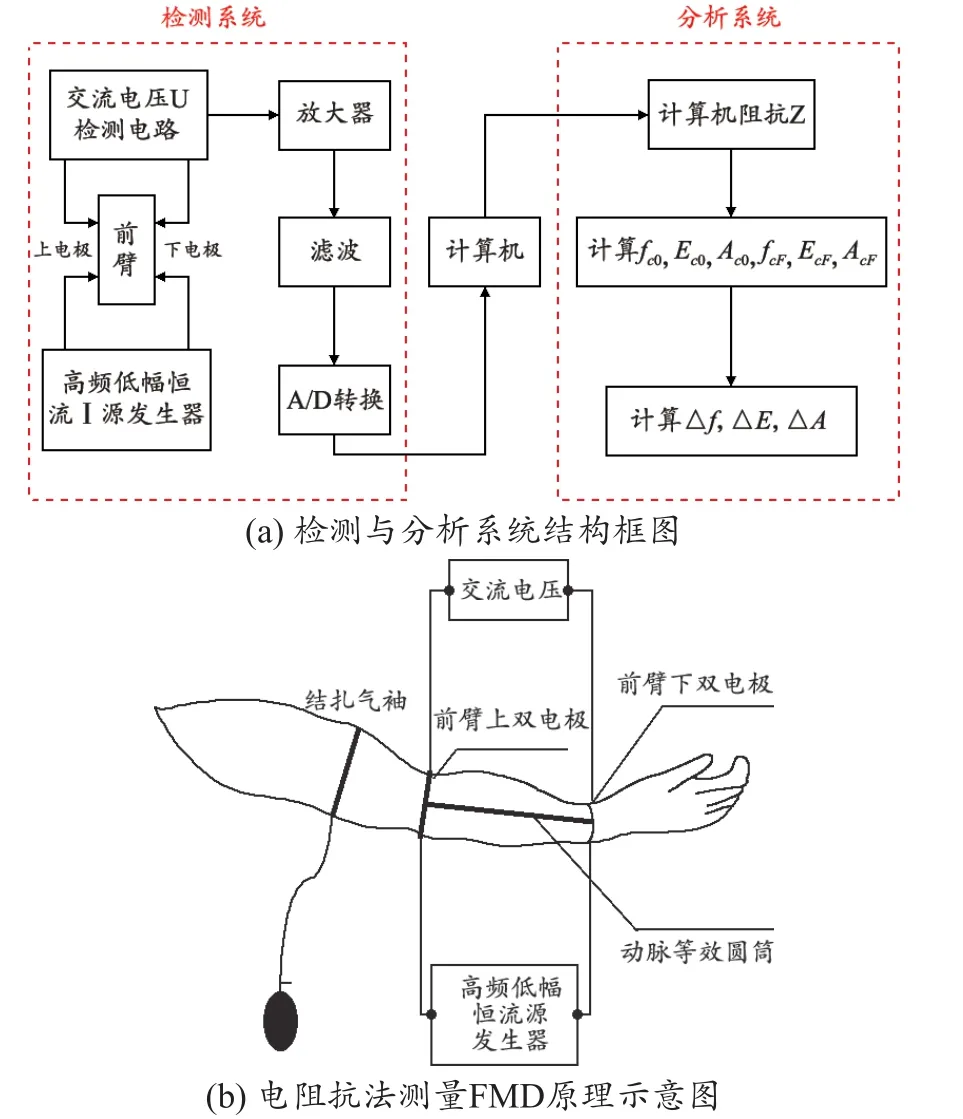
图3 系统设计与实现
分析系统主要由计算机、肱动脉内皮功能参数计算模块、显示屏、硬盘等构成。将检测系统输出的电阻抗信号作为原始数据,并对其进行小波分解去噪,基于去噪后的前臂电阻抗信号,根据公式(5)~(11)分别计算描述肱动脉内皮功能的信号特征参数,包括fc0,Ec0,Ac0,fcF,EcF,AcF,Δf,ΔE,ΔA。本系统的软件部分采用C++实现,可实现病例创建、电阻抗波形显示、性能选择(包括量程、增益、采样率和采样时间的选择)、以及分析计算结果的保存和打印。
4 实验验证
4.1 实验方案
随机选择7名年龄22~23岁的健康大学生作为受试者,所有受试者血压、心率正常,没有心脑血管疾病。受试者在实验前了解本实验的详细流程以及可能存在的风险,并签署书面知情同意书。
整个实验检测过程中,将检测装置的电极置于待测前臂的上下两端,上下电极距离1.5 cm,用常规水银血压计自带的气袖作为肱动脉加压装置。首先检测并记录FMD实施前静息状态前臂电阻抗信号Z0(t);用血压计自带的气袖给肱动脉加压,阻断肱动脉血流3分钟后释放,记录释放后的前臂电阻抗信号ZF(t)。
4.2 实验结果与讨论
图4显示的是利用本文装置所检测的受试者1在FMD实施前后一段前臂电阻抗信号的对比。FMD实施后前臂电阻抗信号的幅值小于FMD实施前的幅值,根据公式(1)可知,FMD实施后前臂动脉管径增大,这符合血流介导的肱动脉扩张现象。图4所示的电阻抗信号进行小波变换,得到的受试者1在FMD实施前后电阻抗信号频谱图的比较见图5。
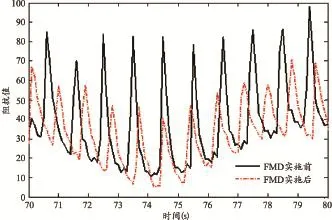
图4 受试者No. 1在FMD实施前后一段前臂电阻抗信号的对比
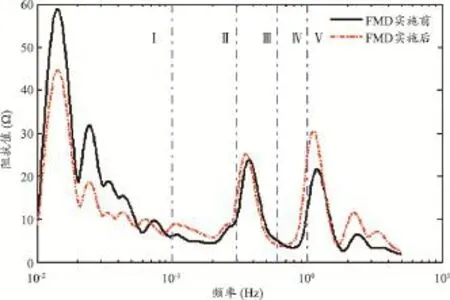
图5 受试者No.1在FMD实施前后电阻抗信号频谱图的比较
研究表明[16-17],人体血流信号的频谱可划分出五个频带,每个频带代表不同的生理活动见表1。观察图5可发现,频带II、III和IV的特征峰不够明显,说明神经活动、肌源性活动和呼吸活动对应的前臂电阻抗信号频谱特征峰不明显,造成这种现象的原因还有待于进一步探究;而频带I和频带V的特征峰明显,且FMD实施前后特征峰值可产生明显变化,说明内皮活动和心脏活动对应的前臂电阻抗信号频谱特征峰明显,且在FMD实施前后变化明显。鉴于本文系统主要用于评估肱动脉内皮功能,因此只对图5中频带I对应的内皮细胞活动进行分析。
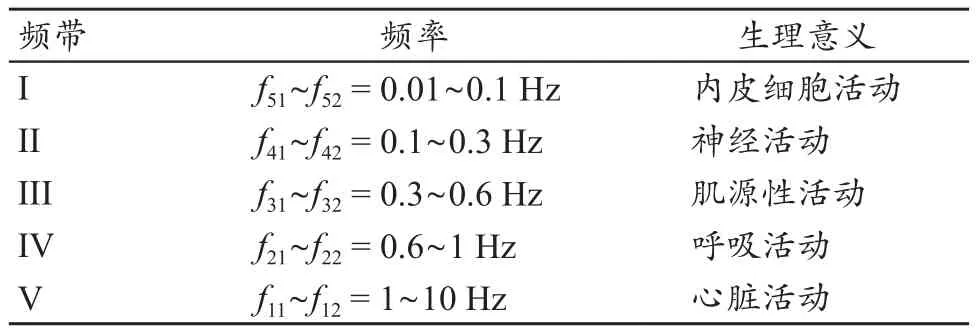
表1 人体血流信号频谱的频带划分[16-17]
表2列出了7名受试者在FMD实施前后前电阻抗信号9个特征参量,包括FMD实施前的特征频率fc0、绝对能量Ec0和平均幅值Ac0,FMD实施后的特征频率fcF、绝对能量EcF和平均幅值AcF,以及特征频率、绝对能量和平均幅值在FMD实施前后的相对变化百分比Δf、ΔE和ΔA。从表2中可以看出,在FMD实施前后,特征频率的相对变化绝对值在3.16%以内;FMD实施后绝对能量和平均幅值均减小。但由于个体差异,不同的受试者性别、年龄、身高、体重不同,导致其身体状况、健康程度、生理功能都不同,因此动脉内皮细胞活动对应的绝对能量和平均幅值的相对减小量存在较大的差异。
5 结论与展望
正确评价动脉内皮功能心脑血管疾病的预警起着至关重要的作用,本文利用生物电阻抗技术测量肱动脉FMD实施前后前臂生物电阻抗信号,并基于小波分析的方法设计出一种具有操作简单、价格低廉等优点的动脉内皮功能的电阻抗信号检测分析装置。
针对测量的前臂电阻抗信号进行频谱分析,可以提取到5个频段的特征参数,分别是内皮细胞活动、神经活动、肌原性活动、呼吸活动和心脏活动,其中与肱动脉内皮功能相关的是内皮细胞活动。通过对比计算FMD实施前后的特征参数变化量,发现FMD实施后特征频率基本不变,绝对能量、平均幅值均发生了不同程度的减小。由于FMD实施前后前臂电阻抗信号的变化主要由前臂动脉管径的变化引起,因此,可以认为前臂电阻抗信号的变化反映了前臂动脉管径的变化,即内皮的功能。本文提出的前臂电阻抗信号检测与分析系统为定量评估肱动脉内皮功能提供了一种新思路。尽管本文初步的研究结果表明,FMD实施前后前臂电阻抗信号的这些特征参数发生了不同程度的变化,然而,我们仍需要对更多的样本进行测量与分析,通过对比健康对照人群与有动脉功能受损的疾病患者的前臂生物电阻抗信号,获得健康对照人群的各个特征参数变化量和不同患者的特征参数变化量,以便建立评估规则,为进一步临床评估肱动脉内皮功能提供参考。
本文提出的检测与分析系统具有操作简单、价格低廉等优点,可应用于家庭及社区的医疗检测。随着智能手机与可穿戴医疗设备的快速发展和广泛应用,本文研究也为进一步研制智能可穿戴电阻抗动脉功能监测仪器提供了一定的方法学基础。

表2 FMD实施前后前臂电阻抗信号特征量的比较
[1]Laurent S,Boutouyrie P,Asmar R,et al.Aortic stiffness is an independent predictor of all-cause and cardiovascular mortality in hypertensive patients[J].Hypertension,2001,37(5):1236-1241.
[2]O’rourke MF,Mancia G.Arterial stiffness[J].J Hypertens,1999,17(1):1-4.
[3]Iannuzzi A,Licenziati MR,Acampora C,et al.Carotid artery stiffness in obese children with the metabolic syndrome[J].Am J Cardiol,2006,97(4):528-531.
[4]Favero G,Paganelli C,Buffoli B,et al.Endothelium and its alterations in cardiovascular diseases:life style intervention[J].Biomed Res Int,2014,2014:801896.
[5]Ramos-Casals M.The ill endothelium:how atherosclerosis begins in lupus[J].Rheumatology,2014,53(4):583-585.
[6]吕辉洋,刘璐,刘青,等.颈动脉粥样硬化在动脉粥样硬化性心血管疾病的研究新进展[J].心血管病防治知识:学术版,2015,(2):136-139.
[7]Ross R,Glomset JA.Atherosclerosis and the Arterial Smooth Muscle Cell[J].Science,1973,180(4093):1332-1339.
[8]Anderson TJ.Assessment and treatment of endothelial dysfunction in humans[J].J Am Coll Cardiol,1999,34(3):631-638.
[9]王慧群,陈爱华.血管内皮与动脉粥样硬化[J].医学综述,2008,14(4):598-600.
[10]林艾雯,陈竹君.动脉粥样硬化与内皮细胞损伤机制的研究进展[J].岭南心血管病杂志,2015,21(4):580-582.
[11]Anderson TJ,Uehata A,Gerhard MD,et al.Close relation of endothelial function in the human coronary and peripheral circulations[J].J Am Coll Cardiol,1995,26(5):1235-1241.
[12]葛念峄,冯新恒,谢道银,等.冠心病血管内皮功能的无创评估[J].临床心血管病杂志,2000,16(11):491-494.
[13]Celermajer DS,Sorensen KE,Gooch VM,et al.Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis[J].Lancet(London,England),1992,340 (8828):1111-1115.
[14]Takase B,Uehata A,Akima T,et al.Endothelium-dependent flow-mediated vasodilation in coronary and brachial arteries in suspected coronary artery disease[J].Am J Cardiol,1998,82 (12):1535-9,A7-8.
[15]董秀珍.生物电阻抗技术研究进展[J].中国医学物理学杂志,2004,21(6):311-317.
[16]Benedičič M,Bernjak A,Stefanovska A,et al.Continuous wavelet transform of laser-Doppler signals from facial microcirculation reveals vasomotion asymmetry[J].Microvasc Res,2007,74(1):45-50.
[17]Stefanovska A,Bracic M,Kvernmo HD.Wavelet analysis of oscillations in the peripheral blood circulation measured by laser Doppler technique[J].IEEE Trans Biomed Eng,1999,46(10):1230-1239.
[18]覃开蓉,李思琦,申华,et al.一种肱动脉内皮功能的电阻抗检测分析装置及方法[P].中国专利:201610092345.3,2016-02-19. (已公开)
Detecting and Analyzing System for Brachial Artery Endothelial Function
The damage or dysfunction of arterial endothelial function is the primary performance at the early stage of atherosclerosis. Quantitative evaluation of brachial artery endothelial function is helpful to discover the cardiovascular dysfunction in time,thus provides some evidence for the early diagnosis and treatment of cardiovascular and cerebrovascular diseases. To date,brachial artery endothelial function is evaluated at clinic by measuring the brachial fow-mediated vasodilation (FMD) with a Color Doppler Ultrasonography. Although the accuracy and resolution of this method are much higher,its equipment is relatively expensive,and its operation is very complicated. In this study,a detecting and analyzing system is proposed for evaluating brachial artery endothelial function based on forearm biological electrical impedance signal. By detecting forearm biological impedance signal before and after brachial FMD,the characteristic parameters of biological electro-impedance signals,including characteristic frequency,absolute energy,average amplitude and their relative alteration rate,are calculated using wavelet analysis technology. As the changes in the forearm biological electro-impedance before and after FMD are mainly caused by the changes in the brachial arterial diameter,the detecting and analyzing system of forearm biological electro-impedance signal would provide a new idea for evaluating quantitatively brachial artery endothelial function. In comparison with existing methods at clinic,the detecting and analyzing system of forearm biological electro-impedance signal is detection-simpler,cheaper,more practical and convenient,it can not only be used in the family or community medicine,but also realize on-line detection and provide with a methodology base for further development of the intelligent and wearable electrical impedance analyzer for monitoring arterial function.
arterial endothelial function;biological impedance signal;wavelet analysis;characteristic frequency;absolute energy;average amplitude
LI Si-qi1,SHEN Hua1,2,ZHU Yong1,LIANG Shun1,QIN Kai-rong1
1.Department of Biomedical Engineering,Faculty of Electronic Information and Electrical Engineering,Dalian University of Technology,Dalian Liaoning 116024,China;2.Department of Electronic Engineering,Dalian Neusoft University of Information,Dalian Liaoning 116023,China
TP274;R54
A
10.3969/j.issn.1674-1633.2016.09.003
1674-1633(2016)09-0009-05
2016-08-26
国家自然科学基金项目(31370948);辽宁省公益研究科学基金项目(2014001027)。
覃开蓉,教授。
通讯作者邮箱:krqin@dlut.edu.cn

