免疫增强剂提升猪用灭活疫苗免疫效力的研究
唐波,张道华,唐应华,常晨,刘国阳,华涛,张雪花,侯继波
(江苏省农业科学院 国家兽用生物制品工程技术研究中心,南京 210014)
免疫增强剂提升猪用灭活疫苗免疫效力的研究
唐波,张道华*,唐应华,常晨,刘国阳,华涛,张雪花,侯继波
(江苏省农业科学院 国家兽用生物制品工程技术研究中心,南京 210014)
为评价免疫增强剂对猪细小-乙脑二联灭活疫苗的免疫效力提升作用,将免疫增强剂以伴侣形式与疫苗共同混合免疫5~6月龄阴性后备母猪和种公猪,检测其抗体水平。结果显示,免疫增强剂与疫苗混合免疫后1周抗体全部转阳,免疫后1~6月平均抗体效价均显著高于不含免疫增强剂的常规疫苗组,表明该免疫增强剂能够显著提升猪细小-乙脑二联灭活疫苗对后备母猪和种公猪的免疫效力。
免疫增强剂;猪细小病毒;猪乙脑病毒;灭活疫苗;免疫效果
猪细小病毒(Porcine parvovirus,PPV) 与乙脑病毒(Japanese encephalitis virus,JEV)是引起猪繁殖障碍病的重要病原[1-2]。目前国内细小病毒阳性感染率超90%,受感染公猪可通过精液长时间排毒[3]。灭活疫苗仍是目前预防细小感染最有效方法[4-5]。我国预防猪乙脑的疫苗为SA14-14-2弱毒活疫苗,然而在猪群中广泛接种减毒活疫苗存在着一定风险,而灭活疫苗对解决活疫苗潜在危险具有重要意义[6]。但是灭活疫苗免疫后仍存在抗体水平低和免疫保护期短等问题,如何提升现有灭活疫苗免疫效力成为临床上急需解决的难题。使用一种既可以增强疫苗免疫效力又可以大大减少抗原含量降低生产成本的免疫增强剂显的尤为重要。随着规模化养猪发展,迫切需要能一针多防且免疫效果好的联苗。研制联苗不但可以简化免疫程序,还可以显著降低接种应激反应从而提高疫苗整体免疫效果。
机体免疫系统均存在模式识别受体[7],这些受体能对外来病原的特定小分子物进行识别,继而激发机体免疫功能[8]。目前应用比较广泛的一些天然免疫受体及其激动剂类小分子类物质就是机体免疫系统的高效刺激分子,在机体疫应答过程中发挥十分重要的作用[9-10]。研究发现,含天然受体激动剂的复方免疫增强剂能够有效提升灭活疫苗对鸡的免疫效力[11]。本研究对有效提升禽用灭活疫苗免疫效力的VA5复方免疫增强剂进行了研究,以评价其对猪用灭活联苗的免疫增强效果。
1 材料和方法
1.1 疫苗和检测试剂 猪细小、乙脑二联灭活疫苗为本室制备,细小病毒含量为每1 mL 107.4TCID50,乙脑病毒含量为每1 mL 107.5TCID50;细小疫苗毒株及HI检测用抗原为PPV-NJ株,乙脑疫苗毒株为JEV-JS株。猪细小病毒ELISA抗体检测试剂盒,购自深圳绿诗源生物技术有限公司;猪乙脑病毒ELISA抗体检测试剂盒,购自武汉科前动物生物制品有限责任公司。
1.2 试验动物 5~6月龄阴性后备母猪和公猪(猪细小病毒HI抗体阴性),购自江苏明天农牧科技公司。
1.3 疫苗的制备 含VA5 免疫增强剂疫苗的配制详见专利( 申请号201210235427.0)。按要求将免疫增强剂配成油乳剂疫苗伴侣,将疫苗伴侣与常规猪细小、乙脑二联灭活疫苗按体积比1︰9混合,该混合液即为含免疫增强剂的猪细小、乙脑二联灭活疫苗灭活疫苗。
1.4 抗体水平检测
1.4.1 猪细小病毒血凝抑制抗体(HI)的检测 将分离的100 uL血清56 ℃水浴灭活30 min后,加入300 uL 25%白陶土悬液,混匀,置室温下作用30 min;以10000 r/min离心10 min,吸取上清,加入100 uL 20%的豚鼠红细胞泥,振荡混匀后37 ℃作用1 h以4000 r/min离心10 min,收集上清即为待检血清样品。参照文献中[12]HI检测方法来评价免疫后抗体消长规律。1.4.2 间接ELISA抗体检测 将分离待检血清按照ELISA检测试剂盒使用说明书的方法进行PPV、JEV ELISA抗体。通过酶标仪读取OD630值,测定血清样品ELISA抗体效价,OD630﹥0.32判为阳性。
1.5 疫苗免疫试验 选健康后备母猪和种公猪各15头,分别设常规疫苗免疫组、伴侣疫苗免疫组、空白对照组,每组5头。免疫组分别每头2.0 mL肌肉注射,于免疫后1周、2周、3周、4周、2月、3月、4月、5月、6月采血,分别用检测血清中PPV、JEV抗体。
2 结果与分析
2.1 含免疫增强剂疫苗免疫后备母猪试验结果
2.1.1 后备母猪PPV HI抗体检测结果 常规疫苗免疫组1周后HI抗体部分转阳(HI抗体不低于6),2周后全部为阳性,1~3个月HI抗体处于较高水平,至免疫后4~6个月有所下降。含免疫增强剂疫苗免疫组1周后HI抗体全部转阳,免疫后1~6个月抗体水平均维持在较高水平且明显高于常规疫苗免疫组(图1)。
2.1.2 后备母猪PPV ELISA抗体检测结果 PPV灭活疫苗免疫后备母猪后的ELISA抗体检测结果表明,各免疫组免疫后1周ELISA抗体全部转阳(OD630≥0.32),第2周后抗体水平均有大幅度的提升。常规疫苗组免疫后第4个月开始下降,含免疫增强剂疫苗组免疫后1~6个月抗体水平均维持在较高水平。含免疫增强剂组在各个时间段的抗体水平均明显高于常规疫苗免疫组(图2)。

图1 后备母猪免疫后PPV HI抗体检测结果

图2 后备母猪免疫后PPV ELISA抗体检测结果
2.1.3 后备母猪JEV ELISA抗体检测结果 免疫后不同时间点分别采集血液分离血清,测定JEV ELISA抗体。结果见图3,常规疫苗免疫组免疫后1周ELISA抗体全部转阳(OD630≥0.32),3~9周抗体水平维持教高水平,免疫后第3个月开始逐渐下降。而含免疫增强剂疫苗组3周到6个月均能维持在较高水平且在各个时间段的抗体水平均明显高于常规疫苗免疫组。
2.2 含免疫增强剂疫苗免疫种公猪试验结果
2.2.1 种公猪PPV HI抗体检测结果 公猪在免疫后各个时间段采集的血清进行HA检测,得到HI抗体水平消长曲线。由图4可知,常规疫苗免疫组1周后HI抗体部分转阳(HI抗体不低于1︰6),2周后全部为阳性,免疫后4周HI抗体达到峰值,3~6个月有所下降。含免疫增强剂疫苗免疫组1周后HI抗体全部转阳,免疫后1~6个月抗体水平均维持在较高水平。

图3 后备母猪免疫后JEV ELISA抗体检测结果

图4 公猪免疫后PPV HI抗体检测结果
2.2.2 种公猪PPV ELISA抗体检测结果 ELISA检测PPV灭活疫苗免疫种公猪后各个时间点血清抗体水平。由图5可知含免疫增强剂疫苗免疫组免疫后1周后很快产生ELISA抗体,免疫后4周HI抗体达到峰值,1~6个月均维持在较高水平。常规疫苗组各个时间点血清抗体水平则明显低于含免疫增强剂组。
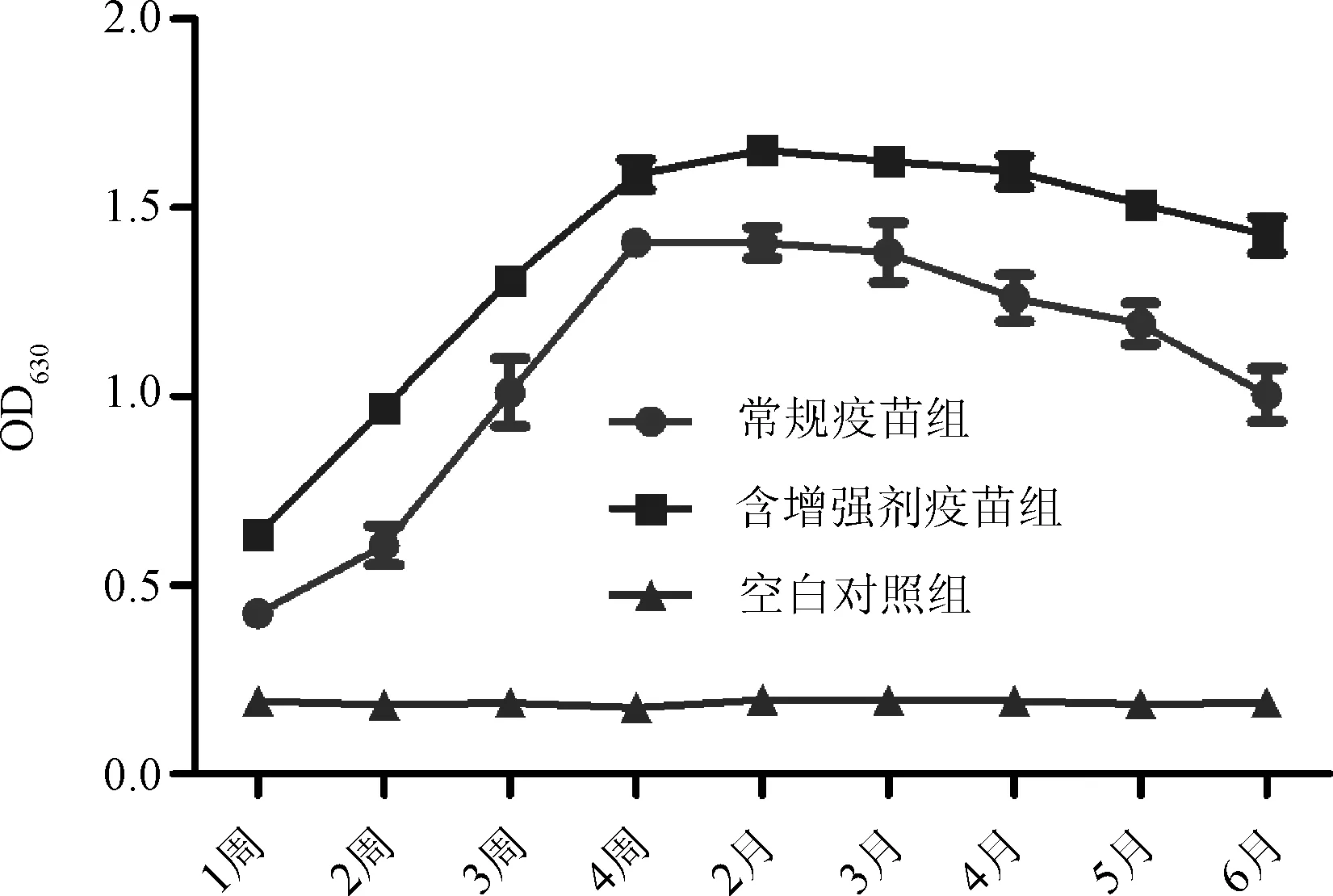
图5 公猪免疫后PPV ELISA抗体检测结果
2.2.3 种公猪JEV ELISA抗体检测结果 疫苗免疫种公猪后JEV ELISA抗体检测结果表明,所有免疫组种公猪免疫后免疫1周抗体全部转阳随后抗体效价逐步增高。常规疫苗免疫后第3个月开始逐渐下降。而含免疫增强剂疫苗组免疫后3周至6个月均能维持在较高的水平,抗体水平在各个时间点均显著高于常规疫苗免疫组(图6)。

图6 公猪免疫后JEV ELISA抗体检测结果
3 讨论与小结
猪细小和乙脑疫苗主要是应用于母猪和种公猪,本试验将VA5复方免疫增强剂以伴侣形式与疫苗混合分别免疫5~6月龄阴性后备母猪和种公猪。免疫后1周抗体很快全部转阳,常规疫苗免疫后第3个月开始逐渐下降,而含增强剂疫苗组免疫后1~6个月抗体水平全部维持在较高水平且显著高于常规灭活疫苗。试验表明该免疫增强剂在后备母猪和种公猪上使用均能很快提升疫苗的抗体效价并能有效延长抗体持续期。
有研究报道,CpG-ODN受体激动剂和poly(I:C)这类物质能够增强机体的免疫应答,在机体的免疫应答过程中发挥着重要作用[13]。本研究使用的VA5复方免疫增强剂中含有这类天然免疫受体激动剂,其在禽流感、马立克病等灭活疫苗的免疫效力提升上具有十分显著的作用[14]。该增强剂不仅能够提高禽流感单苗的免疫效力对禽用二联疫苗也同样具有免疫增强作用,使得机体免疫二联苗后比常规二联苗提前产生抗体且效价明显提升[15]。使用免疫增强剂是目前提升灭活疫苗保护效力的有效途径。该免疫增强剂对猪用灭活疫苗免疫效力影响以及免疫机理的研究报道尚少。
本试验中含VA5复方免疫增强剂的猪用联苗在免疫猪后不仅可以诱导高水平抗体产生,同时还减少了免疫次数以及对猪体的应激反应,大大提高生产效率具有良好的推广应用前景。这为我们进一步开展猪细小-乙脑二联灭活疫苗后续研究奠定基础。
[1] Mengeling W L, Cutlip R C, Wilson R A,etal. Fetal mummification associated with porcine parvovirus infection[J]. Journal of the American Veterinary Medical Association, 1975, 166: 993-995.
[2] Yiying Chen, Yichin Fan, Wuchun Tu,etal. Japanese encephalitis virus genotype replacement, Taiwan, 2009-2010[J]. Emerging Infectious Diseases, 2011, 17(12): 2354-2356.
[3] Yunpeng Fan, Xia Ma, Weifeng Hou,etal. The adjuvanticity of ophiopogon polysaccharide liposome against an inactivated porcine parvovirus vaccine in mice[J]. International Journal of Biological Macromolecules, 2016, 82 : 264-272.[4] Zhenmei Zhang, Chaofan Zhang, Shangjin Cui,etal. Determination of immune dose and immune duration of PPV inactivated vaccine[J].Preventive Veterinary Medicine, 2010, 32 : 394-397.[5] Xia Ma, Zhenhuan Guo, Zhiqiang Shen,etal. The immune enhancement of propolis adjuvant on inactivated porcine parvovirus vaccine inguinea pig[J]. Cellular Immunology, 2011, 270 : 13-18.
[6] 唐波, 张道华, 张雪花, 等.一株猪源乙型脑炎病毒的分离及鉴定[J]. 浙江农业学报, 2015, 27(10): 1698-1703.
[7] Holger Heine. TLRs, NLRs and RLRs: Innate sensors and their impact on allergic diseases-a current view[J]. Immunology Letters, 2011, 139:11-24.
[8] Beutler B. Interfaces questions and possibilities in Toll-like receptor[J]. Nature, 2004, 430: 257-268.
[9] Yasuhiro Gon.Toll-Like receptors and airway inflammation[J]. Allergology International, 2008, 57(1): 33-37.
[10]Kawai T, Akira S. The roles of TLRs, RLRs and NLRs in pathogen recognition[J]. International Immunopharmacology, 2009, 21: 317-337.
[11]唐应华, 陆吉虎, 吴培培, 等.免疫增强剂提高禽流感疫苗效力的研究[J]. 江苏农业学报, 2014, 30(2): 344-348.
[12]张婉华, 邹勇, 朱永军, 等.猪细小病毒HA、HI微量法试验的优化[J]. 中国兽药杂志, 2013, 47(2): 21-23.
[13]Luisa Eca Guimaraes, Britain Baker, Carlo Perricone,etal. Vaccines, adjuvants and autoimmunity[J]. Pharmacological Research, 2015, 100: 190-209.
[14]Yinghua Tang, Jihu Lu, Peipei Wu,etal. Inactivated vaccine
with adjuvants consisting of pattern recognition receptor agonists confers protection against avian influenza viruses in chickens[J]. Veterinary Microbiology, 2014, 172: 120-128.
[15]陆吉虎, 吴培培, 张雪花, 等.免疫增强剂提高禽用二联苗免疫效力的研究[J]. 中国农业科技导报, 2016, 18(1): 58-65.
(编辑:李文平)
Evaluation of Immunopotentiators for Improving the Efficacy of Porcine Inactived Vaccine
TANG Bo,ZHANG Dao-hua*,TANG Ying-hua,CHANG Chen,LIU Guo-yang,HUA Tao, ZHANG Xue-hua, HOU Ji-bo
(NationalResearchCenterofEngineeringandTechnologyforVeterinaryBiologicals,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
To evaluate the immunopotentiator for improving the efficacy of inactived porcine parvovirus and Japanese encephalitis vaccines, the immunopotentiator was mixed with chaperon form of vaccine. Replacement gilts and boars were inoculated with the vaccine for immunization, and the hemagglutinin inhibition (HI) titer and ELISA of sera were measured. The results showed a high antibody titer of immunopotentiators group were elevated significantly after vaccinated. The immunopotentiator is effective in prolonging the antibody persistence period. The antibody is all positive for one week later, and antibody level were significantly higher than conventional group during six months. In sum, the immunopotentiator can improve the efficacy on porcine inactivated vaccine in replacement gilt and boar.
immunopotentiators;porcine parvovirus;Japanese encephalitis virus; inactivated vaccine;immune effect
江苏省农业科技自主创新基金项目[CX(11)2047];农业公益性行业科研专项(201303046)
唐波,硕士,从事动物分子病原学及免疫学研究。
张道华。E-mail: 2005107058@163.com
2016-03-17
A
1002-1280 (2016) 06-0005-05
S858.28

