植物B12D基因克隆研究进展
周延清,王向楠,张永华,张 喻,王慧娜,段红英(河南师范大学 生命科学学院,河南 新乡453007)
植物B12D基因克隆研究进展
周延清,王向楠,张永华,张 喻,王慧娜,段红英
(河南师范大学 生命科学学院,河南 新乡453007)
综述了植物B12D基因的克隆、特性、时空表达、亚细胞定位、异源表达、过表达、生物和非生物胁迫应答、响应脱落酸与赤霉素等激素调节等方面的研究进展,展望了采用分子生物学新技术研究其调节植物胁迫应答反应机制和改良作物品质的发展趋势,为利用其进行植物耐胁迫和品质改良提供参考。
植物; B12D基因; 生物胁迫; 非生物胁迫; 基因功能
植物B12D基因首次在大麦中发现,是一类与大麦糊粉粒和胚发育相关的转录表达基因[1]。之后,从苔藓植物、裸子植物以及拟南芥[2]、木榄木[3]和水稻[4]等被子植物中克隆得到多种B12D基因。前人已经对此类基因的克隆、序列、所编码蛋白质的理化特性、空间结构、亚细胞定位[5]、非生物胁迫和生物胁迫应答机制等进行了研究[6-9],发现其与植物对多种生物胁迫和非生物胁迫的应答反应有关,受脱落酸和赤霉素等植物生长调节剂的调节,参与脂肪酸β-氧化、能量代谢和糖代谢。基于植物B12D基因在植物界分布的广泛性和功能的多样性,综述了植物B12D基因的克隆、表达和胁迫应答等方面的研究进展,旨在为深入研究其功能和在植物品种定向改良方面的应用提供参考。
1 B12D基因的克隆与特性研究
自从Aalen 等[1]首次从大麦中分离获得有关灌浆和胚发育的B12D基因以来,一些学者从小立碗藓(PHYPADRAFT_223334)等苔藓植物、北美云杉(ABK24106)等裸子植物以及拟南芥[2]、水稻和地黄等被子植物中分离获得B12D基因。用于分离该基因的技术方法有逆转录PCR[1,10]、cDNA文库[11]、转录组测序[12]、基因芯片[13]、差异显示[14]、抑制差减杂交、表达序列标签和数量性状位点作图[15]、鸟枪法亚克隆和测序[16]、精细作图[17]、cDNA-限制性长度多态性[18]、全基因组分析[19]、蛋白质组学[20]、抑制差减杂交和微阵列[21]等。已经克隆的植物B12D基因多为cDNA,少数为基因组DNA[20],全长cDNA包括ORF、3′-非翻译区和5′-非翻译区[10],而在基因组中B12D基因包括大小可变性内含子、2~3个外显子、3′-非翻译区和5′-非翻译区。有些植物种的B12D基因有多个成员,例如,水稻OsB12Ds基因有6个成员[20],大麦B12D基因可能有8~9个成员[6]。B12D基因编码的蛋白质多为由76~134个氨基酸残基组成的低分子质量蛋白质[20],具有疏水N-端的膜锚定蛋白[22],彼此间具有相当高的同源性,如地黄B12D蛋白与其他38种植物的B12D蛋白具有54%~88%的氨基酸同源性(表1)。
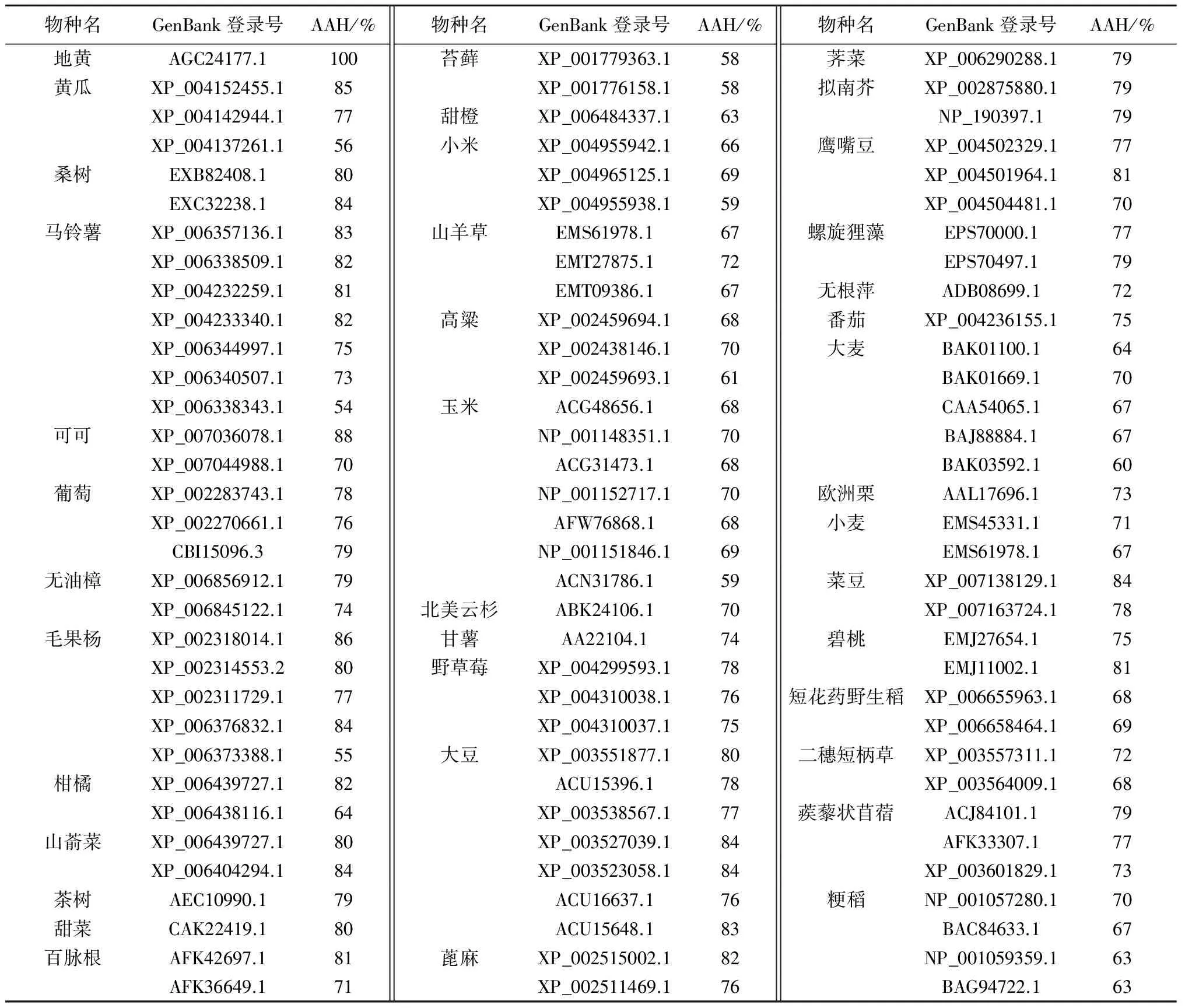
表1 地黄与其他植物的B12D蛋白同源性
注:AAH代表氨基酸序列的同源性。
2 植物B12D基因的表达研究
目前,植物B12D基因的时空表达、瞬时表达(亚细胞定位)、异源表达和过表达研究均有一些报道。在植物B12D基因的时空表达方面,利用Nor-thern blot技术检测到大麦花不同发育时间胚乳中均有B12D基因的转录本,用引物延伸分析技术检测到B12D基因在成熟大麦种子和不成熟大麦种子中转录产生RNA,用基因枪法将该B12D基因的启动子和gus基因转入未成熟大麦种子细胞,gus基因在其未成熟糊粉层和胚中表达,而且甘露醇抑制启动子启动gus基因表达[6];采用Reverse Northern分析证明,番木瓜根B12D基因(Cp27-2)在番木瓜根、叶、花、果实和下胚轴中均表达,而且其叶和果实中的表达量均低于其他3种组织中的表达量[23];荧光定量PCR分析发现,甘蔗B12D基因(ScB12D)[11]、水稻B12D基因(OsB12D1)[20]和地黄B12D基因(RghBNG)[10]分别在其各自同一发育阶段的不同组织中不同程度地表达,在其不同发育阶段的不同组织中不同程度地表达,产生mRNA。这些结果表明,植物B12D基因与植物生长发育有关。
在植物B12D基因瞬时表达方面,与植物衰老相关的B12D基因编码一类存在于植物叶过氧物酶体蛋白组中的靶信号受体蛋白质,其C-端与绿色荧光蛋白的融合蛋白定位于过氧物酶体[5];生物信息学技术预测结果显示,甘蔗ScB12D蛋白定位于质膜或者内质网膜[11],拟南芥B12D蛋白定位于线粒体中[5]或者过氧物酶体中[21],水稻OsB12D蛋白定位于过氧物酶体中[21]或者线粒体中[20],地黄RghBNG蛋白定位在细胞膜与细胞质中[24]。其中,3项研究[5,11,25]结果表明,B12D蛋白参与能量代谢。这些结果表明,不同植物B12D蛋白位于不同的细胞结构中。但是,“B12D蛋白是线粒体膜中NADH-辅酶还原酶复合体1-MLRQ 亚基中的一种”[4]的观点支持B12D蛋白定位于线粒体的结果。
在植物B12D基因异源表达方面,把地黄RghBNG基因克隆到原核表达载体pET-32a,构建了重组表达载体pET-32a-RghBNG,转入大肠杆菌BL21(DE3),成功地诱导表达出RghBNG蛋白[26]。
在植物B12D基因过表达方面,把水稻OsB12D1基因的全长cDNA克隆入改良载体PUC1301中,形成过表达载体pUbi-OsB12D1-FLAG,经过农杆菌介导将其转入水稻,获得PCR鉴定为阳性的转基因水稻T0和经过qRT-PCR和Western blot鉴定为阳性的T2代品系,可以提高水稻在种子萌发和早期苗生长阶段的耐淹性[20]。
3 植物B12D基因的胁迫应答反应研究
植物的胁迫应答反应可以通过其特定基因的诱导表达得以实现。植物B12D基因对生物和非生物胁迫均有应答反应。
在生物胁迫方面,差示筛选分析表明,B12D类基因FC325315在长喙壳从头螨侵染的美国榆树愈伤组织中上调表达[15];用地毯草黄单胞菌接种木薯7 d,其茎中B12D类基因的cDNA(CK646830)表达上调5.5倍[27];B12D基因在真菌诱导子处理的水稻悬浮培养物中上调表达[28];大豆锈菌感染大豆使B12D基因Gma.6327.1.S1s_at上调表达[18];根结线虫感染使花生根中B12D类基因Contig7的转录上调3.99倍[13]。另一方面,有些生物胁迫使B12D基因下调表达,例如,烟草脆裂病毒侵染抗番茄黄曲叶病毒的番茄,导致B12D类基因SGN-U576939的有限表达[29];黑森瘿蚊侵害具有黑麦第2号染色体长臂(赋予对L型黑森瘿蚊的抗性)的小麦近等基因系,导致B12D类基因差异表达[19];黑穗病胁迫下甘蔗ScB12D基因表达呈下调趋势[11]。
在非生物胁迫方面,实时定量PCR表达分析发现,除草剂莠去津处理水稻使其根中B12D基因Os07g41340上调表达[4];NaCl胁迫使甘蔗ScB12D基因[11]、红树植物木榄根中B12D类基因Bg04-08_B20[3]和地黄RghBNG基因[10]表达量增加;重金属铬和汞诱导地黄RghBNG基因[10]表达;斑点杂交和诺瑟斑点杂交表明,汽油胁迫使狗牙根根中B12D类基因CdR311上调表达[16];在水稻衰老过程中B12D基因上调表达[28];RT-PCR检测结果表明,B12D基因Bvb12d在17 ℃和28/26 ℃下的甜菜储藏根中上调表达[17];高温处理促进水稻 OsB12Ds表达,水稻B12D基因OsB12D1对缺氧、淹水和洪水反应积极,水稻基因Os07g17330受盐和叠氮钠诱导表达[20]。另一方面,4个水稻OsB12Ds的表达被甘露醇显著抑制,对低浓度过氧化氢不敏感,对盐、温度、水杨基氧污酸、叠氮钠和淹渍有不同程度的反应,LOC_Os07g41340被甘露醇、高浓度过氧化氢、水杨基氧污酸和水淹渍抑制[20];拟南芥FUSCA3转录因子促进种子成熟和休眠,在32 ℃下抑制种子萌发,转该转录因子基因(FUS3)的拟南芥种子在32 ℃下一定时间内下调其B12D类基因At3g48140[12]。大麦糊粉层的B12D类基因HV_CEa0011J09r2_at在大麦制麦过程中表达,降低麦芽膏的含量,提高麦芽β-葡聚糖含量[19]。因为理想的啤酒质量特征要求高麦芽膏量和低麦芽β-葡聚糖含量[30],所以该基因在大麦品系中的表达影响大麦这2个啤酒质量性状[19]。
在植物生长调节剂诱导植物B12D基因表达方面,脱落酸诱导甘蔗ScB12D基因[11]、大麦B12D基因[7]和一些水稻OsB12Ds基因表达量升高[20]。因为脱落酸能够在种子萌发与休眠、低温、气孔关闭、离子渗透和干旱等非生物胁迫应答和生物胁迫应答中起重要的调控作用[11],所以,B12D 基因与植物响应胁迫的应答机制有关。赤霉素诱导大麦[7]、有些水稻OsB12Ds基因[20]和地黄B12D类基因RghBNG[10]上调表达。NAA和6-BA上调地黄B12D类基因RghBNG[10]表达。
4 展望
迄今,学者对植物B12D基因的克隆、特性、表达和胁迫应答反应等进行了多项研究,发现植物B12D基因广泛分布于苔藓植物、裸子植物和被子植物中,参与植物生长发育过程,对多种生物胁迫和非生物胁迫产生应答反应。因此,B12D基因对植物生长发育和胁迫应答反应具有重要作用。但是,对B12D基因的研究仍然存在一些缺陷,譬如,对植物B12D基因作用的分子机制及其应用研究比较少。对已经研究的B12D基因而言,能够确定其功能和作用机制的研究也不够深入。所以,将来随着现代分子生物学技术(尤其是omics技术)的不断发展和广泛应用,必将采取RNAi技术、基因敲除技术、酵母双杂交技术、转录组学技术和蛋白质组学技术等技术有效而全面地探索B12D基因作用的分子机制,验证其功能,了解其调控植物抵抗生物胁迫和非生物胁迫的作用机制,通过基因工程技术培育抗逆植物新品种。另外,最近研究发现,B12D蛋白参与脂肪酸β-氧化过程[31],这对改良作物品质具有重要价值。
[1] Aalen R B,Opsahl-Ferstad H G,Linnestad C,etal.Transcripts encoding an oleosin and a dormancy-related protein are present in both the aleurone layer and the embryo of developing barley (PlordeumvitlgareL.) seeds[J]. Plant J,1994,5(3):385-396.
[2] Zhu T,Budworth P,Han B,etal.Toward elucidating the global gene expression patterns of developingArabidopsis: Parallel analysis of 8300 genes by a high-density oligonucleotide probe array[J].Plant Physiol Biochem 2001,39: 221-242.
[3] Miyama M,Hanagata N.Microarray analysis of 7029 gene expression patterns inBurmamangroveunder high-salinity stress[J].Plant Sci,2007,172(5):948-957.
[4] Zhang J J,Zhou Z S,Song J B,etal.Molecular dissection of atrazine-responsive transcriptome and gene networks in rice by high-throughput sequencing[J].J Hazard Mater,2012,219:57-68.
[5] Reumann S,Quan S,Aung K. In-depth proteome analysis ofArabidopsisleaf peroxisomes combined withininvivosubcellular targeting verification indicates novel metabolic and regulatory functions of peroxisomes [J].Plant Physiol,2009,150(1):125-143.
[6] Steinum T M,Berner H S,Stacy R A P,etal.Differential regulation of the barley(Hordeumvulgare)transcripts B22E and B12D in mature aleurone layers[J].Physiol Plantarum,1998,102(3):337-345.
[7] Aalen R B,Salehian Z,Steinum T M.Stability of barley aleurone transcripts:Dependence on protein synthesis,influence of the starchy endosperm and destabilization by GA3[J].Physiol Plant,2001,112(3):403-413.
[8] Fujiita M,Fujita Y,Noutosih Y,etal.Crosstalk between abiotic and biotic stress responses:A current view from the points of convergence in the stress signaling networks[J].Curr Opin Plant Biol.2006,9(4):436-442.
[9] Ton J,Mauch-Mani B.Beta amino-butyric acid induced resistance against necrotrophic pathogens is based on ABA dependent priming of callose [J].Plant J,2004,38(1):119-130.
[10] Zhou Y Q,Zhang Y H,Wei J,etal.Cloning and analysis of expression patterns and transcriptional regulation ofRghBNGin response to plant growth regulators and abiotic stresses inRehmanniaglutinosa[J].Springer Plus,2015,4(60):1-8.
[11] 张玉叶,黄宁,肖新换,等.甘蔗B12D基因全长 cDNA 克隆与表达分析[J].热带生物学报,2014,5(2): 111-119.
[12] Chiu R S,Nahal H,Provart N J,etal.The role of theArabidopsisFUSCA3 transcription factor during inhibition of seed germination at high temperature[J].BMC Plant Biol,2012,12:15-20.
[13] Ergen N Z,Thimmapuram J,Bohnert H J,etal.Transcriptome pathways unique to dehydration tolerant relatives of modern wheat[J].Funct Integr Genomics,2009,9(3):377-396.
[14] Schafleitner R R,Wilhem E.Isolation of wound-responsive genes from chestnut(Castaneasativa)microstems by mRNA display and their differential expression upon wounding and infection with the chestnut blight fungus (Cryphonectriaparasitica)[J].Physiological and Mole-cular Plant Pathology,2002,61: 339-348.
[15] Liu R X,Zhang H,Zhao P,etal.Mining of candidate maize genes for nitrogen use efficiency by integrating gene expression and QTL data[J].Plant Mol Biol Rep,2012,30(2):297-308.
[16] Melotto M,Coelho M F,Pedrosa-Harand A,etal.The anthracnose resistance locus Co-4 of common bean is located on chromosome 3 and contains putative disease resistance-related genes[J].Theor Appl Genet,2004,109(4):690-699.
[17] Zhou L J,Chen L M,Jiang L,etal.Fine mapping of the grain chalkiness QTLqPGWC-7 in rice(OryzasativaL.)[J].Theor Appl Genet,2009,118(3):581-590.
[18] Feng X L,Zhao P K,Hao J Q,etal. Effects of sorbitol on expression of genes involved in regeneration of upland rice (OryzasativaL.) [J].Plant Cell,Tissue and Organ Culture,2011,106(3):455-463.
[19] Lee T G,Kim D Y,Johnson J W,etal.A genome-wide analysis of transcripts in a 2BS.2RL wheat-rye translocation during Hessian fly infestation[J].Genes & Genom,2013,35(6):795-803.
[20] He D L,Zhang H,Yang P F.The mitochondrion-located protein OsB12D1 enhances flooding tolerance during seed germination and early seedling growth in rice[J]. Int J Mol Sci,2014,15(5):13461-13481.
[21] Rawat N,Neeraja C N,Nair S,etal.Differential gene expression in gall midge susceptible rice genotypes revealed by suppressive subtraction hybridization(SSH) cDNA libraries and microarray analysis[J].Rice,2012,5(1):8-14.
[22] Käll L,Krogh A,Sonnhammer E L.A combined transmembrane topology and signal peptide prediction method[J].J Mol Biol,2004,338(5):1027-1036.
[23] Porter B W,Aizawa K S,Zhu Y J,etal.Differentially expressed and new non-protein-coding genes from aCaricapapayaroot transcriptome survey[J].Plant Sci,2008,174(1):38-50.
[24] 张喻.地黄RghBNG基因的结构分析和功能验证[D].新乡:河南师范大学,2014.
[25] Walker J E,Arizmendi J M,Dupuis A,etal.Sequences of 20 subunits of NADH:Ubiquinone oxidoreductase from bovine heart mitochondria.Application of a novel strategy for sequencing proteins using the polymerase chain reaction[J].J Mol Biol,1992,226(4):1051-1072.
[26] 张永华.地黄基因RgVP、RghKAT、RglKAT与RghBNG的克隆和表达[D].新乡:河南师范大学,2013.
[27] Lopez C,Soto M,Restrepo S,etal.Gene expression profile in response toXanthomonasaxonopodispv. manihotis infection in cassava using a cDNA microarray[J]. Plant Mol Biol,2005,57(3):393-410.
[28] Huang Y J,To K Y,Yap M N,etal.Cloning and characterization of leaf senescence up-regulated genes in sweet potato[J].Physiol Plant,2001,113(3):384-391.
[29] Eybishtz A,Peretz Y,Sade D,etal.Silencing of a single gene in tomato plants resistant toTomatoyellowleafcurlvirusrenders them susceptible to the virus[J].Plant Mol Biol ,2009,71(1/2):157-171.
[30] Bamforth C W,Barclay A H P.Malting technology and the uses of malt[M]//MacGregor A W,Bhatty R S.Barley:Chemistry and technology.St Paul MN:American Association of Cereal Chemists,1993:297-354.
[31] Cassin-Ross G,Hu J.Systematic phenotypic screen ofArabidopsisperoxisomal mutants identifies proteins involved in β-oxidation[J].Plant Physiol,2014,166(3):1546-1559.
Research Progress on Cloning of Plant B12D Genes
ZHOU Yanqing,WANG Xiangnan,ZHANG Yonghua,ZHANG Yu,WANG Huina,DUAN Hongying
(College of Life Sciences,Henan Normal University,Xinxiang 453007,China)
The research progresses on the cloning,characteristics,temporal and spatial expression,subcellular localization,prokaryotic expression,overexpression,biotic and abiotic stress responses,response to ABA,GA3 and other plant growth regulators of plant B12D genes were reviewed,and the trends in the stress response mechanisms and the plant qualities improvement with B12D genes using molecular techniques were put forward.This paper provides some references for the plant improvement of quanlity and stress tolerance with B12D genes in the future.
plants; B12D gene; biotic stress; abiotic stress; gene function
2016-01-04
NSFC-河南人才培养联合基金项目(U1304304);河南省教育厅科学技术研究重点项目(14B180028)
周延清(1963-),男,河南邓州人,教授,主要从事遗传学教学、遗传与生物技术研究。E-mail:yqzhou@htu.cn
S336;Q943.2
A
1004-3268(2016)06-0001-05

